湿式催化过氧化氢氧化技术综述
罗磊,代成义,张安峰,宋春山,郭新闻
(1 大连理工大学化工学院,辽宁 大连 116024;2 宾夕法尼亚州立大学,美国 宾夕法尼亚州 16802)
引 言
水是人类及一切生物赖以生存的基础,是生产、生活不可替代的宝贵资源。近年来,随着经济的发展和人口的膨胀,工业用水和生活用水快速增长,废水的大量排放给水体安全带来了重大影响。减少污水排放、治理污染废水迫在眉睫。
目前,对废水中有机物进行氧化降解的方法众多,包括物理法、生化法、化学法等。采用传统的物理法不能有效去除污染物,而生化法对污染物种类的依耐性强,使用范围较窄。高级氧化技术(AOPs)作为新型废水处理技术,可直接矿化或提高有机污染物的可生化性,具有很好的应用前景。
高级氧化技术是利用化学反应过程中产生的氧化能力极强的羟基自由基(·OH)使大分子难降解有机物氧化为低毒或无毒的小分子,甚至直接矿化为水和二氧化碳。根据产生自由基的方式不同,可将其分为臭氧氧化技术、湿式氧化技术、催化过氧化氢氧化技术、超临界水氧化技术、光催化氧化技术及多种技术的联用等。湿式催化过氧化氢氧化技术(CWPO)是高级氧化技术中的一种,以过氧化氢为氧化剂,在不加外能辅助设备的条件下,通过加入催化剂促进过氧化氢分解生成具有更强氧化性的羟基自由基从而氧化降解有机物。1894年,英国科学家Fenton[1]发现采用Fe2+/H2O2体系能氧化多种有机物,后人为纪念他将Fe2+/H2O2称为Fenton试剂。1964年,Eisenhauer[2]首次将Fenton 试剂应用于处理苯酚和烷基苯废水,并取得了良好的效果。但是传统均相Fenton 催化体系需要在pH=2~4 才能保证活性,因此进出口水需要调节pH,导致大量污泥的产生,造成二次污染。Fajerwerg[3]于1996年首次将FeZSM-5 用于多相Fenton 体系,拓展了Fenton试剂pH 适用范围。因此,如何保证多相Fenton 体系近中性条件下的催化活性逐渐成为研究的热点。
1 湿式催化过氧化氢氧化技术原理
关于Fenton 试剂具有强氧化性有两种解释:一种是1934年Haber 等[4]首次提出的自由基机理,另一种是Bray 等[5]首先提出的高价铁氧中间体机理。两种解释的区别在于具有强氧化性的活性物种,前者认为活性物种是羟基自由基(·OH),而后者则认为具有强氧化性的是 FeO2+和 FeO3+,而不是·OH[6]。到目前为止,还没有明确的实验能够区分这两种机理,关于这两种机理的争论仍在继续。
1.1 Fenton 反应机理
羟基自由基机理是目前文献中报道较多的Fenton 反应机理。均相体系中,由Fe2+引发的链反应产生·OH,见表1。氧化还原电对Fe3+/Fe2+的氧化还原电势为0.77 eV,因此Fe2+→Fe3+的转化在热力学上是自发进行的,而Fe3+→Fe2+的转化需要耗费能量,这一过程是Fenton 反应的速率控制步骤。要提高 Fenton 试剂的活性,关键在于降低Fe3+→Fe2+转化过程的能垒,促进Fe2+的生成。
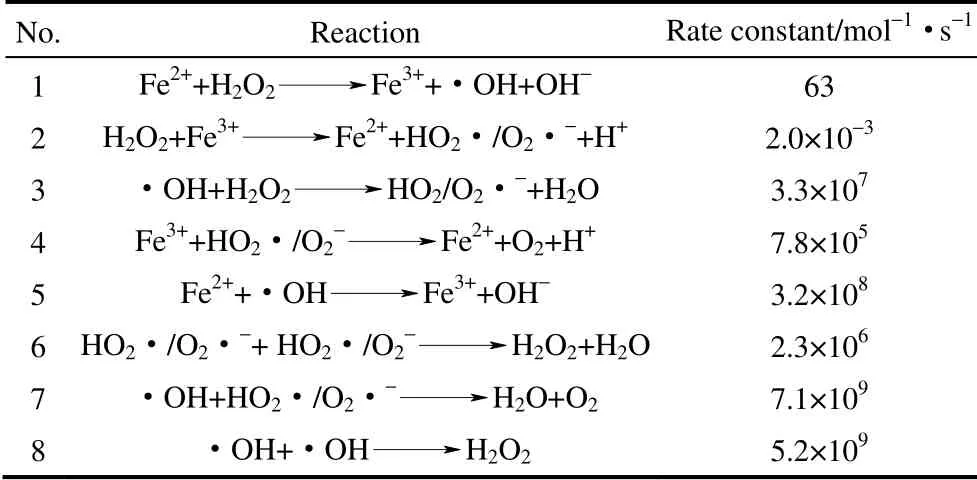
表1 Fe2+引发的链反应[7]Table 1 Chain reaction initiated by Fe2+[7]
对多相Fenton 反应而言,多相界面的存在,使得多相Fenton 催化氧化机理比均相Fenton 反应机理更加复杂。多相Fenton 催化剂组成、晶型、粒径大小、固液微界面的性质、表面形态,以及反应溶液的pH、溶剂性质等诸多因素都会影响到Fenton催化剂的催化性能。在均相溶液中,H2O2主要与溶液中的金属离子发生链反应,而在多相Fenton 催化体系中,除了H2O2与溶出金属离子的反应外,还存在界面反应。一个性能优异的多相Fenton 催化剂,应该尽可能地发挥多相催化的作用,应该保持高活性、高稳定性,即不仅催化去除污染物的效率高,而且具有尽可能低的金属离子溶出率和较好的重复使用性能。因此,高效稳定的多相Fenton 催化剂催化体系中,H2O2与催化剂之间的界面催化反应机制占据主要地位。诸多研究表明[8-12],H2O2在多相催化剂界面的分解主要有两种机制:氧空位机制和自由基机制。Lee[13]通过研究H2O2在Ln1-xAxMnO3(Ln=La 或Nd,A=K 或Sr)上的分解机制,提出了氧空位机制,即表面氧空位与H2O2作用形成吸附氧,吸附氧脱附形成氧气(O2),反应式为
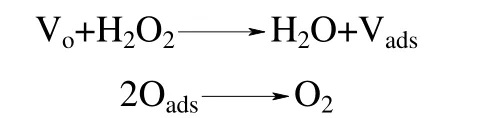
H2O2通过氧空位机制分解的产物是氧气,是无效分解步骤。要提高H2O2的有效利用率,需要经过自由基机制产生具有强氧化性的·OH。因此,高效的多相Fenton 催化剂要获得对H2O2的有效分解必定遵循自由基机制,其催化机制主要是通过催化剂表面的氧化还原反应驱动界面电子迁移,诱发H2O2分解形成羟基自由基(·OH)、超氧自由基(O2·-)等多种活性氧物种,这些活性氧物种的协同作用会产生强大无选择性的氧化能力,对水体中难降解有机污染物实现高效无机矿化。H2O2在含过渡金属或金属氧化物的催化剂表面分解的自由基机制可以简单地表示如下
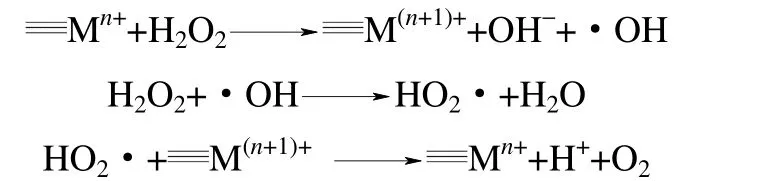
依据多相Fenton 催化体系H2O2分解的自由基反应机制,界面电子迁移循环的速率是反应的关键。诸多研究[14-19]通过不同氧化还原电对之间的电子转移来活化H2O2产生。因此,通过构筑不同的氧化还原电对,对催化剂表面结构特性进行调控,强化界面电子转移速率,可以提高Fenton 催化系统的催化效率。
1.2 羟基自由基的性质
Fenton 反应通过·OH 对有机污染物进行降解,因此研究·OH 的性质对研究Fenton 试剂具有重要意义。羟基自由基具有如下重要特性:①具有极强的氧化性,其氧化性仅次于F2(表2)[20],能从富含电子的有机物或其他介质中夺取一个电子而形成OH-。·OH 的氧化能力随pH 的变化而变化,在pH=3和pH=14 时,其氧化能力分别为2.8 V 和1.9 V[21]。同时,由于氢氧键(O—H)键能通常大于碳氢键(C—H),因此·OH 能够破坏碳氢化合物的碳氢键并从中夺取一个氢原子。·OH 的高氧化性及氢氧键的强键能保证了·OH 能够轻易地攻击任何有机物[20]。②H2O2作为氧化剂不产生二次污染。过氧化氢本身是一种环境友好型试剂,其分解产物为水和氧气,不会造成二次污染。
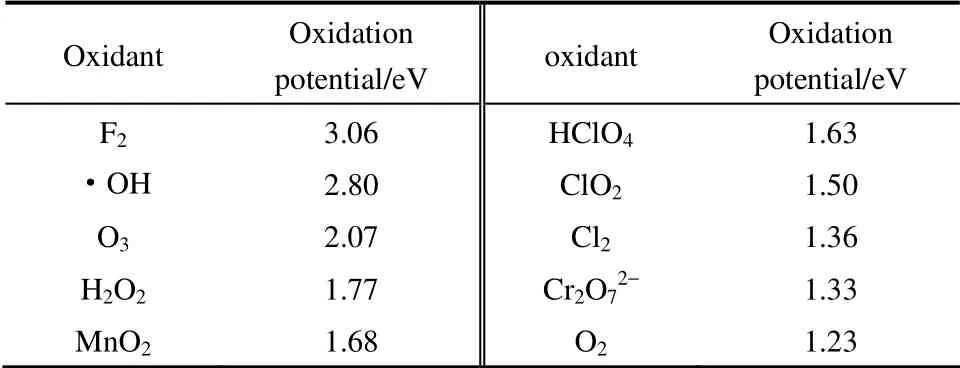
表2 常见氧化剂的标准电极电位[20]Table 2 Standard electrode potential for common oxidants[20]
2 湿式催化过氧化氢氧化催化剂的研究现状
影响Fenton 催化剂活性的因素包括温度、pH、H2O2加入量、催化剂、反应时间、废水性质。而催化剂的研发是催化过氧化氢氧化技术的关键。在Fenton 反应中应用最多的是Fe[22]、Cu[23]、Ni[24]、Co[25]、Mn[26]和Cr[27]6 种元素,它们既可以作为活性组分单独使用,也可以与多种金属共同起催化作用;同时,金属存在形式多样,既可以使用金属氧化物直接催化,也可以担载在不同的载体上起催化作用。目前,多相Fenton 催化剂存在的问题主要是催化剂的活性和稳定性问题。
2.1 Fenton 催化剂活性的提升
影响Fenton 催化剂活性的主要原因在于铁物种循环过程中Fe2+的生成。
2.1.1 过渡金属 过渡金属如零价铁(Fe0)在酸性条件下与H2O2反应生成Fe2+并促进Fe2+再生。Segura 等[28]研究了Fe0/H2O2体系对苯酚的降解活性,认为Fe0/H2O2体系优于经典的Fenton 体系。Chu 等[29]利用Fe0/H2O2体系处理焦化废水,在pH<6.5,H2O2浓度0.3 mol·L-1的条件下,反应1 h,COD 去除率可达到44%~50%。Bokare 等[30]在研究Al0/O2体系降解有机污染物如4-氯酚、苯酚、硝基苯和二氯乙酸等时发现Al0转移电子到O2导致H2O2的形成,H2O2从Al0得到电子形成·OH,也能够降解有机物。此外,Au0[12]在湿式催化过氧化氢氧化降解有机污染物如苯酚也显示出较高的催化活性。
2.1.2 铁氧化物及其他金属复合氧化物 过渡金属氧化物也可以作为多相Fenton 催化剂催化H2O2分解产生·OH。单纯的金属氧化物作为催化剂时,由于反应仅在固液界面发生,所以提高催化剂活性除了考虑Fe 物种的循环外,还需要考虑Fe 物种的分散状态,增大其比表面积以促进活性位的暴露。Zhu等[31]、Hou 等[32]使用多孔磁铁矿降解二甲酚橙、苯酚,发现多孔结构能够有效提高催化活性。Luo 等[33]通过PEI修饰的介孔ZSM-5 作为载体成功制备了负载型高分散Fe3O4,并用于氧化降解苯酚,结果表明,将金属活性组分纳米化对提高Fenton 反应活性具有积极影响。Zboril 等[34]对不同结晶度和比表面积的α-Fe2O3的多相Fenton 体系进行了研究,发现结晶度对Fenton 反应催化活性影响较大。
为了提高金属氧化物的Fenton 反应活性,除了调控金属氧化物比表面积和相对结晶度外,许多研究通过掺杂其他过渡金属阳离子或通过H2热还原等方式对铁氧化物进行修饰。Costa 等[8,35]通过H2程序升温还原制备了对亚甲基蓝具有高催化活性的Fe0/Fe3O4复合物(图1),并且在2 h 内COD 去除率即能达到75%。与单纯Fe0或铁氧化物相比,不同价态金属或金属氧化物的复合物能够明显提高Fenton 反应活性。但是在还原气氛中制备的复合氧化物性能活泼,在空气中不能稳定存在,容易被氧化失活。而通过向铁氧化物中掺杂其他过渡金属元素得到的复合物往往具有更好的稳定性。同时,利用不同金属对(Cu2+/Cu+, Co3+/Co2+, Mn3+/Mn2+, Cr3+/Cr2+等)氧化还原电势的差异,调控Fe3+→Fe2+的催化循环,能够提高Fenton 反应活性。Wang等[18]、Luo 等[15]通过使用FeCu 双金属作为活性组分催化Fenton 反应,结果表明,双金属催化剂的活性明显优于单组分Fe 或Cu 催化剂。其主要原因是氧化还原电对Cu2+/Cu+的引入,使Fe3+→Fe2+的转化途径转化为Fe3++Cu+→Fe2++Cu2+,氧化还原电势由0.77 eV 降低为0.60 eV,从而提高了催化活性。Liu 等[17]通过浸渍法制备了Fe-Ce/Al2O3,并用于氧化降解间苯酚,结果表明,Ce 负载量为2.0%时催化活性最好,Ce 的加入能够增加催化剂表面非晶格氧的含量,进而提高催化剂的催化活性。
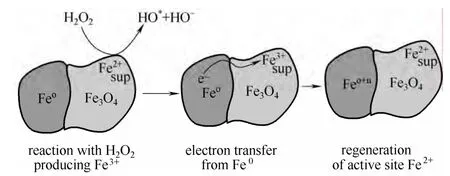
图1 Fe0 将电子传输给Fe3+再生Fe2+的示意图Fig.1 Schematic representation of electron transfer from Fe0 to Fe3+ magnetite to regenerate Fe2+
2.1.3 其他金属氧化物 除了含铁氧化物对多相Fenton 反应具有催化活性外,国内外研究者还成功研制了不含铁的氧化物,并将其用于多相Fenton 反应体系。Yang 等[36]、Rhadfi 等[37]通过比较不同锰氧化物在亚甲基蓝催化降解中的活性,发现β-MnO2和纳米化的Mn3O4均具有较高的催化活性。Zhan等[38-39]、Chen 等[19]使用含铜催化剂对偶氮染料和亚甲基蓝进行脱色处理,发现含铜催化剂是具有Fenton 反应活性的,但催化剂的流失是含铜催化剂的重要缺陷。除此之外,Ce[17,40]、Ni[41]、Co[41]、Cr[16]等也具有Fenton 反应活性。
2.2 多相Fenton 试剂的稳定性
催化剂表面吸附、沉积和催化剂活性组分流失是造成CWPO 催化剂失活的主要原因。一般情况下,过渡金属催化剂失活是由活性组分流失引起的。过渡金属担载在载体上时容易造成催化剂的流失,而添加少量的催化剂助剂有助于改善催化剂的晶体结构及表面性质,可以抑制过渡金属的流失,提高催化剂的活性和稳定性[42]。
对于金属的流失问题,主要来源于有机物降解过程中产生的无机酸中间物种,使得反应体系的pH降低,从而刻蚀金属颗粒,导致金属离子的流失。因此,要减少Fenton 试剂金属流失,既可以提高催化剂的耐酸性,也可以促进产物扩散,减少酸性中间物种与催化剂的直接接触。利用有序介孔材料SBA-15 孔道的限域作用,控制生长高分散双金属Fe-Cu[18,43]、Pd-Fe[14]等催化剂颗粒,并嵌在SBA-15壁上,不仅能够提高金属分散度,同时金属流失得到抑制。对金属进行包覆,隔离金属组分与反应液,能够明显提高催化剂耐酸性[44]。Yan 等[45]使用浸渍法制备的FeZSM-5 在固定床上催化苯酚降解反应,结果表明,催化剂具有较好的重复使用性能和抗流失性能。除此之外,使用非金属催化剂是解决金属流失的重要手段之一。Fortuny 等[46]、Chang 等[47]使用活性炭和g-C3N4作催化剂降解苯酚和亚甲基蓝,发现非金属催化剂也可以用于催化降解有机污染物。
3 结 论
湿式催化过氧化氢氧化技术作为有别于光、电、微波等辅助的Fenton 体系,具有无须外能辅助、反应条件温和、经济环保等优点,在印染、农药、医药等领域具有很好的应用前景和极大的推广价值。但目前,湿式催化过氧化氢氧化技术尚存在一些问题需要解决。首先,对多相Fenton 反应的机理认识不够明确,尤其是高价铁氧中间体机理,需要深入研究。其次,如何提高催化剂氧化降解能力,如何有效防止活性组分流失,提高催化剂的稳定性和重复性,都是亟待解决的问题。
[1]Fenton.Oxidation of tartaric acid in presence of iron [J].J.Chem.Soc., 1894, 65: 899-910.
[2]Eisenhauer H R.Oxidation of phenolic wastes [J].Water Pollution Control Federation, 1964, 9(36): 1116-1128.
[3]Fajerwerg K D H.Wet oxidation of phenol by hydrogen peroxide using heterogeneous catalysis Fe-ZSM-5: a promising catalyst [J].Appl.Catal.B, 1996, 10(4): L229-L235.
[4]Haber F, Weiss J.Über die katalyse des hydroperoxydes [J].Naturwissenschaften, 1932, 20(51): 948-950.
[5]Bray W C, Gorin M H.Ferrylion a compound of tetravalent iron [J].J.Am.Chem.Soc., 1932, 54(5): 2124-2125.
[6]Ensing B, Buda F, Baerends E J.Fenton-like chemistry in water oxidation catalysis by Fe(Ⅲ) and H2O2[J].J.Phys.Chem.A, 2003, 107(30): 5722-5731.
[7]Hartmann M, Kullmann S, Keller H.Wastewater treatment with heterogeneous Fenton-type catalysts based on porous materials [J].J.Mater.Chem., 2010, 20(41): 9002-9017.
[8]Costa R C C, Moura F C C, Ardisson J D, et al.Highly active heterogeneous Fenton-like systems based on Fe0/Fe3O4composites prepared by controlled reduction of iron oxides [J].Appl.Catal.B, 2008, 83(1/2): 131-139.
[9]Munoz M, de Pedro Z M, Casas J A, et al.Preparation of magnetite-based catalysts and their application in heterogeneous Fenton oxidation∶ a review [J].Appl.Catal.B, 2015, 176/177: 249-265.
[10]Satishkumar G, Landau M V, Buzaglo T, et al.Fe/SiO2heterogeneous Fenton catalyst for continuous catalytic wet peroxide oxidation prepared in-situ by grafting of iron released from LaFeO3[J].Appl.Catal.B, 2013, 138/139: 276-284.
[11]Yang X, Tian P, Zhang X, et al.The generation of hydroxyl radicals by hydrogen peroxide decomposition on FeOCl/SBA-15 catalysts for phenol degradation [J].AIChE J., 2015, 61(1): 166-176.
[12]Quintanilla A, García-Rodríguez S, Domínguez C M, et al.Supported gold nanoparticle catalysts for wet peroxide oxidation [J].Appl.Catal.B, 2012, 111/112: 81-89.
[13]Lee Y.Hydrogen peroxide decomposition over Ln1-xAxMnO3(Ln=Laor Nd and A=K or Sr) perovskites [J].Appl.Catal.A, 2001, 215(1/2): 245-256.
[14]Li X, Liu X, Xu L, et al.Highly dispersed Pd/PdO/Fe2O3nanoparticles in SBA-15 for Fenton-like processes: confinement and synergistic effects [J].Appl.Catal.B, 2015, 165: 79-86.
[15]Luo L, Dai C, Zhang A, et al.A facile strategy for enhancing FeCu bimetallic promotion for catalytic phenol oxidation [J].Catal.Sci.Technol., 2015, 5: 3159-3165.
[16]Wei G, Liang X, He Z, et al.Heterogeneous activation of oxone by substituted magnetites Fe3-xMxO4(Cr, Mn, Co, Ni) for degradation of acid orange II at neutral pH [J].J.Mol.Catal.A, 2015, 398: 86-94.
[17]Liu P, He S, Wei H, et al.Catalytic wet peroxide oxidation of m-cresol over Fe-Ce/Al2O3catalyst [J].Chem.Pap., 2015, 69(6): 827-838.
[18]Wang Y, Zhao H, Zhao G.Iron-copper bimetallic nanoparticles embedded within ordered mesoporous carbon as effective and stable heterogeneous Fenton catalyst for the degradation of organic contaminants [J].Appl.Catal.B, 2015, 164: 396-406.
[19]Chen X, Ma C, Li X, et al.Hierarchical Bi2CuO4microspheres: hydrothermal synthesis and catalytic performance in wet oxidation of methylene blue [J].Catal.Commun., 2009, 10(6): 1020-1024.
[20]Navalon S, Alvaro M, Garcia H.Heterogeneous Fenton catalysts based on clays, silicas and zeolites [J].Appl.Catal.B, 2010, 99(1/2): 1-26.
[21]Chen A, Ma X, Sun H.Decolorization of KN-R catalyzed by Fe-containing Y and ZSM-5 zeolites [J].J.Hazard.Mater., 2008, 156(1/2/3): 568-575.
[22]Wang Y, Sun H, Duan X, et al.A new magnetic nano zero-valent iron encapsulated in carbon spheres for oxidative degradation of phenol [J].Appl.Catal.B, 2015, 172/173: 73-81.
[23]Kim S, Ginsbach J W, Lee J Y, et al.Amine oxidative n-dealkylation via cupric hydroperoxide Cu-OOH homolytic cleavage followed by site-specific Fenton chemistry [J].J.Am.Chem.Soc., 2015, 137(8): 2867-2874.
[24]Civan F, Özaltun DH, Klpçak E, et al.The treatment of landfill leachate over Ni/Al2O3by supercritical water oxidation [J].J.Supercrit.Fluids, 2015, 100: 7-14.
[25]Costa D A S, Oliveira A A S, de Souza P P, et al.The combined effect between Co and carbon nanostructures grown on cordierite monoliths for the removal of organic contaminants from the liquid phase [J].New.J.Chem., 2015, (39): 1438-1444.
[26]Qu J, Shi L, He C, et al.Highly efficient synthesis of graphene/MnO2hybrids and their application for ultrafast oxidative decomposition of methylene blue[J].Carbon, 2014, 66: 485-492.
[27]Zhong Y, Liang X, He Z, et al.The constraints of transition metal substitutions (Ti, Cr, Mn, Co and Ni) in magnetite on its catalytic activity in heterogeneous Fenton and UV/Fenton reaction: from the perspective of hydroxyl radical generation [J].Appl.Catal.B, 2014, 150/151: 612-618.
[28]Segura Y, Martínez F, Melero J A, et al.Enhancement of the advanced Fenton process (Fe0/H2O2) by ultrasound for the mineralization of phenol [J].Appl.Catal.B, 2012, 113/114: 100-106.
[29]Chu L, Wang J, Dong J, et al.Treatment of coking wastewater by an advanced Fenton oxidation process using iron powder and hydrogen peroxide [J].Chemosphere, 2012, 86(4): 409-414.
[30]Bokare A D, Choi W.Zero-valent aluminum for oxidative degradation of aqueous organic pollutants [J].Environ.Sci.Technol., 2009, 43(18): 7130-7135.
[31]Zhu M, Diao G.Synthesis of porous Fe3O4nanospheres and its application for the catalytic degradation of xylenol orange [J].J.Phys.Chem.C, 2011, 115(39): 18923-18934.
[32]Hou L, Zhang Q, Jérôme F, et al.Shape-controlled nanostructured magnetite-type materials as highly efficient Fenton catalysts [J].Appl.Catal.B, 2014, 144: 739-749.
[33]Luo L, Dai C, Zhang A, et al.Facile synthesis of zeolite-encapsulated iron oxide nanoparticles as superior catalysts for phenol oxidation [J].RSC Adv., 2015, 5(37): 29509-29512.
[34]Hermanek M, Zboril R, Medrik I, et al.Catalytic efficiency of iron(Ⅲ) oxides in decomposition of hydrogen peroxide: competition between the surface area and crystallinity of nanoparticles [J].J.Am.Chem.Soc., 2007, 129(35): 10929-10936.
[35]Moura F, Oliveira G, Araujo M, et al.Highly reactive species formed by interface reaction between Fe0-iron oxides particles: an efficient electron transfer system for environmental applications [J].Appl.Catal.A, 2006, 307(2): 195-204.
[36]Yang Z, Zhang Y, Zhang W, et al.Nanorods of manganese oxides: synthesis, characterization and catalytic application [J].J.Solid.State.Chem., 2006, 179(3): 679-684.
[37]Rhadfi T, Piquemal J, Sicard L, et al.Polyol-made Mn3O4nanocrystals as efficient Fenton-like catalysts [J].Appl.Catal.A, 2010, 386(1/2): 132-139.
[38]Zhan Y, Li H, Chen Y.Copper hydroxyphosphate as catalyst for the wet hydrogen peroxide oxidation of azo dyes [J].J.Hazard.Mater., 2010, 180(1/2/3): 481-485.
[39]Zhan Y, Zhou X, Fu B, et al.Catalytic wet peroxide oxidation of azo dye (direct blue 15) using solvothermally synthesized copper hydroxide nitrate as catalyst [J].J.Hazard.Mater., 2011, 187(1/2/3)∶ 348-354.
[40]Chen F, Shen X, Wang Y, et al.CeO2/H2O2system catalytic oxidation mechanism study via a kinetics investigation to the degradation of acid orange 7 [J].Appl.Catal.B, 2012, 121/122: 223-229.
[41]Jablonski J.High temperature reduction with hydrogen, phase composition, and activity of cobalt/silica catalysts [J].J.Catal., 2003, 220(1)∶ 146-160.
[42]Liu Y, Sun D.Effect of CeO2doping on catalytic activity of Fe2O3/γ-Al2O3catalyst for catalytic wet peroxide oxidation of azo dyes [J].J.Hazard.Mater., 2007, 143(1/2): 448-454.
[43]Wang Y, Zhao H, Li M, et al.Magnetic ordered mesoporous copper ferrite as a heterogeneous Fenton catalyst for the degradation of imidacloprid [J].Appl.Catal.B, 2014, 147: 534-545.
[44]Lu A, Salabas E L, Schüth F.Magnetic nanoparticles: synthesis, protection, functionalization, and application [J].Angew.Chem.Int.Ed., 2007, 46(8): 1222-1244.
[45]Yan Y, Jiang S, Zhang H.Efficient catalytic wet peroxide oxidation of phenol over Fe-ZSM-5 catalyst in a fixed bed reactor [J].Sep.Purif.Technol., 2014, 133: 365-374.
[46]Fortuny A, Font J, Fabregat A.Wet air oxidation of phenol using active carbon as catalyst [J].Appl.Catal.B, 1998, 19: 166-173.
[47]Chang F, Xie Y, Li C, et al.A facile modification of g-C3N4with enhanced photocatalytic activity for degradation of methylene blue [J].Appl.Surf.Sci., 2013, 280: 967-974.

