HIF-1α及靶基因在糖尿病小鼠创面愈合过程中基因表达的研究及意义
景丽峰, 李 勤, 李 爽
HIF-1α及靶基因在糖尿病小鼠创面愈合过程中基因表达的研究及意义
景丽峰, 李 勤, 李 爽
目的 通过研究BALB/c糖尿病小鼠创面愈合过程中HIF-1α、VEGF、SDF-1a和CXCR4在不同时间点的基因表达情况,从血管生成的调控方面探讨糖尿病创面难愈的机制。方法 建立糖尿病小鼠模型后4周,建立小鼠背部皮肤正中近颈侧直径约6 mm的圆形皮肤全层缺损模型,分别于伤后即刻,3、7、10 d获取创面组织,计算创面的愈合率,检测损伤后各时间点HIF-1α、VEGF、SDF-1a和CXCR4的基因相对表达量。结果 糖尿病组小鼠的创面愈合率第3、7、10天,分别为(7.0±5.8)%、(38.7±6.0)%、(80.0±3.0)%,明显小于对照组;创伤前糖尿病组小鼠皮肤中的目的基因表达量低于对照组;创伤后对照组和糖尿病组小鼠皮肤中目的基因表达量较创伤前明显增加,于第3或7天时表达量达高峰,但糖尿病组小鼠的表达量总体低于对照组,有统计学意义(P<0.05)。结论 糖尿病组小鼠创面愈合过程中,HIF-1α、VEGF、SDF-1a和CXCR4的基因表达水平降低,导致血管形成不足,可能是糖尿病创面愈合延迟的原因之一。
糖尿病创面;HIF-1α;VEGF;SDF-1α;CXCR4;
缺氧诱导因子1α(hypoxia inducible factor 1 α, HIF-1α)作为一种核转录因子,调控多种靶基因的表达,参与机体能量代谢、血管生成、细胞增殖和迁移、细胞凋亡等病理生理过程,在创面愈合过程中发挥了重要作用[1-2]。自2013年4月至2013年12月,我们以BALB/c正常小鼠创面与糖尿病创面为研究对象,观察不同时段创面和创缘组织中HIF-1α、VEGF、基质细胞衍生生长因子-1(stromal cell derived growth factor-1,SDF-1α)、CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)基因水平的变化,从血管生成的调控方面探讨糖尿病创面难愈的机制。
1 材料与方法
1.1 实验动物 BALB/c小鼠50只,6周龄,SPF级,雌雄比例1∶1,体质量(20±2) g,由广州军区广州总医院实验动物中心提供。动物房灯光12 h照明,通风和空调设备良好,室温控制在(24±2) ℃,相对湿度为40%~50%。动物饲养1周后,开始造模实验,实验室按常规定期消毒。实验过程对动物的操作符合医学伦理学标准。
1.2 主要试剂与仪器 STZ(美国SIGMA公司), Tripure(中国聚研公司),逆转录试剂盒和SYBR GreenⅠ荧光染料(美国ROCHE公司),HIF-1 alpha Ab(美国GENE TEX公司),VEGF Ab(美国MILLIPORE公司), SDF1 Ab(美国CST公司), CXCR4 Ab(美国MILLIPORE公司),β-actin Ab(美国EARTH OX公司), Rabbit IgG HRP Ab(美国CST公司),实时荧光定量PCR仪、电泳仪及化学发光成像系统(德国BIORAD公司)。
2 实验过程
2.1 建立糖尿病模型 BALB/c小鼠50只随机分为对照组和糖尿病组各25只,禁食14~16 h,每天腹腔注射1%STZ(40 mg/kg, 糖尿病组)及等体积柠檬酸缓冲液(对照组0.1 mmol/L,pH 4.4),连续注射5 d,所有小鼠注射后均采取自由饮食饮水。注射STZ 1周后断尾采血,随机血糖水平≥16.7 mmol/L即为造模成功, 待模型稳定后(1个月)用于后续实验[3-4]。
2.2 标本采取 腹腔注射麻醉后,于小鼠背部近颈侧以脊柱为中线,用打孔器切取直径约6 mm 的圆形全层皮肤;创面不用任何药物,常规单独饲养,分别于创伤后即刻,3、7、10 d,切取两组小鼠的创面及创缘全层皮肤组织,用液氮冻存,进行分子生物学检测。
2.3 计算创面愈合率 记录两组小鼠创伤后即刻、3、7、10 d时创面面积。采用两种方法:①用数码相机按设置的统一参数,直接拍摄小鼠创面区域(含有标尺)。将图片中的创面部分,使用IPP(Image-Pro Plus)图像处理软件测量其面积。②使用薄膜手套覆盖创面,描记其大小,同样的方法测量面积。计算各组创面愈合率:

2.4 引物设计 基因序列采用NCBI自行设计,同时经NCBI BLAST 检索,无显著同源性。引物由英潍捷基(上海)贸易有限公司合成,具体引物序列和扩增产物片段长度见表1。
2.5 荧光定量PCR检测目的基因表达 取小鼠皮肤组织,按TriPure试剂说明书分离总RNA,紫外分光光度计测定RNA浓度,A260/280比值判定纯度。经反转录试剂盒合成cDNA 后,再进行特定引物PCR扩增。PCR 扩增采用20 μl 反应体系:灭菌蒸馏水7 μl,2×SYBR Green I Master 10 μl,10 μM上、下游引物各0.6 μl,DNA 模板2 μl,轻轻混匀后稍微离心。扩增条件:95 ℃预变性10 min,95 ℃ 15 s,58 ℃ 30 s,72 ℃ 30 s,40个循环。数据的收集由Rotor-gene 6000定量PCR仪自带软件完成。目的基因的相对表达量计算公式:
△Ct=Ct目的基因-Ct管家基因
注:△Ct高表示基因表达量低
2.6 Western Blot检测目的蛋白表达 按照Western及IP细胞裂解液说明书(P0013),提取各时间点创面及创缘组织的总蛋白,BCA法测定蛋白浓度。然后电泳,转膜,一抗4 ℃孵育过夜,TBST洗膜10 min,3次;二抗室温摇床孵育1 h,TBST洗膜10 min,3次;ECL显色后化学发光成像系统成像。以Quantity One 图像分析软件扫描计算灰度值。
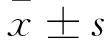

表1 基因序列及基因序列数据
3 结果
3.1 一般情况 建立糖尿病模型后,糖尿病组小鼠血糖升高,饮食量、尿量明显增多,体重逐渐下降。对照组小鼠血糖正常,饮食、大小便等在给药前后,均未见明显差别,体质量逐渐增加。
3.2 创面愈合率 在创伤愈合过程中,糖尿病小鼠的创面愈合延迟,创面愈合率于3、7、10 d时分别为(7.0±5.8)%、(38.7±6.0)%、(80.0±3.0)%,明显小于对照组小鼠,差异有统计学意义(P<0.05,表2)。
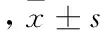
表2 小鼠皮肤创伤后创面愈合率
注:*与对照组相比,P<0.05
3.3 小鼠皮肤中HIF-1α等基因mRNA相对表达水平的变化 创伤前糖尿病小鼠皮肤中HIF-1α、VEGF、SDF-1、CXCR4mRNA表达量低于对照组;创伤后对照组和糖尿病组小鼠皮肤中HIF-1α、VEGF、SDF-1、CXCR4mRNA表达量,较创伤前明显增加,于3d或7d时表达量达高峰,但糖尿病小鼠的表达量总体低于对照组,有统计学意义(P<0.05,表3)。
3.4 小鼠皮肤中HIF-1α等目的蛋白表达水平 通过WesternBlot检测糖尿病小鼠皮肤中HIF-1α,表达水平低于对照组,差异有统计学意义(P<0.05)。创伤后3、7d,所有目的基因的蛋白水平表达低于对照组;10d时,VEGF、SDF-1andCXCR4蛋白水平表达低于对照组,差异有统计学意义(P<0.05)。创伤后对照组和糖尿病组小鼠的各种目的蛋白表达量,较创伤前明显增加,基本上是3、7d时表达量达高峰,随之降至创伤前水平。
4 讨论
在血管的发育过程中,HIF1对血管新生起着至关重要的作用。HIF1是一个异二聚体复合物,由HIF1a和HIF1β亚基构成[5]。HIF1a决定了HIF1 的活性,在正常氧浓度条件下,HIF1a被脯氨酸羟化酶羟化后降解;在缺氧条件下,HIF1a通过核定位信号介导入细胞核,激活下游基因表达,对机体内的一系列因素进行调节,涉及适应和生存机制[6]。HIF-1调控的生成血管的生长因子和细胞因子众多,包括血管生成素、VEGF、SDF-1、CXCR4和血小板源性生长因子(platelet-derived growth factor, PDGF)等[4]。该实验发现,糖尿病小鼠皮肤中HIF-1α及靶基因的表达水平降低,创面愈合延迟。这是因为过高的葡萄糖浓度会导致超氧化物增加,进一步诱导丙酮醛在细胞中积累,导致HIF-1α聚泛素化和降解,最终降低HIF-1α蛋白水平;丙酮醛可以阻碍HIF-1α/p300转录复合物的形成,从而降低HIF-1 的转录活性[7]。糖尿病创面中HIF-1减少,导致众多下游靶基因的表达减少或功能减退,造成血管密度下降,血液循环不良和伤口愈合障碍,这在糖尿病动物模型以及Ⅰ、Ⅱ型糖尿病患者的临床试验中也被证实[8]。
本实验结果表明,小鼠皮肤创伤后正常创面和糖尿病创面中HIF-1a的表达量增加,继而VEGF等靶基因的表达量也增加,总体上于3、7 d表达量达高峰。创伤后局部低氧微环境可通过PI3K/Akt信号通道激活核因子κB,其亚基可结合HIF-1α启动子,导致HIF-1α mRNA表达增加[9]。在PKC和PI3K/AKT信号通路中使用化学抑制剂的实验中发现:这两个信号会相互促进,参与保护HIF-1α以免pVHL降解,导致HIF1α表达增加[10]。HIF-1α以及靶基因表达量总体上于3、7 d时表达明显增加,表明HIF-1及靶基因的表达与创面愈合的增殖期关系密切。这可能是因为创伤后3~7 d属于创面愈合的增殖期,此期以创面肉芽组织形成为特征,并逐渐上皮化,新生血管内皮细胞和成纤维细胞都是 VEGF、SDF-1的重要来源[11]。另外,我们认为创伤初期低氧环境激活了Akt/HIF-1/靶基因信号途径,随着低氧环境逐渐改善,HIF-1α降解增加,HIF-1及靶基因的表达随之减少。冯帅南和Liu等[12-13]也发现,创伤后HIF-1α、VEGF、SDF-1α表达升高,4、7 d时达到高峰。
综上所述,糖尿病小鼠创面愈合过程中,HIF-1α、VEGF、SDF-1α及CXCR4的总体表达水平降低,导致血管形成不足,可能是糖尿病创面愈合延迟的原因之一。HIF-1基因治疗慢性肢体缺血的研究,已进展到临床Ⅰ期药物剂量测试性实验 ,因此,随着对HIF-1更加深入地研究,会有疗效良好的HIF-1调节剂应用于临床,促进糖尿病创面的愈合。
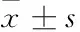
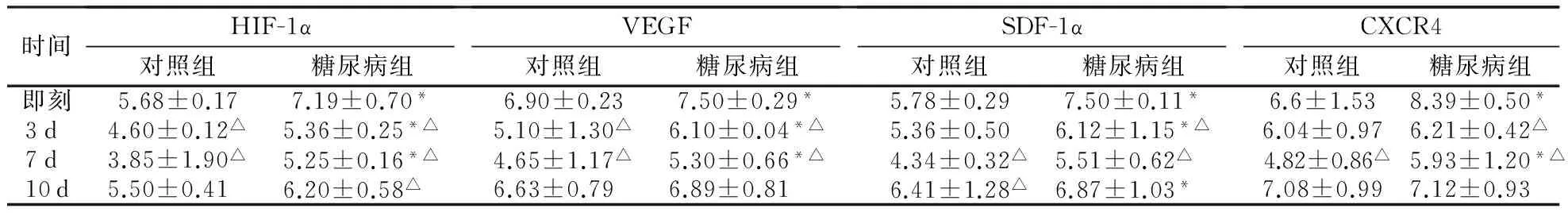
时间HIF-1α对照组糖尿病组VEGF对照组糖尿病组SDF-1α对照组糖尿病组CXCR4对照组糖尿病组即刻5.68±0.177.19±0.70*6.90±0.237.50±0.29*5.78±0.297.50±0.11*6.6±1.538.39±0.50*3d4.60±0.12△5.36±0.25*△5.10±1.30△6.10±0.04*△5.36±0.506.12±1.15*△6.04±0.976.21±0.42△7d3.85±1.90△5.25±0.16*△4.65±1.17△5.30±0.66*△4.34±0.32△5.51±0.62△4.82±0.86△5.93±1.20*△10d5.50±0.416.20±0.58△6.63±0.796.89±0.816.41±1.28△6.87±1.03*7.08±0.997.12±0.93
注:*与对照组比较P<0.05;△与伤后即刻比较P<0.05
[1]SenCK.Woundhealingessentials:lettherebeoxygen[J].WoundRepairRegen, 2009,17(1):1-18.
[2]BotusanIR,SunkariVG,SavuO,etal.StabilizationofHIF-1iscriticaltoimprovewoundhealingindiabeticmice[J].ProcNatlAcadSciUSA, 2008,105(49):19426-19431.
[3]SrinivasanK,ViswanadB,AsratL,etal.Combinationofhigh-fatdiet-fedandlow-dosestreptozotocin-treatedrat:amodelfortype2diabetesandpharmacologicalscreening[J].PharmacolRes, 2005,52(4):313-320.
[4]SemenzaGL.HIF-1:mediatorofphysiologicalandpathophysiologicalresponsestohypoxia[J].JApplPhysiol, 2000,88(4):1474-1480.
[5]AndrikopoulouE,ZhangX,SebastianR,etal.CurrentInsightsintotheRoleofHIF-1inCutaneousWoundHealing[J].CurrentMolecularMedicine, 2011,11(3),218-235.
[6]SemenzaGL.Hypoxia-induciblefactor1:oxygenhomeostasisanddiseasepathophysiology[J].TrendsMolMed, 2001,7(8):345-350.
[7]ThangarajahH,VialIN,GroganRH,etal.HIF-1alphadysfunctionindiabetes[J].CellCycle, 2010,9(1):75-79.
[8]MaceKA,YuDH,PaydarKZ,etal.SustainedofHIF-1αinthediabeticenvironmentpromotesangiogenesisandcutaneouswoundrepair[J].WoundRepairRegen, 2007,15(5):636-664.
[9]BelaibaRS,BonelloS,SchmidtS,etal.Hypoxiaup-regulateshypoxia-induciblefactor-1transcriptionbyinvolvingphosphatidylinositol3 -KinaseandnuclearfactorkappaBinpulmonaryarterymusclecells[J].MolBiolCell, 2007,18(12):4691-4697.
[10]YunSP,LeeMY,RyuJM,etal.RoleofHIF-1alphaandVEGFinhumanmesenchymalstemcellproliferationby17beta-estradiol:involvementofPKC,PI3K/Akt,andMAPKs[J].AmJPhysiolCellPhysiol, 2009,296:C317-C326.
[11]CeradiniDJ,KulkarniAR,CallaghanMJ,etal.ProgenitorcelltraffickingisregulatedbyhypoxicgradientsthroughHIF-1inductionofSDF-1[J].NatMed, 2004,10(8):858-864.
[12] 冯帅南, 黄 宏, 张 波, 等. 小鼠全层皮肤创伤愈合过程中基质细胞衍生因子-1及其受体CXCR4 基因表达的研究[J]. 感染·炎症·修复, 2008,9(3):141-145.
[13]LiuL,MartiGP,WeiX,etal.Age-dependentimpairmentofHIF-1alphaindiabeticmice:Correctionwithelectroporation-facilitatedgenetherapyincreaseswoundhealing,angiogenesis,andcirculatingangiogeniccells[J].JCellPhysiol, 2008,217(2):319-327.
Expression of HIF-1 α and target genes in wound of diabetic mice and its significance
JINGLi-feng,LIQin,LIShuang.
(DepartmentofPlasticSurgery,GeneralHospitalofGuangzhouMilitaryCommand,Guangzhou510010,China)
Objective To investigate the expression of HIF-1α、VEGF、SDF-1α and CXCR4 mRNA at each time point during wound healing in BALB/c mice, probing mechanism of difficult healing of diabetic wound base on regulation of vascularization. Methods A full thickness round wound of 6 mm diameter was established on the back of mice at 4 weeks after the STZ injection. The skin specimens were harvested at 0、3、7、10 days after injury respectively and wound healing rate was calculated. The endogenous expressions of HIF-1α、VEGF、SDF-1α and CXCR4 mRNA and protein were measured by quantitative real-time reverse transcription polymerase chain reaction (qRT-PCR) and Western blot analysis. Results The wound healing of diabetic mice was significantly less than normal mice (P<0.05),woundhealingrateof3、7、10dayswas(7.0±5.8)%, (38.7±6.0)%and(80.0±3.0)%,respectively,whichwerelowerthanthatinthecontrolgroup.ThemRNAexpressionofHIF-1α、VEGF、SDF-1、CXCR4indiabeticgroupwassignificantlylowerthanthatinnormalmicebeforeinjury(P<0.05).Theexpressionofobjectivegeneafterinjurywashigherthanthatbeforeinjury(P<0.05),basicallyitreachedthepeakat3and7days,butthetotalexpressionwaslowerthanthatinthecontrolgroup(P<0.05),whichhadthestatisticalsignificance. Conclusion The expression level of HIF-1α、VEGF、SDF-1α and CXCR4 decreased during wound healing of diabetic mice, resulting in insufficient angiogenesis, which may be a reason for the delay in diabetic wound healing.
Diabetic wound; HIF-1α; VEGF; SDF-1α; CXCR4
510010 广东 广州,广州军区广州总医院 整形外科
景丽峰(1986-),男,山西人,硕士.
10.3969/j.issn.1673-7040.2015.04.016
R
A
1673-7040(2015)04-0239-04
2014-11-21)

