骨性关节炎患者膝关节软骨及软骨下骨中miR-214的表达
余晓明,袁雪凌,孟昊业,孙 振,尹合勇,郭全义,彭 江,汪爱媛,卢世璧解放军总医院 骨科研究所,北京 00853;南开大学,天津 30007
骨性关节炎(osteoarthritis,OA)是一种临床上常见的退行性疾病,主要表现为关节软骨及软骨下骨的退行性改变、关节疼痛、活动困难、骨赘形成等症状,好发于中老年人[1-2]。MicroRNAs(miRNAs,miR)是一个庞大的内源性、非编码核苷酸序列家族,长度21 ~ 25个核苷酸,主要在转录后信使RNA的功能上调控基因的表达[3-5]。近年来,越来越多的miRNAs被证明在骨科疾病中起着重要作用[6]。而miRNA-214被证明在骨质疏松的骨重塑过程中对破骨细胞的功能有调控作用[7]。为进一步研究miR-214的功能,本实验旨在探究其在骨关节炎发展进程中的表达情况,以便了解miR-214作为骨性关节炎治疗靶向标记物的潜在价值。
材料和方法
1 实验标本 实验用原发性膝关节骨性关节炎患者及截肢患者胫骨平台标本,由本院关节外科行人工全膝关节置换术治疗的30例OA患者及严重创伤需行截肢手术治疗的10例患者自愿捐赠。均排除肿瘤、类风湿关节炎、感染及激素治疗等因素。其中男性23例,女性17例,年龄31 ~ 82岁。患者术前均行双膝关节负重位X线检查,后依据Kellgren-Lawrence X线诊断标准将其分为Ⅰ级组(10例)、Ⅱ级组(10例)、Ⅲ级组(10例)、Ⅳ级组(10例),进行实验检测。
2 RNA提取 将收集的胫骨平台分离软骨和软骨下骨,用陶瓷研钵分别将其在液氮下研碎。将分离的软骨及软骨下骨100 mg分别装入1.5 ml EP管中,用TRIzol提取组织中的RNA,样本经裂解、分层、RNA沉淀、洗涤和溶解后,使用分光光度计测定RNA浓度和纯度,确保后续试验准确度。
3 反转录合成cDNA 按照qPCR反转录试剂盒(SYBR Green ReverTra Ace qPCR RT Kit)说明书中要求,配置20μl反应体系,将测定浓度后的RNA样本加入反应体系进行反转录反应。反应在热循环仪上进行,配置反转录体系反应液的所有操作均在冰上进行。反转录反应体系成分:5×RT Buffer,4μl;RT Enzyme Mix,1μl;Primer Mix,1μl;RNA sample,2μl;Nuclear free water,加至20μl。反应条件 :37℃15 min,95℃5 min。
4 实时荧光定量PCR 检测miR-214:按照qPCR扩增反应试剂盒(SYBR Green Realtime PCR Master Mix-Plus)说明书中要求,配置扩增反应混合液,并分别加入miR-214引物,U6为内参引物,最后加入反转录合成的cDNA,反应体系成分:SYBR Green RT-PCR Master Mix,10μl;Plus solution,2μl;上游引物,0.5μl;下游引物,0.5μl;cDNA,1μl;Nuclear free water,6μl。引物序列:miR-214,上游为GACAGCAGGCACAGACA,下游为GT GCAGGGTCCGAGG;U6上游为CTCGCTTCGGCAG CACA3,下游为AACGCTTCACGAATTTGCGT。扩增反应条件:95℃1 min,95℃15 s,60℃15 s,72℃45 s,中间两步共40个循环。反应体系在实时荧光定量PCR机(Applied Biosystems Life Technologies,Foster City,CA,USA)中进行扩增反应。在结果分析中,miRNAs与U6的相对表达量用Delta Ct(ΔCt)表示,其最后表达倍数值用2-ΔΔCt值表示。
5 统计学分析 运用SPSS17.0统计学软件分析,各组间作比较采用ANOVA方差分析,P<0.05为差异有统计学意义。
结 果
1 miR-214在OA软骨组织中的表达水平 所有样本中均有miR-214表达,Ⅳ级组中miR-214的表达水平最高,各组表达水平呈逐渐上调趋势(图1),各组间差异均有统计学意义(P<0.05)。OA发展严重程度与miR-214的表达水平呈正相关。
2 miR-214在OA软骨下骨中的表达水平 Ⅲ级组中miR-214的表达水平明显高于其他3组(P<0.05)。软骨下骨中miR-214的表达水平差异不同于软骨中表达水平。见图2。
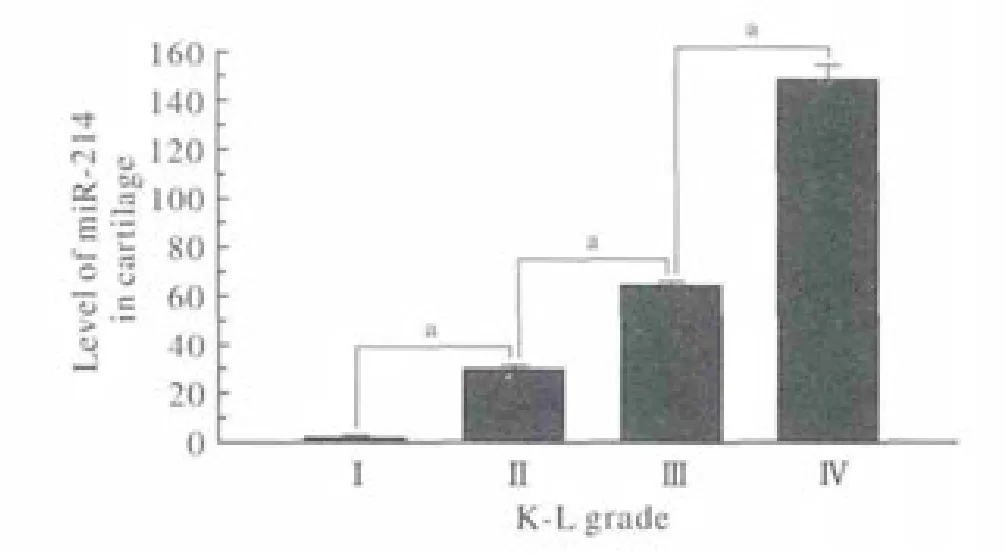
图 1 不同OA分级组软骨中miR-214的表达情况(aP<0.05)Fig. 1 Expression level of miR-214 in different grade of OA cartilage(aP<0.05)
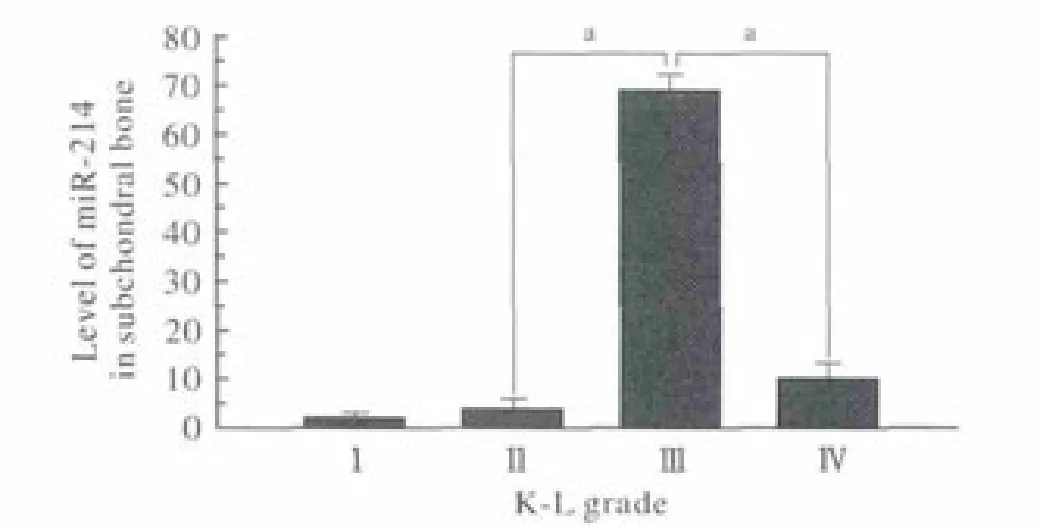
图 2 不同OA分级组软骨下骨中miR-214的表达情况(aP<0.05)Fig. 2 Expression level of miR-214 in different grade of OA subchondral bone (aP<0.05)
讨 论
骨性关节炎主要以关节软骨退变、软骨下骨进行性改变、骨赘形成和滑膜炎症反应为主要特征,严重影响着患者的日常生活质量,而目前为止,最有效的治疗方法只是人工关节置换术[8-9]。虽然OA为中老年人最常见关节疾病,但发病机制复杂,至今尚未明确。如今,骨关节炎的发病机制已成为越来越多学者的研究热点[10]。探索骨关节炎的更加有效的治疗方法也成为分子生物领域的重点。
miRNAs主要起调控基因表达的作用,在关节疾病的发生发展中有很重要的作用[11]。miR-146a已被发现在OA软骨中早期高表达,晚期低表达,并且其表达减少是由白介素-1β导致[12]。miR-140亦被证明在OA软骨中被白介素-1β调控而表达降低,从而引起异常基因的表达,且miR-140还参与骨关节炎软骨损伤的修复及骨发育等过程,对软骨及骨的修复和发育具有关键作用[13-14]。基于miRNAs在骨和软骨中复杂的功能,miRNAs被认为是一种新型、高效能的调节OA中基因表达的方法[15]。
在miRNAs在骨和软骨组织中的调控功能的研究中,miR-214已被发现是一种新型的调控成骨转化的因子,抑制了小鼠成肌细胞的成骨分化功能[16];而在成骨细胞中,miR-214通过靶向调控转录激活因子的表达,抑制成骨细胞的活性及基质矿化过程,从而促进骨质疏松的发生发展[7]。然而在骨性关节炎的机制研究中,miR-214的功能尚未明确。
通过本实验,作者证实了miR-214在OA软骨及软骨下骨中的异常表达,并且发现,在软骨中miR-214的表达水平随着OA严重程度的增加而逐渐升高,由此可见,miR-214可能参与OA进程中软骨损伤的过程,通过调控软骨相关退化基因而加速软骨的退化。而在OA的发展过程中,软骨和软骨下骨可以构成复合单元,在结构和功能上相互影响[2,17-19]。日常活动中,关节受到过度力学负荷而引发骨重塑,由早期的骨质吸收到晚期的骨质增生,再到最终的晚期骨质硬化和骨赘形成,整个OA病程中都存在骨重塑。而miR-214在软骨下骨中的异常表达,说明miR-214可能在骨重塑中起重要作用,而在K-L分级的Ⅲ级组中表达最高,证明随着骨质吸收的增加,miR-214的表达水平逐渐升高,而晚期骨质增生、骨赘形成,miR-214表达下降,由此表明,miR-214可能通过调控成破骨细胞活性而调节骨重塑过程。
综上所述,本实验证实miR-214在OA的发病过程中有重要作用,在软骨退变及软骨下骨改变中可能调控重要基因的表达,参与软骨退化及骨重塑。为下一步对miR-214在OA中的调控机制的研究提供理论基础。通过后期深入研究miR-214在软骨退变中的调控机制,结合其在骨中的调控功能,将为OA的临床诊断和治疗提供一种新型、有效的思路和方式。
1 Loeser RF, Goldring SR, Scanzello CR, et al. Osteoarthritis: a disease of the joint as an organ[J]. Arthritis Rheum, 2012, 64(6):1697-1707.
2 Burr DB, Gallant MA. Bone remodelling in osteoarthritis[J]. Nat Rev Rheumatol, 2012, 8(11):665-673.
3 Lu J, Getz G, Miska EA, et al. MicroRNA expression profiles classify human cancers[J]. Nature, 2005, 435(743): 834-838.
4 Kosaka N, Iguchi H, Ochiya T. Circulating microRNA in body fluid:a new potential biomarker for cancer diagnosis and prognosis[J].Cancer Sci, 2010, 101(10): 2087-2092.
5 Kobayashi T, Lu J, Cobb BS, et al. Dicer-dependent pathways regulate chondrocyte proliferation and differentiation[J]. Proc Natl Acad Sci U S A, 2008, 105(6): 1949-1954.
6 吴国栋,马宁,高旭.MicroRNA——关节炎治疗的新靶点[J].中国生物化学与分子生物学报,2012,28(10):888-891.
7 Wang X, Guo B, Li Q, et al. miR-214 targets ATF4 to inhibit bone formation[J]. Nat Med, 2013, 19(1): 93-100.
8 Berenbaum F. Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!)[J]. Osteoarthritis Cartilage, 2013, 21(1):16-21.
9 安晓,张琦,龚科,等.骨性关节炎与类风湿关节炎患者单侧膝关节置换术后围术期效果比较[J].解放军医学院学报,2014,35(10):1022-1024.
10 周博,朱剑,李坤鹏,等.超声下关节炎患者膝关节积液分布特点[J].解放军医学院学报,2013,34(7):719-721.
11 Nakasa T, Nagata Y, Yamasaki K, et al. A mini-review: microRNA in arthritis[J]. Physiol Genomics, 2011, 43(10):566-570.
12 Yamasaki K, Nakasa T, Miyaki S, et al. Expression of MicroRNA-146a in osteoarthritis cartilage[J]. Arthritis Rheum, 2009, 60(4):1035-1041.
13 Miyaki S, Nakasa T, Otsuki S, et al. MicroRNA-140 is expressed in differentiated human articular chondrocytes and modulates interleukin-1 responses[J]. Arthritis Rheum, 2009, 60(9):2723-2730.
14 赵振国.miRNA-140在骨性关节炎中的研究进展[J].安徽医药,2012,16(8):1053-1055.
15 Miyaki S, Asahara H. Macro view of microRNA function in osteoarthritis[J]. Nat Rev Rheumatol, 2012, 8(9): 543-552.
16 Shi K, Lu J, Zhao Y, et al. MicroRNA-214 suppresses osteogenic differentiation of C2C12 myoblast cells by targeting Osterix[J].Bone, 2013, 55(2): 487-494.
17 袁雪凌,孟昊业,王永成,等.膝关节原发性骨关节炎软骨-软骨下骨复合单元改变的实验研究[J].中国矫形外科杂志,2014,22(9):819-825.
18 王永成,孟昊业,袁雪凌,等.兔骨软骨缺损自发性修复模型中软骨下骨重塑与软骨再生的关系[J] .中国修复重建外科杂志,2014,28(6):681-686.
19 Lories RJ, Luyten FP. The bone-cartilage unit in osteoarthritis[J].Nat Rev Rheumatol, 2011, 7(1): 43-49.

