模拟急进高原过程对清醒和麻醉状态大鼠血压和呼吸的影响*
蔡秋瑾,李筱玥,张欢,刘瑞欣,周振,纪巧荣,高飞,张伟(青海大学医学院,青海西宁810001)
模拟急进高原过程对清醒和麻醉状态大鼠血压和呼吸的影响*
蔡秋瑾,李筱玥,张欢,刘瑞欣,周振,纪巧荣,高飞,张伟△
(青海大学医学院,青海西宁810001)
目的:为了全面地反映急进高原过程中机体的一些真实改变,本实验通过动态监测清醒和麻醉2种不同状态下大鼠血流动力学指标,旨在探讨清醒和麻醉状态大鼠在急性缺氧时血流动力学的差异,并以此进一步探讨其可能的机制。方法:实验将SD大鼠随机分为麻醉组、清醒组、5 000m麻醉对照(A-5000-control)组、5 000 m麻醉氨基胍(A-5000-AG)组、5 000 m清醒对照(C-5000-control)组和5 000 m清醒氨基胍(C-5000-AG)组。麻醉组和清醒组大鼠在低压氧舱从2 260m开始,以2m/s模拟急进高原5 000m过程;其余4组均在模拟5 000m海拔条件下进行。实验期间通过PowerLab生理记录仪实时、动态地监测整个过程中大鼠的系统动脉压(system arterial pressure,Psa)、中心静脉压(central venous pressure,CVP)、心率(heart rate,HR)和呼吸频率(breathing rate,BR)。结果:清醒组大鼠的HR和BR明显高于麻醉组,但MAP明显低于麻醉组。随着海拔的逐渐升高,清醒组和麻醉组大鼠均出现平均动脉压(mean arterial pressure,MAP)降低,且清醒组大鼠降低更为显著。另外,在5 000 m时,清醒组大鼠HR明显降低,而整个过程中2组大鼠的BR均无明显改变。静脉注射诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抑制剂氨基胍后,C-5000-AG组和A-5000-AG组大鼠动脉血压均明显升高,而HR和BR未见明显变化。结论:在急进高原过程中,血压和心率会明显下降,而呼吸频率变化不大。该现象可能的机制为:急性缺氧早期机体启动自我保护机制,活化iNOS,大量产生并释放NO,使血管舒张,可调节肺通气、引起血压下降;达到海拔5 000 m左右甚至更早时,机体可能出现失代偿,使心率减慢,引起血压进一步降低。由于受麻醉药物戊巴比妥钠的影响,麻醉状态的大鼠血压下降出现得较为迟缓,而清醒大鼠对急进高原性低氧反应迅速,能够更真实全面地反映急进高原过程中低氧引起的血流动力学改变。
急性高原病;低氧;血压;呼吸
[ABSTRACT]AIM:This study continuously monitors the hemodynamic changes in conscious and anesthetic rats during rapid ascent to high altitude to investigate whether there is difference between the 2 conditions and discuss the related underlying mechanism.METHODS:Sprague-Dawley rats were randomly divided into conscious group,anesthetic group,anesthetic-5000-control(A-5000-control)group,anesthetic-5000-aminoguanidine(A-5000-AG)group,conscious-5000-control(C-5000-control)group and conscious-5000-aminoguanidine(C-5000-AG)group.The rats in anesthetic group and conscious group were kept in a hypobaric chamber,in which the simulated altitude was increased from 2 260 m to 5 000 m at2 m/s,and the rats in other 4 groupswere at5 000 m.The system arterial pressure(Psa),central venous pressure(CVP),heart rate(HR)and breathing rate(BR)were directly and continuously displayed and digitally recorded by a high-performance data acquisition(PowerLab 16/35,AD Instruments)at200 Hz.RESULTS:The HR and BR in the conscious rats were higher and MAP was lower than those in the anesthetic rats obviously.A significant decrease inmean arterial pressure(MAP)in conscious and anesthetic groupswas observed following the increase in the altitude levels,and the net decrease in MAP in conscious group was significantly greater.Additionally,HR in the conscious rats was significantly lower at5 000 m than thatof the initial level.The rats in C-5000-AG group and A-5000-AG group showed a significant increase in the arterial pressure after the intravenous injection of AG,a selective inhibitor of inducible nitric oxide synthase(iNOS),and nomarked change of HR and BR was found.CONCLUSION:Blood pressure and HR decrease during rapid ascent to high altitude,while the change of BR is not obvious.Themechanisms of self-safety would be triggered in the early stage of hypoxia,which activates iNOSand then leads to a larger number of nitric oxide.Plentiful NO diastolizes the vessels to improve the ventilation-perfusionmismatch and lower the blood pressure.When the altitude arise to 5 000 m,evenmore earlier,a decompensatory stagemay occur in the body,leading to decreased HR and blood pressure furthermore than those in the anesthetic rats.Due to the effects of pentobarbital sodium,the depression of blood pressure requires a lag period and the net decrease in MAP is less than that in the conscious rats.Therefore,hemodynamic changes during rapid ascent to high altitude in conscious rats aremore comprehensive and authentic.
[KEY WORDS]Acute high-altitude sickness;Hypoxia;Blood pressure;Breath
随着高海拔地区的开发和旅游业的发展,长期或短期进入高原地区的低海拔人群与日俱增。然而,当平原地区的人急进高原后,由于对高原高寒、低压、低氧等环境的不适应,机体急性供氧不足,氧的利用受阻,有些人员会产生急性缺氧反应,重者也可发生急性高原病[1-2],这严重影响了人们的健康,也严重阻碍着当地的经济发展。目前认为,高原低氧尤其是急性低氧可造成脑、心、肺等多脏器损伤[3]。急性高原病一般在上升至海拔高度2 500 m (8 202英尺)以上就会发生,但在海拔2 000 m (6 562英尺)也会出现一些症状[4],其发病率高、病程急,可在短时间内发展为致命的高原肺水肿(highaltitude pulmonary edema,HAPE)和高原脑水肿(high-altitude cerebral edema,HACE)[5-6]。因此,进行高原反应和急性高原病的发病机制研究具有重大意义。目前,对于急性低氧方面的动物研究,多是通过等压低氧和低压氧舱内的低压低氧处理的,低压低氧较接近高原环境。但实验动物多处于麻醉状态,由于麻醉药物的影响,实验结果不能真实地反映急性低氧状态下动物病理生理学变化的特点。而动物清醒状态下进行的实验,其结果更接近急进高原的真实情况,其研究更具现实意义。因此,本实验拟通过实时、动态监测麻醉和清醒状态下大鼠急性低压低氧处理过程中的血流动力学变化,探讨清醒和麻醉状态下急进高原对机体血流动力学影响的特点,以期对急进高原时引起的高原反应和高原疾病的血流动力学改变机制有所了解,为其预防和治疗提供依据。
材料和方法
1实验动物和材料
SD大鼠,雄性,体重(282±19)g,由北京维通利华实验动物技术有限公司提供,许可证号为SCXK (京)2012-0001,No.11400700064575。大鼠随机分为清醒组(conscious,C)、麻醉组(anesthetic,A)、5 000 m麻醉对照组(A-5000-control)、5 000 m麻醉氨基胍(aminoguanidine,AG)组(A-5000-AG)、5 000 m清醒对照组(C-5000-control)和5 000 m清醒氨基胍组(C-5000-AG),每组样本例数均为7。
选择性诱导型一氧化氮合酶抑制剂氨基胍购自Sigma,溶于无菌生理盐水制成300mg/L浓度。大鼠维持饲料购于北京科澳协力饲料有限公司。
2动物准备
大鼠用2.5%戊巴比妥钠(50 mg/kg,ip)麻醉[7],仰卧固定于大鼠手术台上并用恒温加热板使体温恒定在36~37℃。做一颈前正中切口,用一个聚乙烯导管(0.50 mm×0.80 mm)做左侧颈总动脉插管,用以测量系统动脉压(system arterial pressure,Psa),另一聚乙烯导管(0.58 mm×0.96 mm)插入右侧颈静脉用以测量中心静脉压(central venous pressure,CVP)。术毕,麻醉组的大鼠移至低压氧舱连接传感器进行指标监测。清醒组大鼠,缝合伤口后用肝素盐水(1×106U/L)封管,经皮下隧道将导管固定在大鼠背部[8],并给予青霉素钠预防感染(0.5 mL,1.6×108U/L,im)[9]。所有大鼠术后1 h之内恢复意识,单独饲养在清洁鼠笼中,饲料、饮水无限制供给。
3方法
所有实验均在青海大学高原医学中心低压氧舱进行(中航风雷)。麻醉组的大鼠手术结束后移至低压氧舱,压力传感器(TP-400T,Nihon-Kohden)连接颈总动脉插管和颈外静脉插管,实验过程中采用恒温加热板使体温恒定在36~37℃;使传感器与大鼠右心室处于同一水平放置,用水银检压计校准后与两导管分别连接,以实时、动态监测并记录Psa和CVP;心率(heart rate,HR)和呼吸频率(breathing rate,BR)分别根据所描记的Psa和CVP的波形周期由Lab Chart软件计算,并以波形的形式记录(采样频率为200 Hz)[10];系统动脉压最大值(maximum of system arterial pressure,Psamax)和系统动脉压最小值(minimum of system arterial pressure,Psamin)由数据板计算出Psa波形的波峰平均值和波谷平均值得来,分别代表收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP);平均动脉压(mean arterial pressure,MAP)=1/3SBP+2/3 DBP[11],MAP变化幅度(ΔMAP)为某点数值与基础值之差;脉压差(pulse pressure)=SBP-DBP。Anesthetic组大鼠在低压氧舱以2 m/s的速度由海拔2 260 m逐渐上升至5 000 m,分别在模拟海拔2 260 m、2 500 m、3 000 m、3 500 m、4 000m、4 500 m和5 000 m时做标记,全程描记。A-5000-control组和A-5000-AG组大鼠在模拟海拔5 000m条件下,描记5 min基础值,根据分组静脉注射0.1 mL生理盐水或AG,连续观察并描记30 min。
清醒组大鼠术后恢复48 h,置于自制的可活动鼠笼中,导管与一旋转套管连接(Model TCS2-21,Tsumura),移至低压氧舱,连接传感器进行监测,方法同上。
4统计学处理
采用Stat View5.0(SAS Institute Inc.)软件进行统计分析,结果用均数±标准差(mean±SD)表示,显著性检验采用Fisher’s LSD法,以P<0.05为差异有统计学意义。
结果
结果显示,随着海拔逐渐升高,清醒组和麻醉组大鼠的MAP、Psamax和Psamin均显著降低,清醒组较麻醉组大鼠MAP下降出现得早,海拔达到2 500 m时,和麻醉组相比差异显著,且ΔMAP明显改变;海拔达到5 000 m时,清醒组MAP由基线值的(118.6± 3.0)mmHg降至(84.2±6.0)mmHg,ΔMAP为(34.3±5.0)mmHg;而麻醉组MAP由基线值的(130.6±9.0)mmHg降至(113.0±10.0)mmHg,ΔMAP为(17.6±2.0)mmHg,两者相比差异显著,见图1、2。

Figure 1.Waveform of system arterial pressure(Psa),central venous pressure(CVP),heart rate(HR)and breathing rate(BR) displayed on a thermal physiograph in conscious or anesthetic rats ascending to 5 000 m from 2 260 m in the hypobaric chamber.图1 生理记录仪描记的大鼠由海拔2 260 m急进至5 000 m过程中Psa、CVP、HR及BR的波形

Figure 2.The changes of MAP,Psamax,Psaminand net decrease in MAP(ΔMAP)in anesthetic or conscious rats ascending to 5 000 m from 2 260 m in the hypobaric chamber.Mean±SD.n=7.Solid symbols indicate P<0.05 vs the baseline values;*P<0.05 vs anesthetic group.图2 急进海拔5 000 m过程中清醒和麻醉状态大鼠MAP、Psamax、Psamin和ΔMAP的变化
随着海拔逐渐升高,清醒组和麻醉组大鼠的脉压差和CVP均未出现明显差异,麻醉组大鼠心率一直保持在420min-1左右,清醒组大鼠心率为开始为492min-1,比麻醉组高(P<0.05),当海拔升至4 500 m时开始降低,在海拔5 000m时降至454 min-1,与基础值相比差异显著。清醒组大鼠的呼吸频率始终比麻醉组高,在海拔的升高过程中均未发生明显改变,分别维持在125和80min-1,见图1、3。
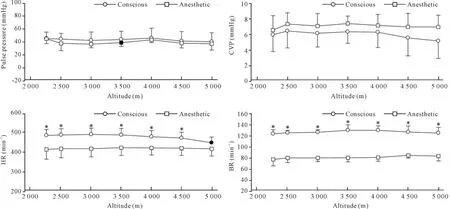
Figure 3.The changes of pulse pressure,CVP,HR and BR in anesthetic or conscious rats ascending to 5 000 m from 2 260 m in the hypobaric chamber.Mean±SD.n=7.Solid symbols indicate P<0.05 vs the baseline values;*P<0.05 vs anesthetic group.图3 急进海拔5 000 m过程中清醒和麻醉状态大鼠脉压差、CVP、HR和BR的变化
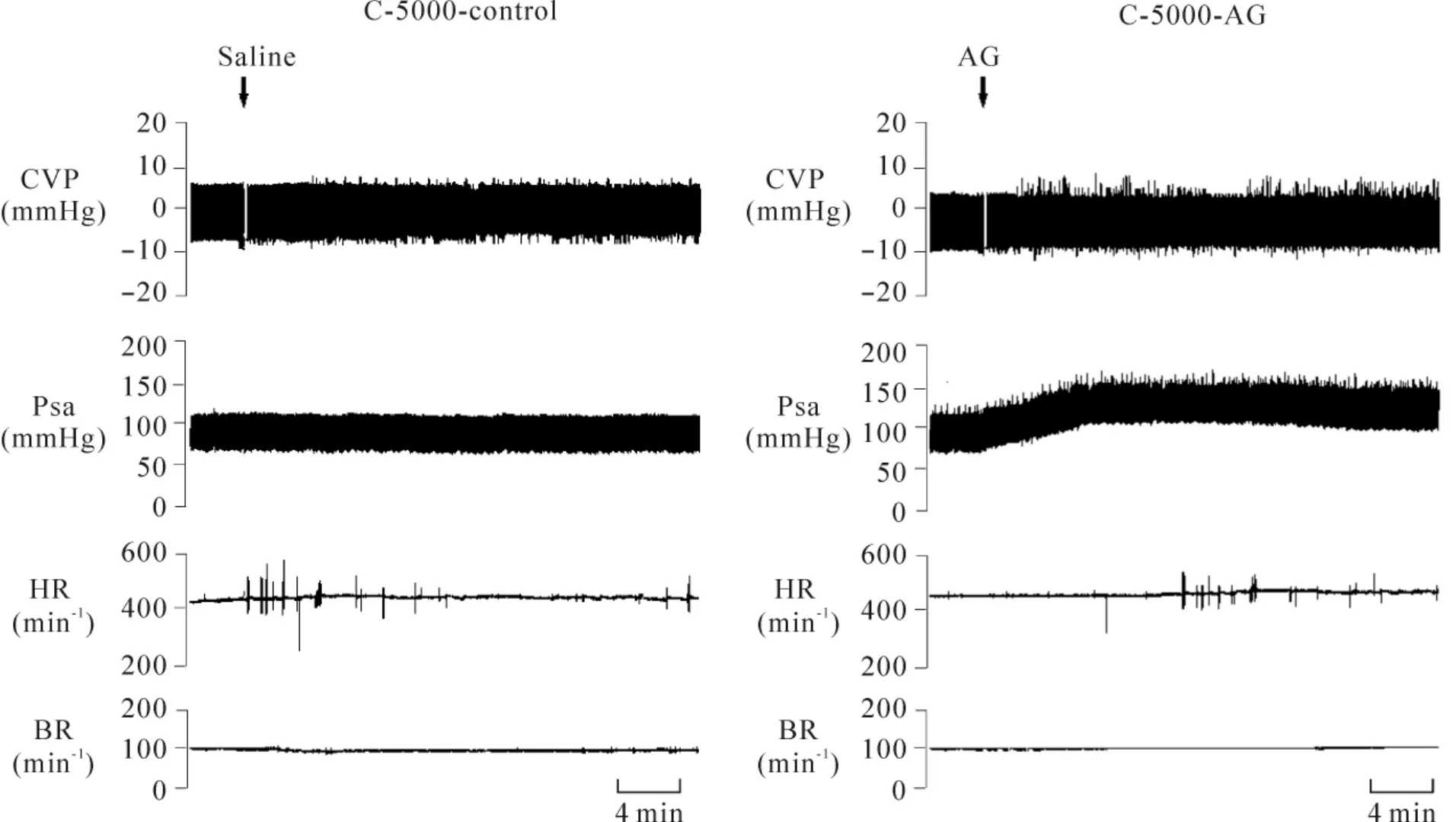
Figure 4.Waveform of Psa,CVP,HR and BR displayed on a thermal physiograph in C-5000-control and C-5000-AG groups.图4 在生理记录仪上描记的C-5000-control和C-5000-AG组大鼠CVP、Psa、HR和BR的波形

Figure 5.Waveform of Psa,CVP,HR and BR displayed on a thermal physiograph in A-5000-control and A-5000-AG groups.图5 在生理记录仪上描记的A-5000-control和A-5000-AG组大鼠CVP、Psa、HR和BR的波形
5000 m急性缺氧条件下,静脉注射AG后,C-5000-AG组和A-5000-AG组大鼠的动脉血压均明显升高,见图4、5;此外,与0点基础值相比,上述2组大鼠的MAP、Psamax和Psamin均显著升高,而HR和BR均未见明显变化,见图6、7。
讨论
本实验通过比较不同状态大鼠,在低压氧舱模拟由2 260 m到5 000 m这一急进低压低氧过程中的血流动力学指标的变化,来探讨清醒和麻醉状态下,急进低氧对机体血流动力学影响的特点,并通过给予相关药物干预,进一步探讨其机制。

Figure 6.The changes of MAP,Psamax,PsaminandΔMAP in anesthetic or conscious rats after an injection of AG or saline at5 000 m.Mean±SD.n=7.Solid symbols indicate P<0.05 vs the baseline values;*P<0.05 vs C-5000-control group.图6 海拔5 000 m条件下,静脉注射AG或生理盐水后清醒和麻醉状态大鼠MAP、Psamax、Psamin和ΔMAP的变化

Figure 7.The changes of pulse pressure,CVP,HR and BR in anesthetic or conscious rats after an injection of AG or saline at5 000 m.Mean±SD.n=7.*P<0.05 vs C-5000-control group.图7 海拔5 000 m条件下,静脉注射AG或生理盐水后清醒和麻醉状态大鼠脉压差、CVP、HR和BR的变化
沙爱龙等[12]曾报道,戊巴比妥钠会引起家兔血压升高,而心率和呼吸频率明显降低。本实验中,低氧处理前麻醉组大鼠与清醒组大鼠相比,血压明显较高,心率和呼吸频率明显较低,这与上述结果相类似。戊巴比妥钠对心率和呼吸的抑制作用机制,目前多认为是该药物对中枢神经的抑制引起的[13],而其对大鼠血压的影响机制尚不明了。有研究表明戊巴比妥钠麻醉大鼠血压比清醒大鼠高[14-15],关于其机制我们还会进一步研究。此外,在模拟急进高原过程中,清醒大鼠比麻醉大鼠血压较早出现显著下降,且幅度较大,这可能与戊巴比妥钠对大鼠中枢的抑制作用,引起机体对低氧刺激敏感性降低,产生的应激肽及一些舒血管物质减少等有关。因此,应用清醒动物进行急进高原研究,更有价值且更具现实意义。
有报道指出,吸入氮氧混合低氧气体模拟急性低氧,10 min后家兔血压会出现降低,并有心率减慢的现象(12.5%O2/N2和8.5%O2/N2的低氧气体,分别模拟4 000 m和6 500 m高海拔急性低氧)[16];另有研究表明,低氧刺激会使大鼠MAP降低[17-19]。刘向昕等[20]、贾司光等[21]认为低氧初期(缺氧10~20 min)机体处于代偿期,交感神经占优势,而后期失代偿,情况发生逆转。但上述实验均是在某一特定模拟海拔下进行的,不足以反映机体在急进高原过程的变化。本实验,通过模拟由海拔2 260 m升至5 000 m这一渐变过程,来模拟急进高原,发现清醒和麻醉大鼠血压均下降,且清醒大鼠在2 500 m时,血压便出现显著下降。这可能是由于急进性低氧时,机体启动自我保护机制,调动心血管、内分泌、神经系统等,大量产生并释放组胺、一氧化氮(nitric oxide,NO)[22-23]等舒血管物质,同时抑制肾素、血管紧张素等缩血管物质的产生,以对抗低氧引起的肺动脉及小动脉强性收缩。但也可能意味着,大鼠在此急进性低氧过程中机体出现失代偿。
我们知道NO主要由NOS催化L-精氨酸产生,是体内重要的舒血管活性物质。NOS主要有3种不同的亚型:神经元型NOS(neuronal nitric oxide synthase,nNOS)、内皮型NOS(endothelial nitric oxide synthase,eNOS)和诱导型NOS(inducible nitric oxide synthase,iNOS)[24]。生理状态时主要是eNOS和nNOS产生的NO发挥生理作用。而iNOS存在于心肌细胞、血管平滑肌细胞、成纤维细胞、内皮细胞及炎症细胞中,生理状态下几乎不表达,在体内缺氧或炎症刺激状态下可被激活,从而产生大量的NO[25]。为了对急性缺氧引起血压和心率降低的机制进行更加深入的研究,本实验在5 000 m海拔条件下,给予清醒大鼠iNOS抑制剂,通过监测并比较各组血压、呼吸和心率的变化,探讨内源性NO在急性缺氧引起的血压和心率下降这些改变当中所起的作用及其机制。结果发现,静脉注射AG后,C-5000-AG组和A-5000-AG组大鼠的MAP、Psamax和Psamin均明显升高。说明人为抑制iNOS可短时间内对抗急性缺氧引起的血压降低部分,换言之,急性缺氧时iNOS活化,其催化产生的NO参与了急性缺氧引起的血压下降。另有研究表明,HAPE患者吸入NO可改善肺通气[26],而急性缺氧时iNOS被激活,产生大量的NO,这意味着急性缺氧引起的呼吸改变也许会在NO的作用下有所改善,故并没有出现我们所预测的呼吸加快。此外,iNOS广泛存在于心肌细胞,NO储存会对心肌细胞造成一定损害,心肌收缩能力减弱[27],射血能力下降,引起血压下降。在大鼠由海拔2 260m急进5 000m过程中,随着缺氧程度的加重和时间的延长,当海拔达到5 000 m甚至更早时,清醒状态大鼠对缺氧较为敏感,可能出现失代偿,心迷走神经兴奋,其末梢释放乙酰胆碱,与心肌细胞膜上的M胆碱能受体结合,可导致心率减慢、心肌收缩力减弱,以致心输出量减少,又可引起血压进一步降低。
综上所述,在急进高原过程中,血压和心率会明显下降,而呼吸频率变化不大。该现象可能的机制为:急性缺氧早期机体启动自我保护机制,调动心血管、内分泌、神经系统等,活化iNOS,大量产生并释放NO,使血管舒张,可调节肺通气,并引起血压下降;达到海拔5 000 m左右甚至更早时,机体可能出现失代偿,使心率减慢、血压进一步降低。相较于麻醉状态,清醒状态更接近于人们急进高原时的生理状态,其结果能更真实全面地反映急进高原时低氧引起的血流动力学改变。因此,应用清醒状态动物进行急性缺氧、慢性缺氧适应等方面的研究,更有利于探讨急进高原引起的高原反应、高原疾病的血流动力学改变机制,以为其预防和治疗提供依据。
[1]Burtscher M,Gatterer H,Faulhaber M,et al.Acetazolamide pre-treatment before ascending to high altitudes: when to start?[J].Int JClin Exp Med,2014,7(11): 4378-4383.
[2]Luks AM.Physiology in medicine:a physiologic approach to prevention and treatment of acute high-altitude illnesses[J].J Appl Physiol(1985),2015,118(5): 509-519.
[3]Luo Y,Wang Y,Lu H,etal.‘Ome’on the range:update on high-altitude acclimatization/adaptation and disease[J].Mol Biosyst,2014,10(11):2748-2755.
[4]Shin T.High altitude illnesses in Hawai’i[J].Hawaii J Med Public Health,2014,73(11 Suppl 2):4-6.
[5]Luks AM,McIntosh SE,Grissom CK,et al.Wilderness medical society consensus guidelines for the prevention and treatment of acute altitude illness[J].Wilderness Environ Med,2010,21(2):146-155.
[6]Netzer N,Strohl K,Faulhaber M.Hypoxia-related altitude illnesses[J].J Travel Med,2013,20(4):247-255.
[7]Zhang W,Shibamoto T,Kuda Y,et al.Effects of betaadrenergic blockers on pulmonary vascular response to anaphylactic hypotension in anesthetized rats[J].JPhysiol Sci,2010,60(Supp 1):S167.
[8]Zhang W,Shibamoto T,Cui S,et al.7-Nitroindazole,but not L-NAME or aminoguanidine,attenuates anaphylactic hypotension in conscious rats[J].Shock,2009,31(2):201-206.
[9]傅继华,张琪,唐明月.清醒大鼠自由活动下长时间直接测压实验方法的改进[J].中国药理学通报,1996,12(6):562-565.
[10]Zhang W,Shibamoto T,Kurata Y,et al.Effects ofβadrenoceptor antagonists on anaphylactic hypotension in conscious rats[J].Eur J Pharmacol,2011,650(1): 303-308.
[11]朱大年,王庭槐.生理学[M].第8版.北京:人民卫生出版社,2013:121-122.
[12]沙爱龙,努尔阿米娜·阿吉,艾洪滨,等.3种麻醉剂对家兔血压、心率、呼吸影响的比较研究[J].北京联合大学学报:自然科学版,2011,25(3):47-50.
[13]杨晓君.戊巴比妥钠麻醉对SD大鼠血钾水平的影响[J].山西医药杂志,2007,36(24):977.
[14]Sun L,Tanida M,Wang M,et al.Effects of anesthetics on the renal sympathetic response to anaphylactic hypotension in rats[J].PLoSOne,2014,9(11):e113945.
[15]施新猷.医学动物实验方法[M].北京:人民卫生出版社,1980:409-410.
[16]赵善民,何显教,晋玲,等.急性低氧对家兔血压心率微血管反应性及自由基的影响[J].中国应用生理学杂志,2003,19(4):341-343.
[17]Mendoza JP,Passafaro RJ,Baby SM,et al.Role of nitric oxide-containing factors in the ventilatory and cardiovascular responses elicited by hypoxic chanllenge in isoflirance-anesthetized rats[J].J Appl Physiol(1985),2014,116(11):1371-1381.
[18]Huang KL,Wu CP,Kang BH,et al.Chronic hypoxia attenuates nitric oxide-dependent hemodynamic responses to acute hypoxia[J].JBiomed Sci,2002,9(3):206-212.
[19]Gozal D,Torres JE,Gozal YM,etal.Effect of nitric oxide synthase inhibition on cardiorespiratory responses in the conscious rat[J].JAppl Physiol(1985),1996,81 (5):2068-2077.
[20]刘向昕,鲁力立,仲崇发.急性缺氧条件下的心率变异性分析[J].航天医学与医学工程,2001,14(5): 328-331.
[21]贾司光.航空航天缺氧与供氧[M].北京:人民军医出版社,1989:96-113,220.
[22]胡晓兰,林树新,于代华,等.低氧对人脐静脉内皮细胞一氧化氮和内皮素-1的生成及诱导型一氧化氮合酶mRNA表达的影响[J].中国病理生理杂志,2005,21(11):2119-2122.
[23]Hu R,Dai A,Tan S.Hypoxia-inducible factor 1 alpha upregulates the expression of inducible nitric oxide synthase gene in pulmonary arteries of hypoxic rat[J].Chin Med J(Engl),2002,115(12):1833-1837.
[24]王洪斌,李素芝,姚文新,等.初发、复发性高原肺水肿血清NO、NOS、iNOS研究[J].高原医学杂志,2005,15(30):18-20.
[25]Panaro MA,Brandonisio O,Acquafredda A,et al.Evidences for iNOSexpression and nitric oxide production in the human macrophages[J].Curr Drug Targets Immune Endocr Metabol Disord,2003,3(3):210-221.
[26]Droma Y,Hanaoka M,Ota M,etal.Positive association of the endothelial nitric oxide synthase gene polymorphisms with high altitude pulmonary edema[J].Circulation,2002,106(7):826-830.
[27]邓次妮,沈潞华.一氧化氮合酶/一氧化氮系统与心血管疾病[J].心血管病学进展,2007,28(4):603-606.
Effect of acute exposure to simulated high altitude on blood pressure and breath in conscious and anesthetic rats
CAIQiu-jin,LIXiao-yue,ZHANG Huan,LIU Rui-xin,ZHOU Zhen,JIQiao-rong,GAO Fei,ZHANGWei
(Medical College of Qinghai University,Xining 810001,China.E-mail:zw0228@sina.com)
R363
A
10.3969/j.issn.1000-4718.2015.05.002
1000-4718(2015)05-0777-08
2015-03-10
2015-04-16
国家自然科学基金资助项目(No.81160012);教育部新世纪优秀人才项目(No.NCET-12-1022);青海省自然科学基金资助项目(No.2012-Z-915Q);青海大学医学院中青年科研基金团队项目(No.2013-KT-4)
Tel:0971-6109507;E-mail:zw0228@sina.com

