ATP敏感性钾通道在硫化氢抑制高糖引起的心肌细胞损伤中的作用*
梁伟杰,陈景福,张稳柱,莫利求,郑东诞,宋明才,潘玩莹,冯鉴强,廖新学(广州市番禺区中心医院心血管内科,广州市番禺区心血管疾病研究所,广东广州00;中山大学附属第一医院黄埔院区心血管内科CCU,麻醉科,广东广州0700;中山大学附属第一医院高血压血管病科,广东广州0080)
ATP敏感性钾通道在硫化氢抑制高糖引起的心肌细胞损伤中的作用*
梁伟杰1,2,陈景福3,张稳柱1,2,莫利求4,郑东诞3,宋明才1,2,潘玩莹4,冯鉴强4,廖新学5△
(1广州市番禺区中心医院心血管内科,2广州市番禺区心血管疾病研究所,广东广州511400;中山大学附属第一医院黄埔院区3心血管内科CCU,4麻醉科,广东广州510700;5中山大学附属第一医院高血压血管病科,广东广州510080)
目的:研究ATP敏感性钾通道(KATP通道)在硫化氢(H2S)抑制高糖引起心肌损伤中的作用。方法:应用Western blot法检测心肌细胞KATP通道蛋白的表达水平;CCK-8试剂盒测定心肌细胞存活率;Hoechst 33258染色测定凋亡细胞数量的变化;JC-1染色法测定线粒体膜电位(MMP)。结果:应用高糖(35 mmol/L葡萄糖)处理H9c2细胞1~24 h,其中6 h、9 h、12 h和24 h均能明显下调KATP通道蛋白的水平,12 h和24 h KATP水平降至最低。在HG处理心肌细胞12 h前,应用400μmol/L硫氢化钠(NaHS,为H2S的供体)预处理30 min明显抑制高糖对KATP通道蛋白表达的下调作用。100μmol/L线粒体KATP通道开放剂二氮嗪和50μmol/L非选择性KATP通道开放剂吡拉地尔(Pin)及NaHS预处理均显著抑制高糖引起的心肌细胞损伤,使细胞存活率升高,凋亡细胞数量及MMP丢失减少。相反,100μmol/L线粒体KATP通道阻断剂5-羟基癸酸和1 mmol/L非选择性KATP通道阻断剂格列本脲均能明显阻断上述NaHS的心肌细胞保护作用。结论:KATP通道介导了H2S对高糖引起的心肌细胞损伤的抑制作用。
ATP敏感性钾通道;硫化氢;心肌细胞
[ABSTRACT]AIM:To investigate the roles of ATP-sensitive potassium(KATP)channels in high glucose-induced cardiac injury and the inhibitory effect of hydrogen sulfide(H2S)on the cardiomyocyte injury.METHODS:The expression level of KATPchannel protein was tested byWestern blot.The cell viability wasmeasured by CCK-8 assay.The number of apoptotic cells was observed by Hoechst 33258 nuclear staining.Mitochondrialmembrane potential(MMP)was examined by JC-1 staining.RESULTS:After the H9c2 cellswere treated with 35mmol/L glucose(high glucose,HG)for1~24 h,the protein level of KATPchannelwas significantly reduced at6 h,9 h,12 h and 24 h,reaching theminimum level at12 h and 24 h.Pretreatmentof the cellswith 400μmol/LNaHS(a donor of H2S)prior to exposure to HG for12 h considerably blocked the down-regulation of KATPchannels induced by HG.Pretreatment of the cells with 100μmol/L mitochondrial KATPchannel opener diazoxide,50μmol/L non-selective KATPchannel opener pinacidil or NaHSobviously inhibited HG-induced injuries,leading to an increase in the cell viability,and decreases in the number of apoptotic cells and the MMP loss.Pretreatmentwith 100μmol/Lmitochondrial KATPchannel antagonist5-hydroxydecanoic acid or 1mmol/L nonselective KATPchannel antagonist glibenclamide attenuated the above cardioprotective effects of NaHS.CONCLUSION: KATPchannelsmediate the inhibitory effect of H2S on HG-induced cardiac injury.
[KEY WORDS]ATP-sensitive potassium channels;Hydrogen sulfide;Cardiomyocytes
硫化氢(hydrogen sulfide,H2S)长期以来被认为是一种有毒的气体。但是,体内的组织、器官,如脑、心血管等均能产生内源性的H2S[1-2],是继NO和CO之后第3种内源性气体信号分子。近年来,越来越多的研究证实,H2S具有多种生理与病理生理功能。在心血管系统,H2S能舒张血管平滑肌[3];能减轻心肌梗塞引起心室功能障碍和心衰发展[4]及保护H9c2心肌细胞对抗缺氧引起的损伤[5]。ATP敏感性钾通道(ATP-sensitive K+channels,KATPchannels)被第一个认为是H2S的靶分子。根据存在的部位,KATP通道主要分为细胞膜KATP通道和线粒体KATP通道。Bian等[6]报道,KATP通道介导外源性H2S预处理对缺血引起心肌损伤的抑制作用。
最近,H2S在糖尿病心血管并发症中的作用受到关注。有报道指出,2型糖尿病患者及链脲霉素诱导的糖尿病大鼠,其血浆H2S水平明显降低[7]。近年,我们证实外源性H2S能通过调控p38丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)、细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)及瘦素(leptin)通路,保护H9c2心肌细胞对抗高糖引起的损伤[8-9]。但是,KATP通道在H2S对抗高糖引起的心肌损伤中的作用及其机制尚不明确。
为此,本研究建立高糖损伤H9c2心肌细胞模型[8],旨在探讨:(1)高糖对心肌细胞KATP通道蛋白表达水平的影响;(2)NaHS(为H2S的供体)预处理能否抑制高糖对KATP通道蛋白表达的抑制作用;(3) KATP通道开放剂能否抑制高糖引起的心肌细胞损伤; (4)KATP通道阻断剂能否减弱外源性H2S的心肌细胞保护作用。
材料和方法
1材料
NaHS、Hoechst 33258和JC-1(Sigma);二氮嗪(diazoxide,DZ)、吡拉地尔(pinacidil,Pin)、5-羟基癸酸(5-hydroxydecanoic acid,5-HD)和格列本脲(glibenclamide,Gli)购自Cayman;细胞计数试剂盒8 (Cell Counting Kit-8,CCK-8)购自Dojindo;DMEM培养基(HyClone);特级胎牛血清(Gibco);抗KATP抗体(Santa Cruz)。H9c2心肌细胞由中山大学实验动物中心提供。
2方法
2.1细胞培养H9c2心肌细胞来源于大鼠胚胎期的心脏组织,培养于含10%胎牛血清的DMEM培养基中,置于5%CO2、37℃的细胞培养箱中培养。
2.2实验分组实验分为12组:⑴正常对照组(control):DMEM培养基处理心肌细胞24 h;⑵高糖(high glucose,HG)组:35 mmol/L葡萄糖处理24 h;⑶NaHS+HG组:400μmol/L NaHS作用心肌细胞30 min,撤去,PBS洗2次,接着用35 mmol/L葡萄糖处理24 h;⑷5-HD+NaHS+HG组:100μmol/L 5-HD作用心肌细胞30 min,撤去,PBS洗2次,后续实验步骤与第⑶实验组相同;⑸Gli+NaHS+HG组:1 mmol/LGli作用心肌细胞30 min,撤去,PBS洗2次,后续实验步骤与第⑶实验组相同;⑹DZ+HG组: 100μmol/L DZ作用心肌细胞30 min,撤去,PBS洗2次,接着35 mmol/L葡萄糖处理24 h;⑺Pin+HG组:50μmol/L Pin作用心肌细胞30 min,撤去,PBS洗2次,接着35 mmol/L葡萄糖处理24 h;⑻NaHS组:400μmol/L NaHS作用心肌细胞30 min,撤去,PBS洗2次,接着DMEM培养基处理24 h;⑼5-HD组:100μmol/L 5-HD作用心肌细胞30 min,撤去,PBS洗2次,接着DMEM培养基处理24 h;⑽Gli组: 1 000μmol/LGli作用心肌细胞30 min,撤去,PBS洗2次,接着DMEM培养基处理24 h;⑾DZ组:100 μmol/L DZ作用心肌细胞30 min,撤去,PBS洗2次,接着DMEM培养基处理24 h;⑿Pin组:50μmol/L Pin作用心肌细胞30 min,撤去,PBS洗2次,接着DMEM培养基处理24 h。
2.3Western blot法检测KATP通道蛋白将H9c2心肌细胞接种于35 mm培养皿中,培养至细胞融合至80%时,各实验组给予不同的处理因素后,用预冷的PBS洗3次,加入裂解液,4℃静置30 min,12 000 r/ min离心10 min,取上清,然后采用BCA法进行蛋白定量。总蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,转移到PVDF膜上。用5%脱脂奶粉封闭60 min,随后分别加入抗KATP(1∶1 000)抗体,4℃过夜,然后用TBST洗3次,每次5 min,与相应的II抗(1∶3 000)室温孵育1.5 h,用TBST洗3次,每次5 min。将PVDF膜用发光试剂ECL显色,暗室曝光到X线片上,凝胶成像系统扫描分析结果。重复5次。
2.4CCK-8测定细胞存活率将H9c2心肌细胞接种于96孔培养板中,当心肌细胞生长到占培养孔面积大约80%时,按各分组处理后,于每孔中加入10 μL CCK-8试剂和90μL DMEM,轻摇,37℃孵育2.5 h,用酶标仪记录各孔450 nm处吸光度值(A)。取5孔A值的平均数,按下列公式计算细胞存活率:细胞存活率(%)=处理组A/对照组A×100%,重复5次。
2.5Hoechst33258核染色检测细胞凋亡将H9c2心肌细胞接种于24孔培养板中,在细胞生长到占培养孔面积大约80%时,按各分组处理后,用PBS冲洗3次,然后用4%多聚甲醛于4℃环境中固定10min,加入含5 mg/L Hoechst 33258试剂,于37℃温箱孵育30 min,在荧光显微镜下(Nikon)摄片,鉴别正常的心肌细胞和凋亡的心肌细胞,随机选取视野在荧光显微镜下摄片,重复5次。
2.6JC-1染色测定线粒体膜电位(mitochondrial menbrane potential,MMP)将H9c2心肌细胞接种于24孔培养板中,当细胞生长到培养孔面积大约80%时,上述各实验组经不同的处理因素作用后,用PBS冲洗3次,用10μg/L JC-1的无血清培养基于37℃温箱中孵育45 min,然后用PBS冲洗3次。在荧光显微镜下随机选取5个不重复区摄片,细胞核周围绿色的亮点即为摄取了JC-1的线粒体。用ImageJ 1.47i软件分析5个视野绿色荧光强度的平均值,再对每组的各样本进行统计分析。重复5次。
3统计学处理
实验数据用SPSS16.0软件进行统计分析,所有结果以均数±标准误(mean±SEM)表示,组间比较采用单因素方差分析(one-way ANOVA),用SNK-q进行均数之间的两两比较,以P<0.05为差异有统计学意义。
结果
1高糖抑制心肌细胞KATP通道蛋白的表达
应用高糖(35mmol/L葡萄糖)处理H9c2心肌细胞1~24 h,6 h时开始,KATP通道蛋白表达水平明显降低(P<0.01),9 h时进一步降低(P<0.01),12 h和24 h时降至最低水平(P<0.01),见图1。
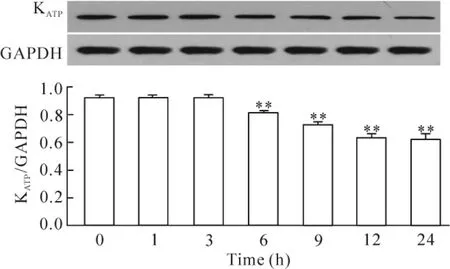
Figure 1.High glucose inhibited the expression of KATPchannels in H9c2 cardiac cells.Mean±SEM.n=5.**P<0.01 vs0 h group.图1 高糖抑制心肌细胞KATP通道蛋白的表达
2H2S减弱高糖对心肌细胞KATP通道蛋白表达的抑制
应用高糖处理心肌细胞12 h使KATP通道蛋白表达明显减少,与对照组比较,差异有统计学意义(P<0.01)。但是,在高糖处理心肌细胞前,应用400 μmol/L NaHS预处理30 min使高糖对KATP通道蛋白表达的抑制作用显著减弱,与高糖组比较,差异显著(P<0.01)。400μmol/L NaHS本身对心肌细胞KATP通道蛋白的基础表达水平无明显的影响,见图2。
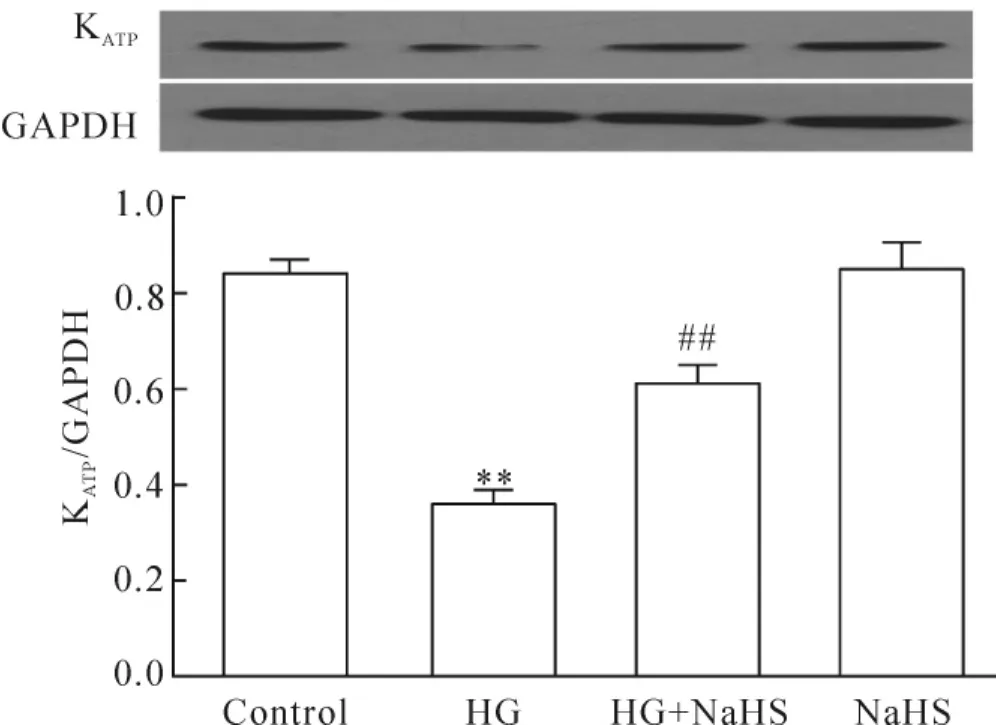
Figure 2.H2S ameliorated the inhibitory effect of HG on KATPchannel protein expression.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group.图2 H2S减弱高糖对心肌细胞KATP通道蛋白表达的抑制作用
3KATP通道介导H2S抑制高糖引起的心肌细胞毒性
应用0.06、0.08、0.10、0.12、0.14和0.16 mmol/L线粒体KATP通道开放剂DZ预处理H9c2心肌细胞30 min也明显地抑制HG引起的心肌细胞毒性,升高细胞存活率(P<0.01)。0.06~0.16 mmol/ L DZ本身对心肌细胞存活率无显著影响。另一方面,应用0.03、0.04、0.05、0.06、0.07和0.08 mmol/ L非选择性KATP通道开放剂Pin预处理H9c2心肌细胞30 min均能明显抑制高糖引起的心肌细胞毒性,使细胞存活率升高,与HG组比较差异均有统计学意义(P<0.01)。但0.03~0.08 mmol/L Pin本身对心肌细胞的存活率无明显的影响。值得注意的是,线粒体KATP通道开放剂对抗高糖细胞毒性的作用与非选择性KATP通道开放剂比较,两者无明显差异(P>0.05)。与KATP通道开放剂的作用相似,400 μmol/L NaHS预处理心肌细胞30 min能明显地抑制高糖引起的心肌毒性,使细胞存活率升高,与HG组比较差异有统计学意义(P<0.01)。但是,应用100 μmol/L线粒体KATP通道阻断剂5-HD或1 mmol/L非选择性KATP通道阻断剂Gil预处理30 min均明显地减弱H2S的抗高糖心肌毒性作用,使心肌细胞存活率降低,与NaHS预处理组比较差异均有统计学意义(P<0.01)。5-HD或Gli本身对细胞存活率无明显的影响,见图3。

Figure 3.KATPchannelsmediated the inhibitory effect of H2Son HG-induced cytotoxicity in the H9c2 cardiac cells.Mean±SEM.n=6.**P<0.01 v s control group;#P<0.05,##P<0.01 vs HG group;△△P<0.01 vs NaHS+HG group.图3 KATP通道介导H2S对高糖引起的心肌细胞毒性的抑制作用
4KATP通道介导H2S对高糖致心肌细胞凋亡的抑制作用
Hoechst核染色的检测结果显示,正常的H9c2心肌细胞的染色质分布均匀,呈现出弥散均匀的低密度荧光。应用35 mmol/L葡萄糖处理心肌细胞24 h后,呈现典型的凋亡特征(即细胞核呈现浓缩致密的固缩形态或颗粒荧光)的细胞数量增多,与正常对照组比较差异显著(P<0.01)。然而,100μmol/L DZ和50μmol/L Pin预处理H9c2心肌细胞30 min均能显著地减少凋亡细胞的数量,与HG组比较,差异显著(P<0.01)。但是,线粒体KATP通道开放剂对HG致心肌细胞凋亡的抑制作用与非选择性KATP通道开放剂比较无明显差异(P>0.05)。与KATP通道开放剂的作用相似,400μmol/L NaHS预处理心肌细胞30 min能明显抑制高糖致心肌细胞凋亡的作用,使凋亡细胞数量明显减少,与HG组比较,差异显著(P<0.01)。但是,应用100μmol/L线粒体KATP通道阻断剂5-HD或非选择性KATP通道阻断剂Gli预处理30min均明显减弱H2S的抗高糖致心肌细胞凋亡作用,使心肌细胞凋亡数量增加,与NaHS预处理组比较差异均有统计学意义(P<0.01)。5-HD或Gli本身对细胞凋亡数量无明显的影响(P>0.05),见图4。
5KATP通道介导H2S对高糖致心肌细胞线粒体膜电位丢失的抑制作用
HG作用于H9c2心肌细胞24 h可使胞内JC-1的平均荧光强度(mean fluorescence intensity,MFI;反映MMP大小的指标)从(78.60±0.62)%降低至(51.10±0.07)%,差异显著(P<0.01)。然而,100 μmol/L DZ和50μmol/L Pin预处理H9c2心肌细胞30 min均能显著减少MMP的丢失,使MFI分别升高至(67.10±0.15)%和(67.20±0.25)%,与HG组比较差异显著(P<0.01)。但是,线粒体KATP通道开放剂对HG致心肌细胞MMP丢失作用与非选择性KATP通道开放剂比较无明显差异(P>0.05)。
与KATP通道开放剂的作用相似,400μmol/L NaHS预处理心肌细胞30 min能明显地抑制高糖的致心肌细胞MMP丢失,使MFI升高至(64.10± 0.17)%,与HG组比较差异显著(P<0.01)。但是,应用100μmol/L线粒体KATP通道阻断剂5-HD或非选择性KATP通道阻断剂Gli预处理30 min均明显减弱H2S对高糖致心肌细胞MMP丢失的抑制作用,使心肌细胞MFI分别降低至(50.70±0.67)%和(50.60±0.32)%,与NaHS预处理组比较差异均有统计学意义(P<0.01)。5-HD或Gli本身对心肌细胞MMP无明显的影响(P>0.05),见图5。
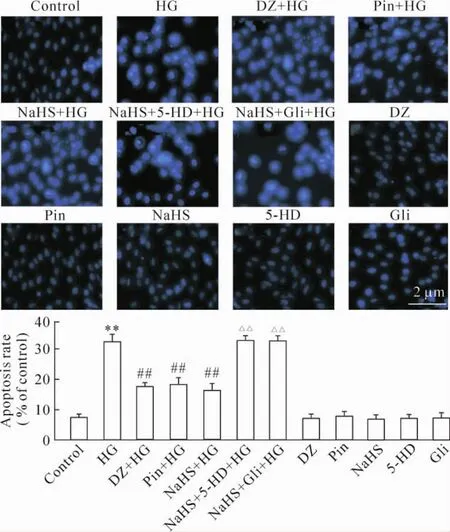
Figure 4.KATPchannelsmediated the inhibitory effect of H2S on HG-induced apoptosis of H9c2 cardiac cells.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group;△△P<0.01 vs NaHS+HG group.图4 KATP通道介导H2S对高糖致心肌细胞凋亡的抑制作用
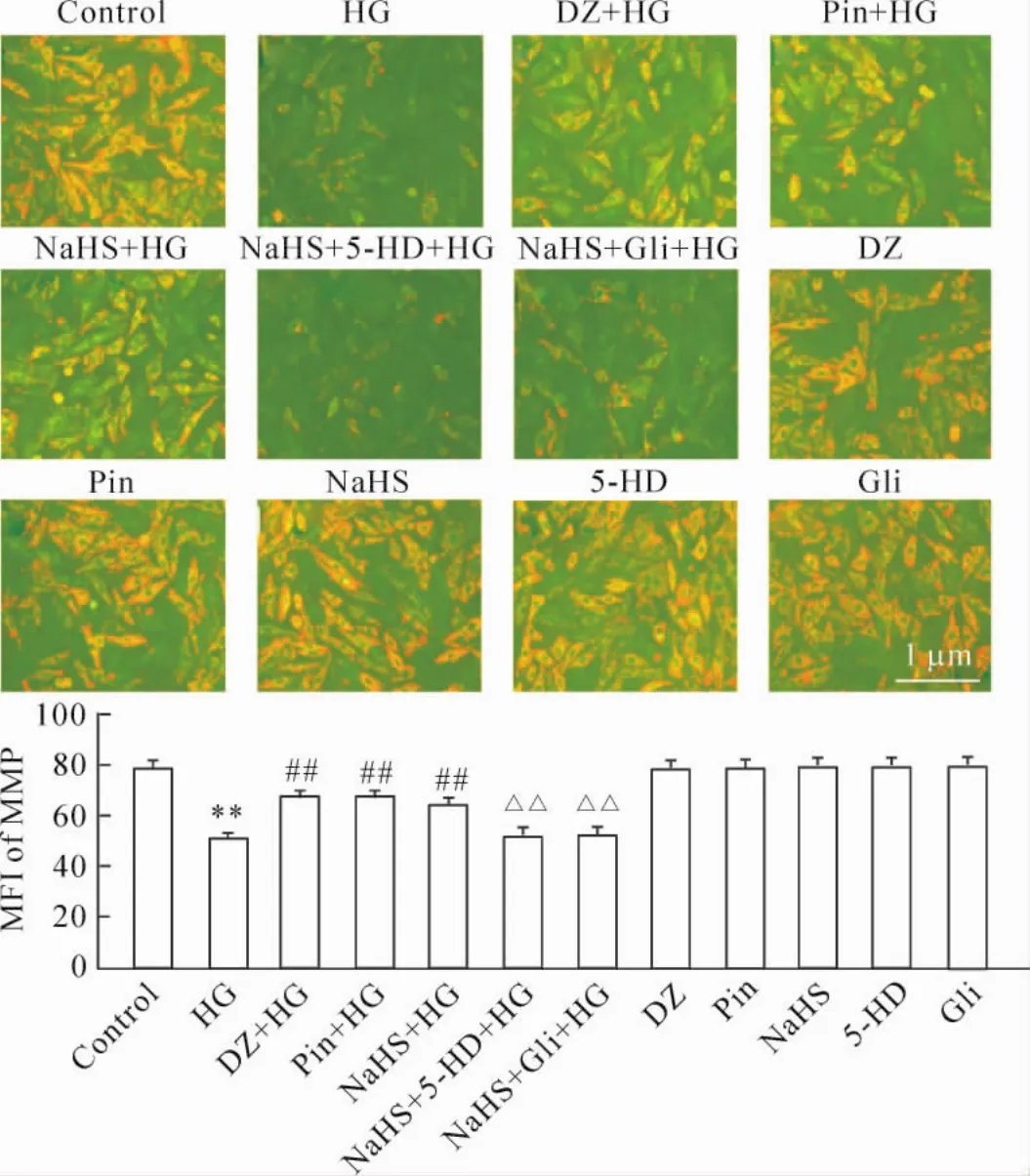
Figure 5.KATPchannelsmediated the inhibitory effect of H2S on HG-induced loss ofmitochondrialmember potential(MMP)in the H9c2 cardiac cells.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group;△△P<0.01 vs NaHS+ HG group.图5 KATP通道介导H2S对高糖致心肌细胞线粒体膜电位丢失的抑制作用
讨论
KATP通道是一种受细胞内ATP浓度调控的内向整流钾通道,它于1983年被Noma等[10]首先在心肌细胞发现。随后的研究证实,该通道还广泛存在于胰腺、平滑肌等可兴奋组织,发挥重要的生理和病理生理作用。有研究表明,高血糖可通过损伤人血管内皮细胞的KATP通道而损伤血管,但是KATP通道在高血糖损伤心肌细胞中的作用及其机制尚未完全清楚。为了探讨此重要的学术问题,本研究首先观察高糖对H9c2心肌细胞KATP通道蛋白表达的影响。研究结果表明,高糖明显地抑制H9c2心肌细胞KATP通道蛋白的表达,提示高糖可通过抑制KATP通道继而损伤心肌细胞。为了验证这个推断,本研究进一步探讨了线粒体KATP通道开放剂二氮嗪和非选择性KATP通道开放剂吡拉地尔对高糖诱导的心肌细胞毒性、细胞凋亡及线粒体损伤(MMP丢失)的作用。结果表明,二氮嗪和吡拉地尔均能明显地抑制高糖引起的心肌细胞毒性、致凋亡作用及线粒体损伤作用;而且这2种KATP通道开放剂的心肌细胞保护作用没有明显差异,提示:(1)抑制KATP通道活动可能是高糖引起心肌细胞毒性、致凋亡作用及线粒体损伤的机制之一;(2)线粒体KATP通道的开放可能在抑制高糖引起的心肌细胞损伤中起着更重要的作用,但是,要证实这一点,需要进一步观察膜KATP通道开放剂的作用,并与线粒体KATP通道开放剂的作用比较。最近,Bian等[6]报道,线粒体KATP通道和膜KATP通道介导缺血预处理引起的心肌保护作用,本文的研究结果与他们的相类似,提示KATP通道能保护心肌细胞对抗高糖引起的上述多种损伤。值得注意的是,应用于2型糖尿病治疗的磺脲类(sulfonylureas,SUs)药物,其药理作用主要是通过关闭KATP通道,促进胰岛素的分泌,从而发挥降糖作用。SUs药物自20世纪50年代起一直使用至今,目前仍为主要的口服降糖药物之一,具有方便、价廉的特点。但基于某些SUs药物能同时阻断心肌细胞KATP通道的缘故,长期应用有增加心脏病死亡率的风险。因此,对于不同的SUs药物应用于临床之前,需先对其可能的心脏损害作用作充分的评估。
最近,我们证实外源性H2S能保护H9c2心肌细胞对抗高糖引起的心肌细胞毒性、致凋亡作用和MMP丢失[8-9]。由于H2S是KATP通道的开放剂[3],KATP通道介导H2S对缺血引起心肌损伤的抑制作用[6],因此,本研究进一步探讨KATP通道在H2S保护心肌细胞对抗高糖损伤中的作用。研究结果表明,NaHS预处理能明显地减弱高糖对心肌细胞KATP通道蛋白表达的抑制作用;另一方面,线粒体KATP通道阻断剂5-羟基癸酸和非选择性KATP通道阻断剂格列本脲能显著地减弱NaHS对高糖引起的心肌细胞毒性、致凋亡作用和MMP丢失的抑制作用,提示促进KATP通道蛋白的表达及激活KATP通道可能是外源性H2S保护心肌细胞对抗高糖损伤的重要机制之一。与本研究的结果相似,Hu等[11]观察到,线粒体KATP通道在H2S抑制鱼藤酮(rotenone,为一种杀虫药)引起的神经母细胞瘤细胞SH-SY5Y的凋亡中起着重要的作用。
综上所述,本研究证实,高糖可通过抑制KATP通道损伤心肌细胞;外源性H2S可通过调控KATP通道对抗高糖引起的心肌损伤。本文为防治糖尿病心肌损伤提供了新思路。
[1]HosokiR,MatsukiN,Kimura H.The possible role of hydrogen sulfide as an endogenous smoothmuscle relaxant in synergy with nitric oxide[J].Biochem Biophys Res Commun,1997,237(3):527-531.
[2]Abe K,Kimura H.The possible role of hydrogen sulfide as an endogenous neuromodulator[J].JNeurosci,1996,16(3):1066-1071.
[3]ZhaoW,Zhang J,Lu Y,et al.The vasorelaxant effect of H2S as a novel endogenous gaseous KATPchannel opener[J].EMBO J,2001,20(21):6008-6016.
[4]Wang X,Wang Q,GuoW,et al.Hydrogen sulfide attenuates cardiac dysfunction in a ratmodel of heart failure:a mechanism through cardiac mitochondrial protection[J].Biosci Rep,2011,31(2):87-98.
[5]李建平,杨春涛,杨战利,等.CFTR氯通道在硫化氢诱导的心肌保护剂细胞增殖中的作用[J].中国病理生理杂志,2009,25(6):1070-1075.
[6]Bian JS,Yong QC,Pan TT,et al.Role of hydrogen sulfide in the cardioprotection caused by ischemic preconditioning in the rat heart and cardiac myocytes[J].JPharmacol Exp Ther,2006,316(2):670-678.
[7]Zhang Y,Tang ZH,Ren Z,et al.Hydrogen sulfide,the next potent preventive and therapeutic agent in aging and age-associated diseases[J].Mol Cell Biol,2013,33 (6):1104-1113.
[8]Xu W,WuW,Chen J,etal.Exogenous hydrogen sulfide protects H9c2 cardiac cells against high glucose-induced injury by inhibiting the activities of the p38 MAPK and ERK1/2 pathways[J].Int JMol Med,2013,32(4): 917-925.
[9]Zhuang XD,Hu X,Long M,et al.Exogenous hydrogen sulfide alleviates high glucose-induced cardiotoxicity via inhibition of leptin signaling in H9c2 cells[J].Mol Cell Biochem,2014,391(1-2):147-155.
[10]Noma A.ATP-regulated K+channels in cardiac muscle[J].Nature,1983,305(5930):147-148.
[11]Hu LF,Lu M,Wu ZY,et al.Hydrogen sulfide inhibits rotenone-induced apoptosis via preservation ofmitochondrial function[J].Mol Pharmacol,2009,75(1):27-34.
Role of ATP-sensitive potassium channels in inhibitory effect of hydrogen sulfide on high glucose-induced injury in H9c2 cardiac cells
LIANG Wei-jie1,2,CHEN Jing-fu3,ZHANG Wen-zhu1,2,MO Li-qiu4,ZHENG Dongdan3,SONG Ming-cai1,2,PANWan-ying4,FENG Jian-qiang4,LIAO Xin-xue5
(1Department of Cardiology,Central Hospital of Panyu District,2Cardiovascular Institute of Panyu District,Guangzhou 511400,China;3Cardiac Care Unit of Department of Cardiology,4Department of Anesthesiology,Huangpu Division of The First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510700,China;5Departmentof Hypertension and Vascular Diseases,The First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510080,China.E-mail:liaoxinx@mail.sysu.edu.cn)
R363
A
10.3969/j.issn.1000-4718.2015.05.003
1000-4718(2015)05-0785-06
2015-02-11[修回日期]2015-04-17
国家自然科学基金资助项目(No.81270296);广东省财政科技项目(No.2014SC107)
Tel:020-87332628;E-mail:liaoxinx@mail.sysu.edu.cn

