嗜吞噬细胞无形体msp4蛋白的生物信息学分析及表达鉴定
赵庆亮 杨素芳 梁田 张殿卿 杨霞 盛金良
(石河子大学动物科技学院 人兽共患病实验室,石河子 832003)
嗜吞噬细胞无形体msp4蛋白的生物信息学分析及表达鉴定
赵庆亮 杨素芳 梁田 张殿卿 杨霞 盛金良
(石河子大学动物科技学院 人兽共患病实验室,石河子 832003)
分析预测嗜吞噬细胞无形体msp4蛋白的抗原性,对嗜吞噬细胞无形体的msp4蛋白采用生物信息学对其进行分析二级结构,亲水性,疏水性,B细胞线性表位;根据分析的优势抗原表位区,进行基因合成并亚克隆至pET32a表达载体,在大肠埃希菌中获得重组蛋白。生物信息学分析结果显示msp4蛋白由283个氨基酸组成,分子量为29.8 ku,理论等电点为6.05,不稳定系数为32.79,总平均疏水性为0.063;二级结构预测msp4蛋白主要以无规卷曲、延伸链、α-螺旋为主;B细胞表位预测msp4蛋白有14个线性表位;根据分析的结果选取msp4蛋白亲水性高的膜外区的28-158位序列克隆至pET32a进行原核表达,在34 ku出有目的蛋白的表达。成功对嗜吞噬细胞无形体的msp4蛋白原核表达及纯化,为无形体病血清学检测方法的建立奠定了物质基础。
嗜吞噬细胞无形体;生物信息学分析;msp4蛋白;原核表达
人粒细胞无形体病(human granulocytic anaplasmosis,HGA)是由嗜吞噬细胞无形体经蜱传播一种新发的人兽共患病,临床主要表现为发热、不适、头痛及肌痛等,并伴有白细胞和血小板减少,转氨酶升高和多器官功能损伤。1994年美国首次报道该病例后[1],2006年我国首次在安徽省发现人粒细胞无形体病例[2]。该病临床症状与某些病毒性疾病相似,容易误诊,严重者可导致死亡[3]。
嗜吞噬细胞无形体(Anaplasma phagocytophilum,APH)属立克次氏体目无形体科无形体属,是专性的胞内寄生的革兰氏阴性球杆菌,直径约为0.2-2 μm,中性粒细胞是它的特异性宿主细胞[4]。嗜吞噬细胞无形体的传播媒介在我国主要为硬蜱,宿主主要有白足鼠、山羊、绵羊等家畜动物[5,6]。
目前诊断该病原的方法主要依据PCR检测和IFA(间接免疫荧光),病原分离等方法,但是这些方法要求试验条件高,不易操作,成本高等缺点。目前通过生物信息学的方法分析嗜吞噬细胞无形体的msp4基因,获取其优势抗原表位区,进行原核表达和纯化,经WB验证蛋白的免疫原性,可作为候选诊断抗原,为研究形体病的血清学检测方法的建立提供生物材料。
1 方法与材料
1.1 材料
嗜吞噬细胞无形体msp4蛋白的氨基酸序列来源于GenBank,序列登录号为AFD54597.1,E. coil DH5α和BL21(DE3)菌株及pET32a载体均由本实验室保存。琼脂糖胶回收试剂盒、质粒提取试剂盒均购自天根生化科技(北京)有限公司,T4 连接酶、EcoRⅠ和XhoⅠ限制性内切酶购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 生物信息学分析 从NCBI网站(http://www. ncbi.nlm.nih.gov/)GenBank上查找嗜吞噬细胞无形体(NY18 株)MSP4膜蛋白完整的基因序列(JQ522935.1)和氨基酸序列(AFD54597.1);利用ExPASy蛋白分析专家(http://www.Expasy.org/tools)服务器中的ProtParam程序预测蛋白的基本组成,等电点、吸光系数、脂肪族系数、亲水系数等;利用ExPASy蛋白分析专家服务器中的SOPMA程序预测蛋白的二级结构;利用在线软件TMHMM 2.0(http:// www.cbs.dtu.dk/services/TMHMM/)预测蛋白的跨膜区;利用抗原表位分析软件(Immune Epitope Database Analysis Resource)(http://tools.immuneepitope.org/ main/html/bcell_tools.html) 的Parker Hydrophilicity, Bepipred Linear Epitope方法预测蛋白亲水性和氨基酸水平的B细胞表位。
1.2.2 原核表达载体构建 根据生物信息学分析的结果,选取msp4蛋白的优势抗原区,进行人工基因合成,在两端分别添加限制性酶EcoRⅠ和XhoⅠ位点。用限制性酶切酶EcoRⅠ和XhoⅠ双酶切目的基因,同法酶切pET32a载体。用琼脂糖胶回收试剂盒将酶切的目的基因和载体回收,然后16℃过夜连接转化至DH5α感受态细胞,将转化产物涂布氨苄抗生素抗性平板,挑取抗性平板上的单个细菌进行液体培养之后,进行菌液PCR验证,PCR验证的阳性克隆菌进行37℃过夜培养后提取质粒,进行双酶切鉴定。
1.2.3 原核表达及纯化 将酶切鉴定的阳性质粒转化至表达菌BL21感受态细胞,挑取阳性转化表达菌进行培养,37℃摇床培养至OD600为0.45-0.6,在不同浓度(0.2、0.4、0.6、0.8和1.0 mmol/L)诱导剂IPTG,不同时间(2、6、6和8 h)条件下诱导pET32a-msp4重组蛋白的表达,于诱导前收菌1 mL,诱导的不同时间段收菌1 mL,离心菌液进行SDSPAGE分析。此外,另取100 mL经诱导6 h的菌液,收集菌体沉淀,用5 mL的PBS重悬菌体,超声破碎菌体(工作循环30次,超声10 s,间隔10 s),然后将裂解液离心,分别收集上清和沉淀(包涵体)进行SDS-PAGE分析。鉴别目的蛋白是以可溶性形式存在于上清液中还是以包涵体形式存在于沉淀中。对以包涵体形式表达的重组蛋白用8 mol/L浓度尿素进行变性处理,包涵体溶解后采用镍离子亲和层析法纯化,将纯化的蛋白利用透析袋复性,对复性蛋白进行SDS-PAGE分析。
1.2.4 重组msp4蛋白的多抗制备及Western blotting鉴定 取纯化的msp4重组蛋白200 μg与等量的弗氏完全佐剂混合,充分乳化后免疫小白鼠,2周后100 μg的蛋白与等量的弗式不完全佐剂混合进行加强免疫,末次加强免疫剂量为50 μg/只,第3次免疫10 d后心脏采血,分离血清,进行Western blotting 鉴定。纯化的msp4重组蛋白经SDS-PAGE电泳分析后,转印至硝酸纤维素膜上,5%脱脂奶粉37℃封闭1 h,将免疫过小白鼠分离的血清作为一抗(1∶100)作用1 h,用TBST洗涤3次,加入HRP标记的羊抗鼠(1∶5 000)作用1 h,TBST缓冲液洗涤3次,在二氨基联苯胺(DAB)缓冲溶液中显色3-5 min后加去离子水终止。
2 结果
2.1 msp4的生物信息学分析结果
2.1.1 ProtParam工具分析结果 根据ProtParam软件预测表面msp4基因编码的蛋白分子式为:C1333H2035N347O413S10,分子量为29.8 ku,理论等电点为6.05;msp4蛋白的组成含量最多的氨基酸是:Ser(13.5%),Ala(11%),Gly(9.6%),Val(8.2%);Leu(6.0%),Asn(5.7%),Tyr(5.7%);带负电荷的氨基酸残基(Asp+Glu)为24,带正电荷的氨基酸残基(Arg+Lys)为21;不稳定系数为32.79,为稳定蛋白(标准40以下的为稳定蛋白);预测的半衰期30 h(体外哺乳动物网状细胞),>20 h(酵母菌体内),>10 h(大肠杆菌体内);脂肪系数平均为78.90,总平均疏水性为0.063。
2.1.2 SOPMA预测msp4蛋白的二级结构 利用ExPASy蛋白分析专家服务器中的SOPMA程序对msp4蛋白的二级结构进行预测。预测msp4蛋白的二级结构包括282个氨基酸,其中129个氨基酸(占45.74%)可能形成无规卷曲(c),75个氨基酸(占26.60%)可能形成延伸链(e),57个氨基酸(占20.21%)可能形成α-螺旋(h),21个氨基酸(占7.45%)可能形成β-转角(t)。无规卷曲结构主要位于氨基酸的第10-12、30-40、52-61、87-99、154-161、242-260区段;α-螺旋结构主要位于氨基酸的第1-8、13-20、126-135、205-212区段,延伸链结构在氨基酸中的分布均一。由以上预测结果可知该蛋白质主要以无规卷曲、延伸链、α-螺旋为主。
2.1.3 msp4蛋白的跨膜区预测结果 借用TMHMM 2.0在线软件预测蛋白的跨膜区(图1)。从图1中可看出大约第1-6位氨基酸位于膜内的可能性比较大,第30-282位氨基酸位于膜外的可能性比较大,第7-29位氨基酸可能存在跨膜区。
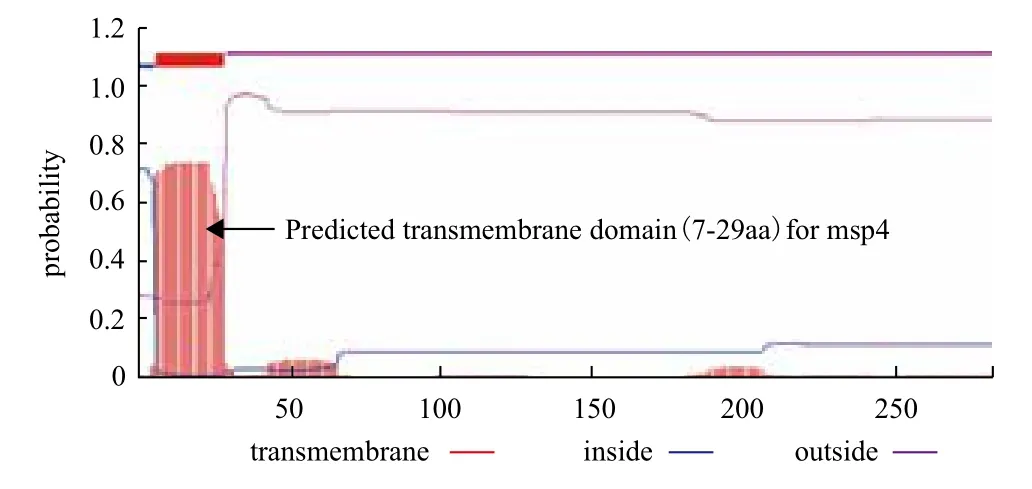
图1 TMHMM2.0预测msp4蛋白跨膜区
2.1.4 msp4蛋白的亲水性预测结果 对msp4蛋白的亲水性分析结果见图2。结果显示该蛋白包含多个亲水性区域,主要分布在27-43、51-56、64-98、110-145、152-159、217-221、235-238、249-269这个区段,其中27-43、64-98、135-145区段亲水性较高。
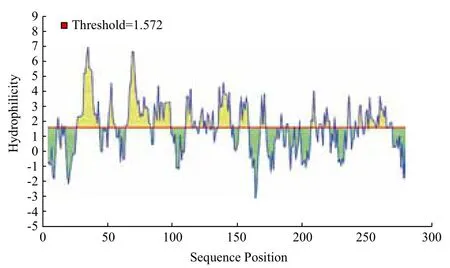
图2 msp4蛋白的亲水性分析
2.1.5 msp4蛋白的抗原表位分析 根据蛋白表位分析中的B细胞线性表位分析模块分析msp4蛋白结果见图3,msp4蛋白包含有14个线性表位,其中以 28-42、50-59、65-77、87-100、111-118、135、137-138、140-143、154-158、188-190、245-251、253-257、259-263区段是msp4蛋白的优势抗原表位区段,明确msp4蛋白的线性表位区段,为获得特异性的抗原区段提供了较好的依据。
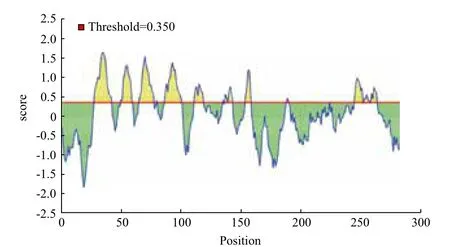
图3 msp4蛋白的B细胞线性表位预测
2.2 原核表达载体的构建
选取msp4蛋白的优势抗原区段第28-158位氨基酸作为目的表达基因进行人工合成,将目的基因连到pET32a原核表达载体,经双酶切验证目的基因插入到表达载体,测序结果表明,合成的基因序列正确无误的插入到pET32a原核表达载体
2.3 pET32a-msp4原核表达和纯化
在37℃、IPTG浓度为1.0 mmol/L诱导时间为6 h时,蛋白表达条件最佳(图4)。将诱导收集菌液超声破碎,分别收集上清液和沉淀进行SDS-PAGE分析,结果显示目的蛋白大部分都是以包涵体的形式存在,包涵体经尿素变性、镍离子亲和层析法纯化及透析复性后进行SDS-PAGE电泳分析,结果显示获得了分子量为34 ku的msp4重组蛋白。
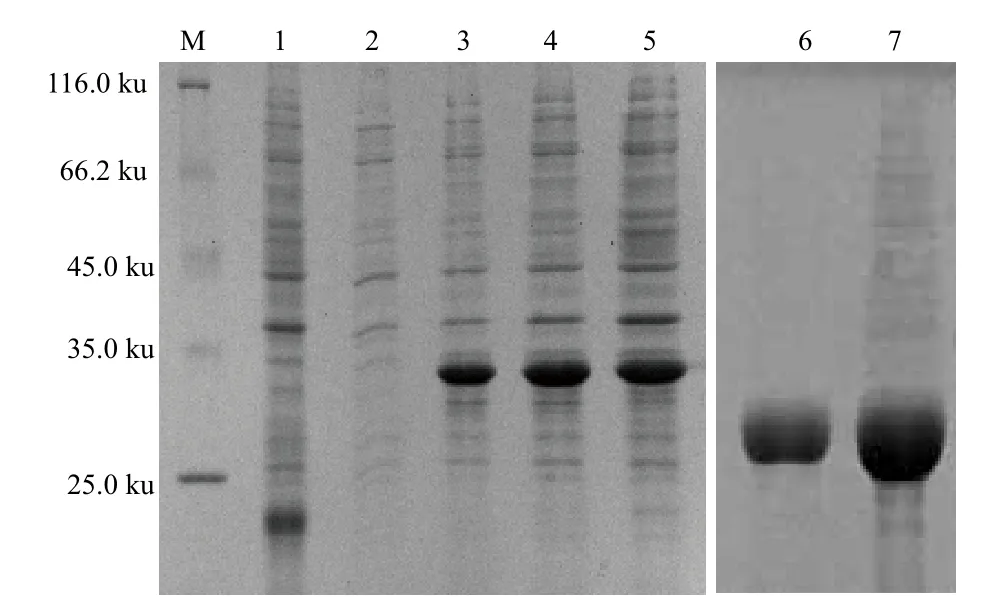
图4 msp4重组蛋白的SDS-PAGE电泳分析
2.4 重组msp4蛋白多抗效价测定和Western blotting鉴定
以纯化的重组msp4蛋白为包被抗原,利用间接ELISA对纯化后的多抗进行了效价测定,以多抗孔的OD值对阴性对照孔的OD值的比值(P/N)大于2.1时,多抗的最高稀释度为多抗的效价。结果表明,纯化后的多抗效价为1∶51200。
取纯化的重组msp4蛋白做SDS-PAGE,然后将纯化的多抗作为一抗进行Western blotting检测。结果(图5)表明多抗能与重组msp4蛋白发生特异性反应。

图5 Western blotting分析结果
3 讨论
嗜吞噬细胞无形体作为一种新发的人兽共患病原体,可以引起反刍动物的蜱咬热[7]、马边虫病[8]、HGA[9]。自1994年美国首次报道人粒细胞无形体病例,嗜吞噬细胞无形体引起人粒细胞无形体病的报道日益增多,2010年Huang等[10]报道HGA是美国第二大的蜱传播的疾病。美国从2000年至2010年人粒细胞无形体病的发病例由348例增加至1 761例,平均每百万人1.4个病例上升至每百万6.1个病例。分子生物学及人群血清学检测证实该病原体在中国及周边国家存在,2006年天津地区的高危人群人粒细胞无形体病的阳性率为8.8%[11],2009年山东沂源地区正常人群人粒细胞无形体IgG抗体阳性率为26.7%[12],2011年张丽娟等[13]报道新疆伊犁地区人无形体IgG抗体阳性率为5.3%,2013年刘志杰等[14]报道甘肃地区的绵羊的PCR检出率为42.9%,山羊为38.5%;说明我国存在自然感染的嗜吞噬细胞无形体,可能会给人们的健康安全带来危害。
目前嗜吞噬细胞无形体诊断的主要方法有:外周血涂片镜检中性粒细胞内可见桑葚状包涵体;急性期特异性IgM阳性;急性期及恢复期双份血清免疫荧光法(IFA)检测到特异抗体(IgG)滴度升高或降低4倍及以上;急性期全血或血细胞标本PCR检测到嗜吞噬细胞无形体特异性核酸阳性,且序列分析证实与嗜吞噬细胞无形体的同源性达99%以上等,其中以IFA和PCR为重要的检测手段。国内关于无形体病的血清学检测的方法研究较少,目前国内的主要检测使用的是美国FOCUS生产的无形体IgG免疫荧光试剂盒,缺少于成品检测试剂盒,这就对国内的嗜吞噬细胞无形体的快速诊断提出了挑战。Zhi等[15]对嗜吞噬细胞无形体44 kD蛋白成功实现了原核重组表达,并对重组表达产物进行了血清学诊断评价,结果显示用重组蛋白作为抗原进行诊断特异性和一致性更明显,而且通过原核表达制备重组蛋白远比培养细胞、转染、收集菌体、纯化抗原的途径简单得多。Msp4蛋白是嗜吞噬细胞无形体的一个主要表面蛋白,本试验利用生物信息的方法对msp4蛋白进行分析,通过分析获得msp4优势抗原区段,进行原核表达,并进行蛋白纯化。可以将重组纯化的msp4蛋白作为血清学检测的备选材料,为无形体的血清学方法的建立奠定了基础。
4 结论
嗜吞噬细胞无形体的msp4基因含有完整的开放阅读框(846 bp),编码283个氨基酸,分子量为29.8 ku,理论等电点为6.05;二级结构预测msp4蛋白主要以无规卷曲、延伸链、α-螺旋为主;B细胞表位预测msp4蛋白有14个线性表位。根据分析的结果选取msp4蛋白亲水性高的膜外区的28-158位序列克隆至pET32a进行原核表达,在34 ku出有目的蛋白的表达。
[1] Chen SM, Dumler JS, et al. Identification of a granulocytotropic Ehrlichia species as the etiologic agent of human disease[J]. Journal of Clinical Microbiology, 1994, 32(3):589-595.
[2] Zhang L, liu Y, et al. Nosocomial transmission of human granulocyitc anaplasmosis in China[J]. JAMA, 2008, 300(19):2263-2270.
[3]Dumler JS, Choi KS, Garcia-Garcia JC, et al. Human granulocytic anaplasmosis and Anaplasma phagocytophilum[J]. Emerging Infectious Diseases, 2005, 11(12):1828-1834.
[4]Dumler JS, Barbet AF, Bekker CP, et al. Recorganization of genera in the families Rickettsiaceae and Anaplasmataceae in the order Rickettsiales:unification of some species of Ehrlichia with Anaplasma, Cowdria with Ehrlichia and Ehrlichia with Neorickettsia,descriptions of six new species combinations and designation of Ehrlichia equi and ‘HGE agent’ as subjective synonyms of Ehrlichia phagocytophila[J]. International Journal of Systeatic and Evolutionary Mcirobiology, 2001, 51(6):2145-2165.
[5] Dumler JS, Choi KS, Garcia-Garcia JC, et al. Human ganulocytic anaplaosis and anaplama phagocytophilum[J]. Emerging Infectious Disease, 2005, 11(12):1828-1834.
[6] Ijdo JW, Meek JI, Cartter ML, et al. The emergence of another tickborne infection in the 12-town area around Lyme, Connecticut:huamn granulocytic ehrlichiosis[J].Journal of Infectious Diseases,2000, 181(4):1388-1393.
[7] Nieder M, Silaghi C, Hamel D, et al. Tick-borne fever caused by anaplasma phagocytophilum in Germany:first laboratory confirmed case in dairy cattle herd[J]. Tierarzliche Praxis. Ausgabe G,Grosstiere/Nutziere, 2012, 40(2):101-106.
[8] Silaghi C, Liebisch G, Pfister K. Genetic variants of Anaplasma phagocytophilum from 14 equine granulocytic anaplasmosis cases[J]. Parasites & Vectors, 2011, 4(1):1-9.
[9] Bakkern JS, Dumler S. Human granulocytic anaplasmosis[J]. Infectious Disease Clinics of North America, 2008, 22(3):433-448.
[10] Huang B, Troese MJ, et al. Aaaplasma phagocytophilum APH_1387 is expressed throughout bacterial intracellular development and localizes to the pathogen-occupied vacuolar membrane[J]. Infection and Immunity, 2010, 78(5):1864-1873.
[11] Zhang L, Shan A, Mathew B, et al. Rickettsial seroepidemiology among farm workers, Tianjin, People’s Republic of China[J]. Emerging Infectius Diseases, 2008, 14(6):938-940.
[12]张丽娟, 崔峰, 王玲, 等.山东省沂源县无形体病实验室调查分析[J].传染病信息, 2009, 22(1):21-25.
[13]范德生, 禹惠兰, 吴保新, 等. 新疆伊犁地区无形体流行病学调查及病原序列分析[J]. 中国人兽共患病学报, 2011, 27(4):327-330.
[14] Yang J, Liu Z, Guan G, et al. Prevalence of Anaplasma phagocytophilum in ruminants, rodents and ticks in Gansu, north- western China[J]. Journal of Medical Microbiology, 2013, 62(2):254-258.
[15]Zhi N, Ohashi N, Rikihisa Y, et al. Cloning and expression of the 44-kilodalton major outer membrane protein gene of the human granulocytic ehrlichiosis agent and application of the recombinant protein to serodiagnosis[J]. Journal of Clinical Microbiology,1998, 36(6):1666-1673.
(责任编辑 李楠)
Expression and Bioinformatics Analysis of the msp4 Protein of Anaplasma Phagocytophilum
Zhao Qingliang Yang Sufang Liang Tian Zhang Dianqing Yang Xia Sheng Jinliang
(College of Animal Science and Technology of Shihezi University,Shihezi 832003)
The purpose of this study was to analysis the antigenicity of msp4 protein of anaplamsa phagocytophilum. The informatics analysis was used to predict and analyze the important parameters of the msp4 protein, such as the physical and chemical properties, protein secondary structure, and its hydrophilicity, hydrophicity, bepipred linear epitope. According to the advantage epitope, we selected the high hydrophilic region of protein membrane outside domains, and cloned to pET32a prokaryotic expression vector. The bioinformatics analysis revealed that the msp4 protein was composed of 283 amino acids, and that its isoelectric point was 6.52. The msp4 protein was an stable hydropathilic protein(the instablility coefficient was 32.79, the grand average of hydropathicity was 0.063). The secondary structure of the msp4 protein was mainly composed of random coils, extended strands, and alpha helixes. B cell epitope predicted that the msp4 protein has 14 linear epitopes. From the result of bioinformatics analysis, we selected the the 28-158 aa of the high hydrophilic region of protein membrane outside domains, and cloned to pET32a prokaryotic expression vector, the msp4 protein was successfully expressed and purified. The expressed and purified the recombinant msp4 protein lays a material foundation for the establishment of serological methods for anaplasma phaagocytophilum detection.
anaplasma phagocytophilum;bioinformatics analysis;msp4 protein;prokaryotic expression
10.13560/j.cnki.biotech.bull.1985.2015.01.034
2014-02-20
国家重点基础研究发展计划资助(2010CB53020X)
赵庆亮,男,硕士研究生,研究方向:动物疾病病理;E-mail:zhaoqingliang2009@126.com
盛金良,副教授,E-mai:sjlshz@126.com

