DINP皮肤暴露对小鼠过敏性皮肤炎症的佐剂作用
张焕云,吴 卓,戴佳佳,秦懿偲,李金泉,杨 旭(华中师范大学生命科学学院,湖北 武汉 430079)
DINP皮肤暴露对小鼠过敏性皮肤炎症的佐剂作用
张焕云,吴 卓,戴佳佳,秦懿偲,李金泉,杨 旭*(华中师范大学生命科学学院,湖北 武汉 430079)
为了探究新型增塑剂邻苯二甲酸二异壬酯(DINP)对小鼠过敏性皮肤炎症的影响,采用皮肤染毒的暴露方式,56只SPF级雄性Balb/C小鼠随机平均分为7组处理40d.用0、1.4、14和140mg/kg DINP对小鼠进行皮肤染毒,并用抗氧化剂褪黑素设置2组来探究氧化应激的介导作用,以及1组生理盐水对照组.染毒结束后取耳组织测定耳肿指数和双耳重量差,并制作耳组织病理学切片,最后检测氧化应激指标.实验结果显示, 14和140mg/kg DINP皮肤暴露组的皮肤炎症有明显加剧(P<0.01),氧化应激指标也有明显变化(P <0.01).这表明,一定浓度的DINP,经较长时间的暴露,对小鼠过敏性皮肤炎症具有明显的佐剂作用.并且,随着DINP浓度升高,小鼠机体氧化应激过度活化,造成机体组织或细胞的氧化损伤,并加剧了炎症反应.
邻苯二甲酸二异壬酯;过敏性皮肤炎症;皮肤暴露;佐剂效应;氧化损伤
邻苯二甲酸酯类增塑剂(PAEs)是一类广泛应用于塑料产品中的化学助剂,在增塑剂市场中占主导地位[1-2].但如使用不当,将会对人体健康造成危害[3-7].
DINP是一种新型PAEs类增塑剂.DINP代谢物可通过生物介质检测到,如血液、尿液[8]. DINP在生殖发育毒性方面比传统增塑剂安全许多,但目前对其非生殖发育毒性的研究甚少.有研究表明,如果人类长期使用含PAEs类物质的护肤品,尿液中相关代谢物水平会明显升高[9].鉴于世界各国对新型增塑剂的推广,对其非生殖发育毒性的研究很有必要.
丹麦学者Larsen等[10-11]对DEHP(一种传统PAEs类增塑剂)的毒理学研究发现DEHP对小鼠的气道炎症有一种“环境佐剂效应”.研究者普遍认为PAEs类增塑剂对机体产生各种伤害的原因在于其对细胞的氧化损伤作用,并且不少实验也证实了这一观点的正确性[12-14].然而,鲜有研究涉及到DINP对小鼠过敏性皮肤炎症的影响,并将DINP导致组织和细胞氧化损伤与其过敏性皮炎的影响联系起来.因此,本实验选择研究DINP对小鼠过敏性皮肤炎症的影响,希望为今后的深入研究做出一定的贡献.
皮肤接触是DINP常见的暴露方式之一[15],但往往也易忽视.人造化学品很可能是近年来人类过敏性疾病发病率上升的主要因素[16-17].有研究指出,室内降尘中PAEs污染需引起关注[18].因此,本文研究了DINP经皮肤暴露时对小鼠过敏性皮炎的影响,对于相关职业的特殊人群预防过敏性疾病具有参考意义.
1 材料与方法
1.1 实验材料
1.1.1 实验动物 雄性Balb/C小鼠,5~6周龄,体重(22±1.5)g,由湖北省疾病预防控制中心实验动物饲养所提供.实验开始前,先对小鼠进行一周的适应性喂养.
1.1.2 主要仪器 5415R低温冷冻离心机(德国Eppendorf公司)、FLx800荧光酶标仪(美国Bio-Tek公司)、DM 4000B电子显微镜(德国Leica公司)、HH-42三用电热恒温水箱(北京市长源实验仪器厂)、MSI涡旋仪(IKA公司)、DNM-9602酶标分析仪(北京普朗新技术有限公司)、-70℃冰箱(日本三洋).
1.1.3 主要试剂 邻苯二甲酸二异壬酯(DINP,美国Sigma-Aidrich公司)、异硫氰酸荧光素(FITC,美国Sigma-Aidrich公司)、丙酮(美国Sigma-Aidrich公司)、吐温80(美国Amresco公司)、4%多聚甲醛溶液(美国Sigma-Aidrich公司)、2,7-二氯荧光黄双乙酸盐(DCFH-DA,美国Sigma-Aidrich公司,纯度大于97%)、硫代巴比妥酸(TBA,上海试剂二厂),其他试剂均为国产分析纯级.GSH和蛋白质试剂盒均购自南京建成生物工程研究所.
1.2 染毒方法
1.2.1 DINP浓度的选择 根据美国消费品安全委员会(CPSC)规定,DINP的人的每日耐受量为0.12mg/(kg·d)[19],根据小鼠与人用药量换算公式得出,DINP的小鼠的每日耐受量为1.4mg/kg.所以,选取1.4mg/kg为本实验的最低染毒浓度.同时,按照1:10比例等比增加两个染毒浓度,即14和140mg/kg DINP,用来模拟高浓度DINP暴露条件,检测其暴露后的毒性效应.
1.2.2 溶液的配制 (1)DINP染毒液的配制:DINP与吐温80按照1:1的比例混匀,然后用灭菌的生理盐水将其配制成140mg/kg的原液,原液用生理盐水稀释后得到14mg/kg、1.4mg/kg的染毒液.每天皮肤涂抹DINP的体积与小鼠体重的比值是4μL/g(此比例时染毒液不易滴下).因此配制50mL 140mg/kg DINP: 1.8mL DINP+ 1.8mL吐温80 + 46.4mL生理盐水.(2)0.5%FITC的配制:0.5%FITC (W/V) 致敏剂是以FITC为溶质,DBP和丙酮(1:1)为溶剂均匀混合而成,室温超声混匀并现配现用.单纯使用0.5% FITC不能使小鼠成为敏感模型,DBP充当着必要的诱导作用[20].(3)褪黑素溶液(MT, 30mg/kg):MT溶液体积与小鼠体重的比值为10μL/g,用3%的无水乙醇助溶.如配10mL MT溶液:30mg MT+9.7mL生理盐水+300μL无水乙醇.
1.2.3 实验分组 将56只Balb/C小鼠随机平均分为7组,每组8只.A组: 生理盐水皮肤暴露+溶剂对照(DBP和丙酮1:1配制)染毒;B组: 生理盐水皮肤暴露+0.5% FITC致敏;C 组: 1.4mg/(kg·d) DINP皮肤暴露+0.5%FITC致敏;D组: 14mg/(kg·d)DINP皮肤暴露+0.5%FITC致敏;E组: 140mg/(kg·d)DINP皮肤暴露+0.5%FITC致敏;F组:140mg/(kg·d)皮肤暴露+0.5% FITC + MT;G组:生理盐水皮肤暴露+0.5%FITC+MT.
1.3 DINP皮肤暴露动物模型的建立
将7组小鼠分别在背部减去大致相同面积的毛发并每天分别涂抹0、1.4、14、140mg/kg剂量的DINP,一共涂抹40d.第41~42d,A组和G组腹部涂抹120μL对照溶剂,B-F组的腹部涂抹120μL 0.5%FITC进行致敏.第47d时,B-F组的右耳涂抹20μL 0.5%FITC进行激发,左耳涂对照溶剂.A组和G组的左右耳均涂对照溶剂.F组和G组为MT保护组,以灌胃的方式摄入相同浓度的MT(图1).

图1 实验分组与染毒流程Fig.1 The experimental groups and the exposure process
1.4 耳肿胀程度的检测
耳肿胀程度用耳肿指数和双耳重量差来表示,分别使用电子游标卡尺和分析天平测量.小鼠耳肿指数用48d时小鼠左右耳同一位置厚度差来表示;分别用8mm打孔器在小鼠双耳对称位置取下相同大小的耳部组织,分析天平称重并计算小鼠双耳质量差.
1.5 耳组织病理学检测和细胞计数
耳肿胀程度检测结束之后,取小面积右耳组织于室温下用4%的多聚甲醛固定,常规脱水,石蜡包埋,H&E染色,DM 4000B电子显微镜下观察右耳组织的病理组织学变化.我们通过对H&E染色切片的细胞计数来分析细胞浸润的情况.
1.6 组织匀浆和氧化应激指标的检测
1.6.1 组织匀浆的制备 收集小鼠右耳组织,将小鼠右耳组织在预冷的PBS (pH7.5) 中漂洗,滤纸拭干,然后在冰上用玻璃匀浆器将耳组织和预冷的PBS进行匀浆,制成10%匀浆液,于4℃,10000r/min离心后取上清,保存于-70℃冰箱,用于氧化应激指标ROS、GSH和MDA的检测.
1.6.2 活性氧(ROS)水平的检测 细胞中ROS含量是反映细胞内氧自由基水平的主要指标.过量的活性氧物质会导致机体产生氧化应激作用.ROS含量采用DCF荧光法测定.将上清液用PBS稀释500倍,将浓度为10mmoL/L的DCFHDA荧光染料用PBS稀释1000倍,各取100μL于酶标板中排列,在37℃条件下避光反应10min后,用荧光酶标仪测量其在485nm激发光,528nm发射光下的荧光强度.
1.6.3 还原型谷胱甘肽(GSH)含量和蛋白含量的测定 GSH可以和ROS结合形成硫代半缩醛,并通过抗坏血酸-谷胱甘肽循环生成具更强抗氧化作用的抗坏血酸.GSH含量和蛋白质含量的测定均要严格按照试剂盒操作说明进行.
1.6.4 丙二醛(MDA)含量的测定 过量的ROS还可使脂质发生过氧化反应,MDA是脂质过氧化反应的最终代谢产物之一,其水平高低代表脂质过氧化的强度.MDA含量的测定采用硫代巴比妥酸(TBA)法.取0.5mL10%的小鼠肺组织匀浆于10mL离心管中,加入2mL 0.6%的TBA溶液,之后将所有离心管置于沸水浴中,在沸水浴期间,MDA可以与TBA反应生成粉红色的发色团.沸水浴15min后取出所有离心管,并迅速将其放置于流动的冷水中降温,待样品冷却之后,取出离心管,吸取1mL混合液,在10000r/min条件下离心10min.离心完毕,取200μL于酶标板中排列,用全波长酶标仪分别在450、532和600nm波长下测定吸光度,最后按照公式计算MDA含量:

式中:A为吸光度.
1.7 统计学分析
实验数据均采用SPSS12.0统计分析软件对实验结果进行单因素方差分析(ANOVA),随后采用LSD法进行两两对比,P<0.05为有统计学意义.用于表示结果的柱状图均是由GraphPad Prism 5统计分析软件绘图.
2 实验结果
2.1 耳肿胀程度
通过测量双耳的耳肿指数和双耳重量差来反映小鼠的耳部肿胀程度.
图2和图3分别展示了小鼠耳肿指数和双耳质量差.与A组相比,B-E组小鼠右耳出现均明显肿胀现象;与B组相比,D、E组的小鼠耳肿胀程度更严重,DINP浓度越高,耳肿胀越严重;与E组相比,F组小鼠耳肿胀程度明显减轻,具有极显著性差异(P<0.01).
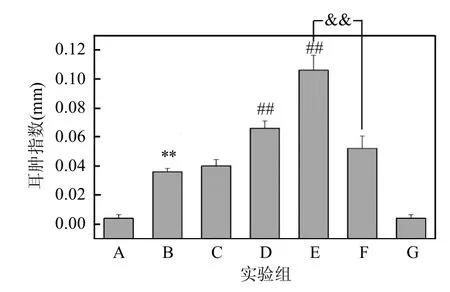
图2 小鼠双耳耳肿指数的结果Fig.2 The result of ear swelling index*:P<0.05, **:P<0.01,与A组相比;#:P<0.05, ##:P<0.01,与B组相比;&&:P<0.01,E组与F组相比
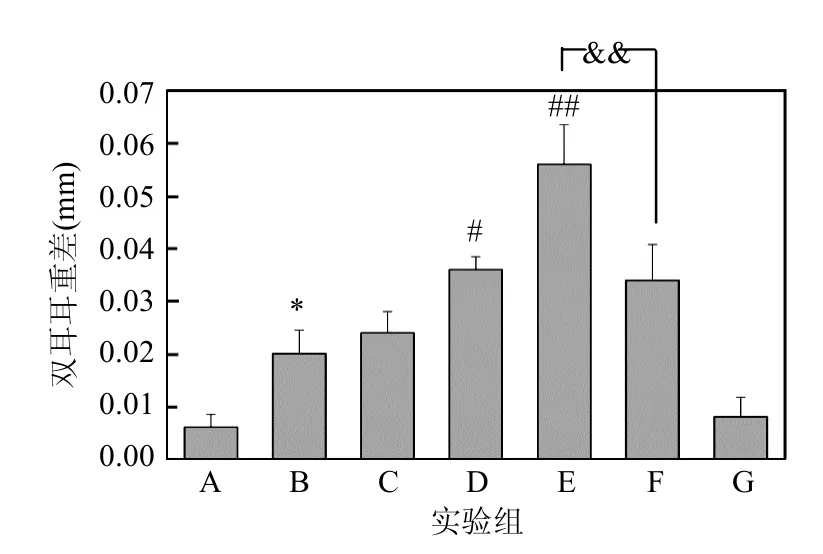
图3 小鼠双耳耳重差的结果Fig.3 The result of difference of bilateral ear weight**:P<0.01,与A组相比;##:P<0.01,与B组相比;&&:P<0.01,E组与F组相比
2.2 耳组织病理学H&E染色切片及细胞计数
本实验小鼠耳组织的病理学变化通过H&E染色切片来表现,用以反应小鼠耳组织肿胀以及细胞浸润情况,并结合IPP软件对H&E染色的切片进行了细胞计数,直观的反映细胞浸润的情况(如图4所示,黑色箭头表示细胞浸润).A组小鼠耳组织并没有出现明显的病理学变化和细胞浸润的现象;与A组相比,B-E组的小鼠右耳耳肿胀现象明显并随着DINP暴露浓度的升高而加重;同时,细胞浸润数量出现明显增多,最严重的组为E组,可见明显的蓝色染色细胞核,细胞计数具有极显著差异(P<0.01);与E组相比,F组小鼠耳组织耳肿胀程度明显减轻,细胞浸润数量也显著减少(P<0.05).
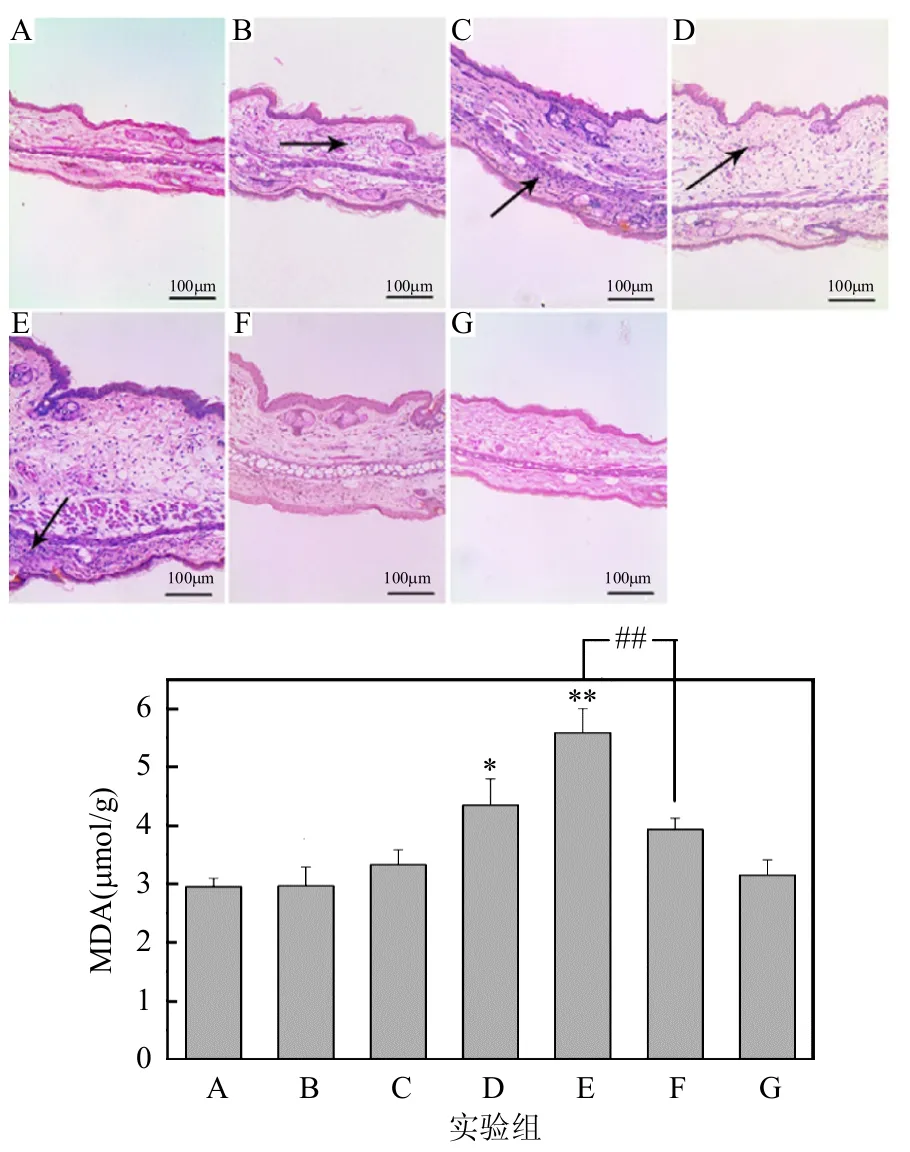
图4 小鼠耳部组织H&E染色和细胞浸润计数结果Fig.4 The mice ear organization H&E staining and the counting result of cell infiltration**:P<0.01,与A组相比;#:P<0.05,与B组相比;&:P<0.05,E与F组相比;黑色箭头:细胞浸润
2.3 耳组织氧化应激指标的检测
2.3.1 ROS水平的检测 图5是各组小鼠右耳组织的ROS含量检测结果.可以看出:与A组相比,D、E组ROS含量明显升高,具有显著性差异(P<0.05,P<0.01);与B组相比,D、E组ROS含量明显升高,且具有显著性差异(P<0.05,P<0.01);F组与E组相比, ROS含量明显降低,且具有极显著差异(P<0.01).
2.3.2 GSH水平的检测 图6表示的是小鼠右耳GSH含量的检测结果,可以看出:与A组相比,B组GSH含量明显降低,具有显著性差(P<0.05),C、D、E组GSH含量明显降低,具有极显著差异(P<0.01);与B组相比,D组和E组GSH含量均明显降低,且具有极显著性差异(P<0.01);F组与E组相比,GSH含量明显升高,且具有极显著差异(P<0.01).
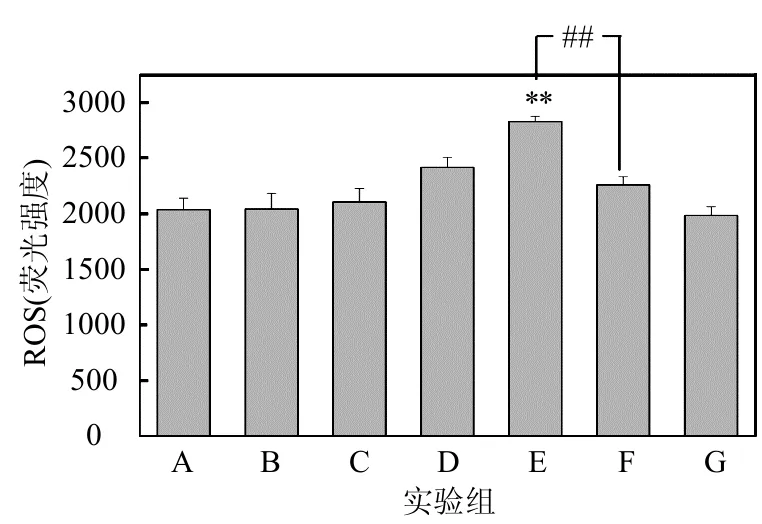
图5 小鼠右耳ROS含量的结果Fig.5 The result of ROS content in mice right ears *:P<0.05, **:P<0.01,与A组相比;#:P<0.05, 与B组相比;&&:P<0.01,E组与F组相比
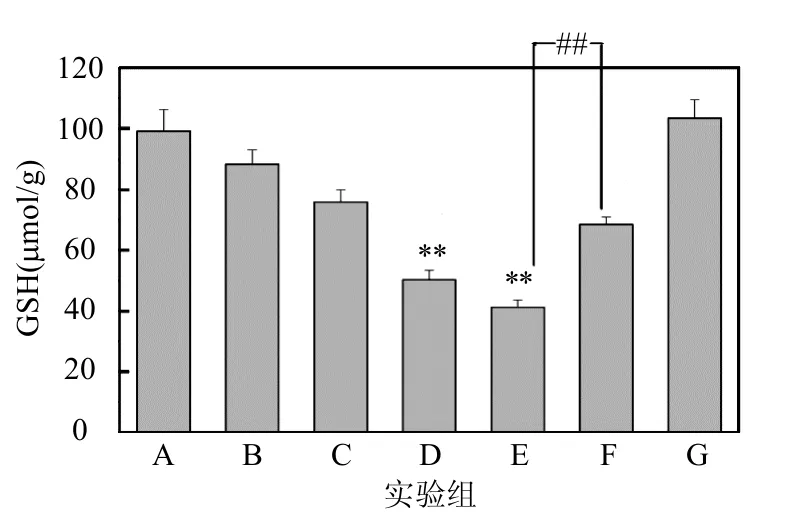
图6 小鼠右耳GSH含量的结果Fig.6 The result of GSH content in mice right ears*:P<0.05, **:P<0.01,与A组相比;##:P<0.01,与B组相比;&&:P<0.01,E组与F组相比
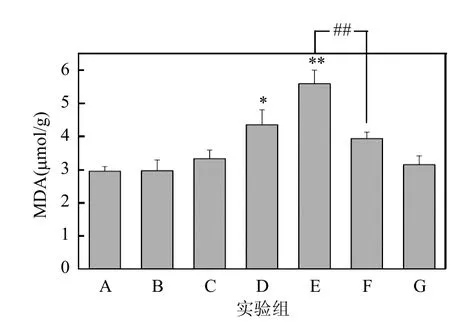
图7 小鼠右耳MDA含量的结果Fig.7 The result of MDA content in mice right ears*:P<0.05, **:P<0.01,与A组相比;##:P<0.01,与B组相比;&:P<0.05,E组与F组相比
2.3.3 MDA水平的检测 图7是MDA含量的检测结果:与A组相比,D,E组MDA含量明显升高,具有显著性差(P<0.05,P<0.01);与B组相比,E组MDA含量明显升高,具有极显著差异(P<0.01);F组与E组相比,MDA含量明显降低,且具有极显著差异(P<0.01).
3 讨论
3.1 小鼠耳肿胀程度和组织病理学变化
耳肿胀程度是本实验中最直接的观测指标,也是评价该暴露模型严重程度的重要指标之一[21].在40d的DINP(14和140mg/kg)皮肤暴露后,小鼠对于过敏原的刺激更为敏感,表现在耳肿胀程度加重、耳部组织结构破坏和细胞浸润严重等方面.这些变化直观地向我们展示了DINP长期皮肤暴露的危害.
3.2 小鼠氧化应激指标的变化
单纯过敏原刺激或在低浓度DINP辅佐下引起的小鼠过敏性皮炎并没有出现明显的氧化应激效应.但是,在高浓度DINP辅佐作用下,炎症反应加重到一定程度时,就会引起小鼠组织和细胞氧化应激效应增强,并造成氧化损伤,导致ROS和MDA含量升高,GSH含量下降.褪黑素是一种重要的脂溶性抗氧化剂,在本研究中,高剂量染毒+褪黑素和生理盐水+褪黑素与高剂量组和生理盐水组相比较,右耳的ROS、MDA的含量均有所下降,GSH含量上升,说明发生炎症的小鼠体内确实产生了氧化损伤.
4 结论
一定浓度的DINP,经较长时间的暴露,对小鼠过敏性皮肤炎症具有明显的佐剂作用,能够明显增强小鼠的皮肤炎症;这种毒性作用可被MT所拮抗.表明氧化应激/损伤途径在小鼠皮肤炎症反应中起介导作用.
[1]郑文芝,周勇强,张霖霖, PVC塑料制品中增塑剂PAEs在水环境中迁移规律的研究 [J]. 广东化工, 2006,33(3):29-30.
[2]王立鑫,赵 彬,刘 聪,等.中国室内SVOC污染问题评述 [J].科学通报, 2010,55(11):967-977.
[3]Swan S H, Main K M, Liu F, et al. Decrease in anogenitaldistance among male infants with prenatal phthalate exposure [J]. Environ. Health Persp., 2005,113(8):1056-1061.
[4]Raymond M D, Mechael R M, Dean C F, et al. Chronic toxicity of di (2-ethylhexyl) phthalate in rats. [J]. Toxicol. Sci., 2000,55(2):433-443.
[5]Yang G T, Qiao Y K, Li B, et al. Adjuvant effect of di-(2-ethylhexyl) phthalate on asthma-like pathological changes in ovalbumin-immunised rats.[J]. Food and Agricultural Immunology, 2008,19(4):351-362.
[6]Cho S C, Bhang S Y, Hong Y C et al. Relationship between environmental phthalate exposure and the intelligence of school-age children. [J]. Environ Health Perspect (2010), 118(7): 1027-1032.
[7]屈卫东,郑 唯.环境内分泌干扰物与健康 [M]//第29章.陈学敏,杨克敌主编.现代环境卫生学.北京:人民卫生出版社, 2008: 928-960.
[8]Kevin M Kransler, Ammie N Bachman, Richard H McKee. A comprehensive review of intake estimate of di-isononyl phthalate(DINP) based on indirect exposure models and urinary biomonitoring data. [J]. Regulatory Toxicology and Pharmacology, 2012,62:248-256.
[9]李 新.化妆品中邻苯二甲酸酯类和己二酸酯类成分色谱分析方法的研究 [D]. 乌鲁木齐:新疆大学, 2012.
[10]Larsen S T, Lund R M, Nielsen G D, et al. Di-(2-ethylhexyl) phthalate possesses an adjuvant effect in a subcutaneous injection model with BALB/c mice.[J]. Toxicol. Lett., 2001,125(1-3): 11-18.
[11]Larsen S T, Hansen J S, Hansen E K, et al. Airway inflammation and adjuvant effect after repeated airborne exposures to di-(2-ethylhexyl) phthalate and ovalbumin in BALB/c mice. [J]. Toxicology, 2007,235(12):119-129.
[12]柯翔鸿.邻苯二甲酸(2-乙基己基)酯对小鼠的氧化损伤和生殖毒性分子机制的研究 [D]. 武汉:华中师范大学, 2008.
[13]胡金涛. DEHP对中国林蛙肝脏氧化应激的影响 [D]. 西安:陕西师范大学, 2013.
[14]周 佩,蒋子奇,钏茂巧,等. DEHP暴露对小鼠神经行为学及脑脂质过氧化物的影响 [J]. 环境科学学报, 2012,32(9):2339-2345.
[15]Wormuth M, Scheringer M. What are the sources of exposure to eight frequently used phthalic acid esters in Europeans? [J]. Risk Anal., 2006,26:803-824.
[16]Clement L T Jones C A, Cole J. Health disparities in the United States: childhood asthma [J]. AmJ. Med. Sci., 2008,335:260-265.
[17]Miller R L, Ho S M. Environmental epigenetics and asthma: current concepts and cell for studies [J]. AMJ. Resp. Crit., Care, 2008,177:567-573.
[18]邹德坤,王夫美,焦 姣,等.夏季学生宿舍室内降尘中PAEs污染特征和暴露评价 [J]. 中国环境科学, 2013,33(11):2075-2080.
[19]Kransler K M, A N Bachman, R H Mckee. A comprehensive review of intake estimates of di-isononyl phthalate (DINP) based on indirect exposure models and urinary biomonitoring data [J]. Regulatory Toxicology and Pharmacology, 2012,62:248-256.
[20]Imai Y, Kondo A, lizuka H, et al. Effects of phthalate esters on the sensitization phase of contact hypersensitivity induced by fluorescein isithiocyanate [J]. Clin. Exp Allergy: J. Brit. Soc. Allergy Clin Immunol., 2006,36:1462-1468.
[21]Takano H, Yanagisawa R, Inoue K,et al. Di-(2-ethylhexyl) phthalate enhances atopic dermatitis-like skin lesions in mice [J]. Environ. Health Perspect., 2006,114(8):1266-1269.
致谢:感谢环境生物医学实验室的精心指导和大力支持;感谢实验室所有的师兄师姐给予本项目的支持和帮助.感谢本项目团队不懈奋斗、坚持到底的所有成员.最后,向在科研实验中牺牲的小白鼠致敬!
Adjuvant effect of skin DINP exposure on mice with allergic dermatitis.
ZHANG Huan-yun, WU Zhuo, DAI Jia-jia,QIN Yi-cai, LI Jin-quan, YANG Xu*(School of Life Sciences, Central China Normal University, Wuhan 430079, China). China Environmental Science, 2015,35(12):3804~3809
In order to explore the effect of a new plasticizer-di-isononyl phthalate (DINP) on mice allergic skin inflammation, we used skin exposure method. Fifty six male Balb/C mice were divided into seven groups, in which four groups and exposed to 0, 1.4, 14 and 140mg/kg DINP, two other groups administrated antioxidant melatonin were set to explore oxidative stress effects, and one group was set as saline control. After exposure, the indexes of ear swelling and the weight difference of bilateral ear were determined, and we observed the pathology change through the ear pathology slice. The biomarkers about oxidative stress were tested too. The results showed that the 14and 140mg/kg DINP worsen skin inflammation significantly (P<0.01), and the oxidative stress indexes also changed obviously (P<0.01). These results suggest that a certain concentration of DINP can significantly increase related symptom of skin inflammation caused by allergen. It certifies that a certain concentration DINP has obvious adjuvant effect on allergic skin inflammation in mice. In addition, along with the concentration of DINP increase, the oxidative stress in the bodies of mice is overactive and it causes organism tissues or cells oxidative damage and contributes to the inflammatory response.
di-isononyl phthalate (DINP);allergic dermatitis;skin exposure;adjuvant effect;oxidative damage
X18,R994.6
A
1000-6923(2015)12-3804-06
张焕云(1992-),女,山东济宁人,华中师范大学生命科学学院在读本科生.
2015-05-12
华中师范大学教育部资助大学生创新实验项目;国家自然科学基金重点项目(51136002)
* 责任作者, 教授, yangxu@mail.ccnu.edu.cn

