维生素D对牛卵巢卵泡颗粒细胞的影响
靳 光,张元庆,张喜忠,王 曦,王栋材,李 博,薛艳蓉
(山西省农科院畜牧兽医研究所,太原 030000)
繁殖与生理
维生素D对牛卵巢卵泡颗粒细胞的影响
靳 光,张元庆,张喜忠,王 曦,王栋材,李 博,薛艳蓉
(山西省农科院畜牧兽医研究所,太原 030000)
试验旨在探寻具有生物活性的维生素D(1α,25-(OH)2D3)对体外培养的牛卵巢卵泡颗粒细胞的活力、增殖及雌激素分泌的影响。在体外培养的牛卵巢卵泡颗粒细胞中加入不同梯度的1α,25-(OH)2D3(0,1,10,100 nM),用CCK-8检测细胞活力,细胞计数检测增殖,ELISA法检测雌二醇浓度。结果表明:1、10、100 nM的1α,25-(OH)2D3均能提高卵泡颗粒细胞的活性,1α,25-(OH)2D3为100 nM时其刺激作用最强;10、100 nM的1α,25-(OH)2D3能刺激卵泡颗粒细胞增殖与雌二醇分泌,100 nM的1α,25-(OH)2D3刺激增殖作用最强,10 nM的1α,25-(OH)2D3刺激雌二醇分泌的能力最强。
维生素D;牛;卵泡颗粒细胞;细胞活力;增殖;雌二醇
维生素D是一种脂溶性维生素,其主要作用是升高血浆中钙、磷的水平,以促进骨的钙化。维生素D可以通过食物摄取也可以在体内合成。维生素D在体内代谢产物有数十种,但在体内最终的活性形式只有一种,那就是1α,25-二羟维生素D3(1α,25-(OH)2D3)[1-2]。
1α,25-(OH)2D3发挥其生物学作用需要靶细胞上维生素D受体(VDR)的介导。VDR是核受体家族成员之一,调控了人及小鼠约3%的基因表达[1,3]。随着研究的深入,人们发现VDR存在于雄性动物的睾丸、附睾、前列腺、精囊腺等重要器官[4-5]。另外,在人精子内VDR存在于精子细胞核内[6]。VDR在雄性动物生殖系统内的表达,说明1α,25-(OH)2D3能够在其中发挥调节作用。
维生素D对生殖的影响已有诸多研究。对于VDR基因敲除的小鼠其精液品质下降,表现为精子数目与精子活率降低,精子形态异常[7]。对于未成熟大鼠的睾丸支持细胞,1α,25-(OH)2D3能够提高芳香化酶(控制雌激素生成的关键酶)mRNA的表达量[8]。对于精子,1α,25-(OH)2D3能够增加精子细胞内钙离子浓度,提高精子运动能力和顶体酶活性,有利于精子获能并延长精子体外生存时间[9-10]。
虽然维生素D对于雄性动物生殖的影响已有大量研究,但是对于雌性动物的研究较少,并且维生素D对母牛生殖方面的研究还未见报道。因此,本试验以母牛为研究对象,探究维生素D对母牛卵巢卵泡颗粒细胞的细胞活力、增殖以及雌激素分泌水平的影响。
1 材料与方法
1.1样品采集
选取健康的成年山西省晋南牛作为研究对象,在当地屠宰场将动物宰杀后采集卵巢。迅速用生理盐水冲洗卵巢并放入4℃无菌PBS缓冲液内,2 h内带回实验室。
1.2主要试剂
DMEM/F12基础培养基、青链霉素混合液、Cell Counting Kit-8(CCK-8)试剂盒购于武汉博士德生物公司;胎牛血清(FBS)购于杭州四季青公司;牛雌二醇ELISA试剂盒购于上海蓝基生物公司;1α,25-(OH)2D3购于Selleck公司。
1.3牛卵巢卵泡颗粒细胞的收集
无菌条件下将卵泡从卵巢上剪下,然后剪开卵泡,用刮刀刮取卵泡壁内层的卵泡颗粒细胞。用PBS将收集的卵泡颗粒细胞清洗3次,然后用台盼蓝鉴定活细胞。
1.4CCK-8测定细胞活性
将收集的卵泡颗粒细胞以每孔1×104个活细胞接种于96孔培养板内。培养液为DMEM/F12,其中含有10%FBS、100 IU/mL青霉素、0.1 mg/mL链霉素以及不同浓度梯度的1α,25-(OH)2D3(0、1、10、100 nM),每孔内含培养液100 μL。每个1α,25-(OH)2D3浓度梯度设定5个复孔,试验重复6次。卵泡颗粒细胞在37℃,5%CO2浓度条件下培养24 h。24 h以后每孔加入10 μLCCK-8溶液,继续培养3 h。3 h后使用酶标仪测定培养板内各孔在450 nm下的吸光度值。
1.5雌二醇测定及细胞计数
将收集的卵巢卵泡颗粒细胞以每孔5×104个活细胞接种于96孔培养板内。培养液组成及1α,25-(OH)2D3浓度梯度同上,每孔内含培养液200 μL。每个1α,25-(OH)2D3浓度梯度设定3个复孔,试验重复6次。卵巢颗粒细胞在37℃、5%CO2浓度条件下培养6 d,期间每48 h换液一次。6 d以后抽取细胞上清液,用牛雌二醇ELISA试剂盒,按其说明书步骤对各样品雌二醇浓度进行测定。吸取上清后,用胰酶消化剩余细胞,将细胞吹散后终止消化,然后用血细胞计数板对各个孔细胞进行计数。
1.6统计分析
所有数据应用SPSS软件进行分析,数据以平均数±标准误表示。方差分析使用单因素方差分析,多重比较采用Duncan法。
2 结果
2.11α,25-(OH)2D3对牛卵泡颗粒细胞活力的影响
牛卵泡颗粒细胞经体外培养24 h后,不同浓度1α,25-(OH)2D3对牛卵泡颗粒细胞活力的影响如图1所示。与不添加1α,25-(OH)2D3的对照组相比,当1α,25-(OH)2D3添加量为1、10、100 nM时,颗粒细胞的活力都有显著提高(P<0.01)。当添加浓度为100 nM时,颗粒细胞的活力最高。
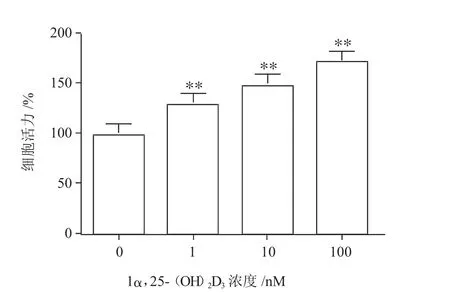
图1 1α,25-(OH)2D3对牛卵巢卵泡颗粒细胞活力的影响
2.21α,25-(OH)2D3对牛卵泡颗粒细胞增殖的影响
牛卵泡颗粒细胞经体外培养6 d后,不同浓度1α,25-(OH)2D3对牛卵泡颗粒细胞增殖的影响如图2所示。与不添加1α,25-(OH)2D3的对照组相比,当1α,25-(OH)2D3添加量为10、100 nM时,颗粒细胞的数目都显著提高(P<0.01),当添加浓度为100 nM时,颗粒细胞的数目最多。
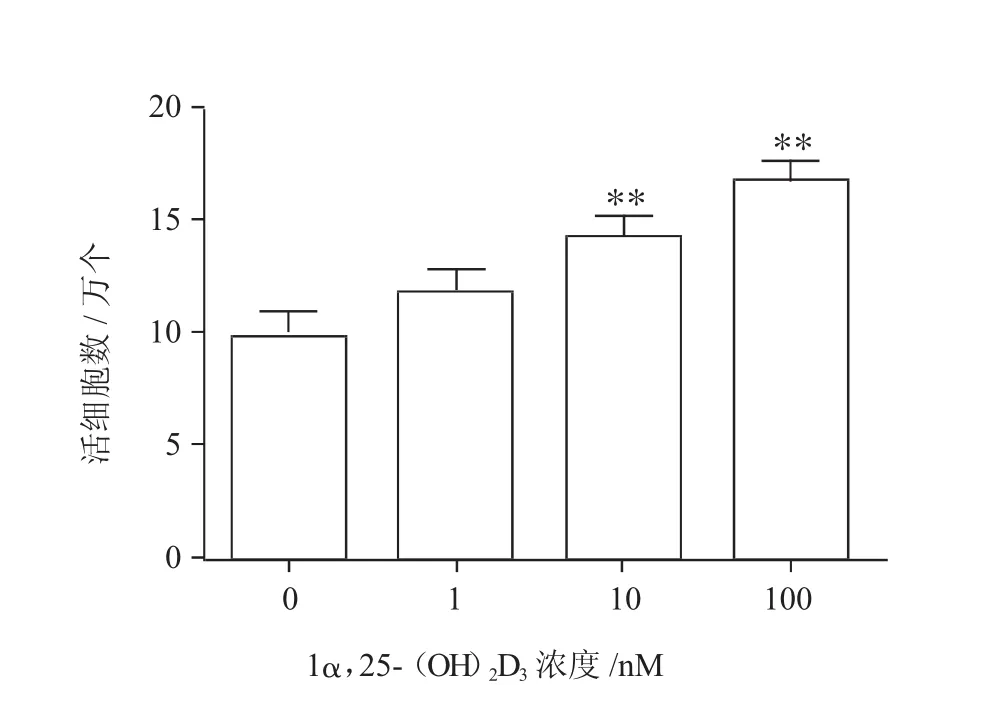
图2 1α,25-(OH)2D3对牛卵巢卵泡颗粒细胞增殖的影响
2.31α,25-(OH)2D3对牛卵泡颗粒细胞雌二醇分泌的影响
牛卵泡颗粒细胞经体外培养6 d后,不同浓度1α,25-(OH)2D3对牛卵泡颗粒细胞雌二醇分泌的影响如图3所示。与不添加1α,25-(OH)2D3的对照组相比,当1α,25-(OH)2D3添加量为10、100 nM时,卵泡颗粒细胞雌二醇分泌显著提高(P<0.01),当添加浓度为10 nM时,颗粒细胞雌二醇分泌量最大。
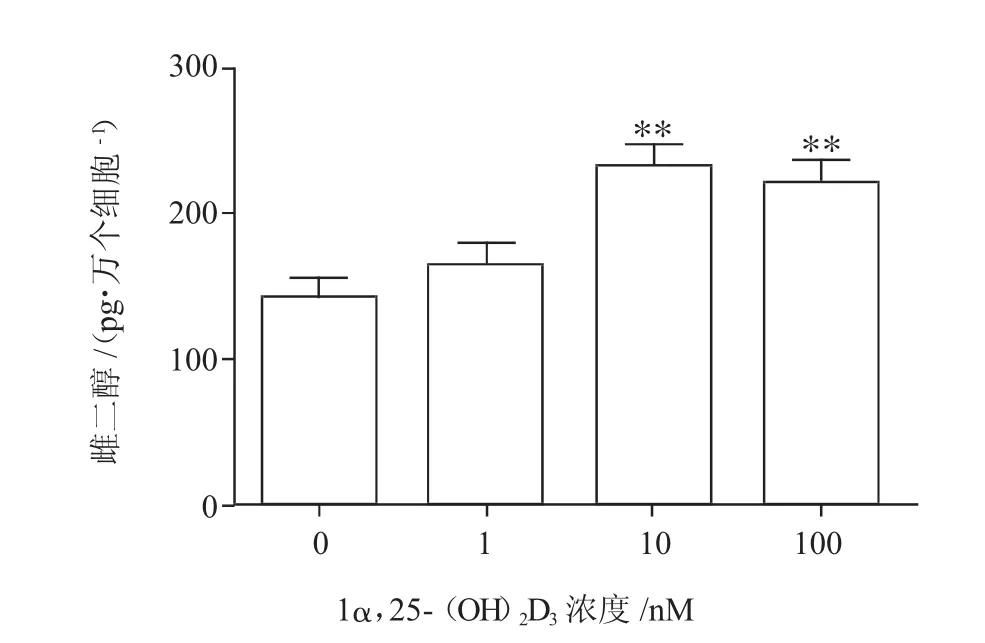
图3 1α,25-(OH)2D3对牛卵巢卵泡颗粒细胞雌二醇分泌的影响
3 讨论
维生素D是一种脂溶性维生素,属于类固醇激素家族的一员。近年来,维生素D对动物生殖的影响多有报道,但是对母牛生殖的影响未见报道。本研究首次以母牛为研究对象,探寻了维生素D对母牛卵巢卵泡颗粒细胞的影响。卵巢卵泡颗粒细胞是雌性动物至关重要的细胞,因为它是雌激素的主要来源,而雌激素决定了雌性动物的性成熟与生殖。
CCK-8近来广泛用于细胞活力检测[11],其能与细胞线粒体内脱氢酶进行反应,生成黄色的甲瓚化合物,颜色越深则说明细胞活力越强。本研究用CCK-8证明1α,25-(OH)2D3对卵泡颗粒细胞活力有促进作用。颗粒细胞的活力越强则其增殖与分泌功能也应越强,随后对于颗粒细胞增殖的试验与雌二醇分泌的试验也证实了这一点。不过对于雌二醇而言,1α,25-(OH)2D3对其的最佳刺激浓度并不是100 nM,而是10 nM。这一点不同于细胞活力试验与细胞增殖试验的结果。可能是1α,25-(OH)2D3对雌二醇分泌的调节机制不同于另外两者,因此造成了这样的差异。
1α,25-(OH)2D3对细胞增殖的影响在非生殖细胞内早有研究[12],本研究也证明了1α,25-(OH)2D3对卵泡颗粒细胞的增殖有促进作用,并且对雌二醇的分泌也有促进作用。牛卵泡发育呈现卵泡波的形式,颗粒细胞增殖与其分泌的雌二醇在卵泡发育中起到至关重要的作用。在同一波的卵泡中,只有优势卵泡才能一直发育并最终排卵,而其它卵泡都不得不闭锁退化掉。而优势卵泡的特点就是颗粒细胞增殖迅速,雌二醇分泌旺盛[13-14]。母牛自出生之日起,其卵巢内卵子数目便不会再增加。但是母牛的卵泡会不停地闭锁退化,导致母牛终生可用的卵子数目不足1%。1α,25-(OH)2D3对母牛卵泡颗粒细胞的增殖及雌二醇的分泌都有促进作用,或许会因此改善母牛的生殖能力,对于这一点还需要继续深入研究。
[1]Bouillon R,Carmeliet G,Verlinden L,et al.Vitamin D and human health lessons fromvitamin Dreceptor null mice[J].Endocr Rev,2008,29:726-776.
[2] Prosser D E,Jones G.Enzymes involved in the activation and inactivation of vitamin D[J].Trends in Biochemical Sciences,2004,29:664-673.
[3]Sunn K L,Cock T A,Crofts L A,et al.Novel N-terminal variant of human VDR[J].Mol Endocrinol,2001,15:1599-1609.
[4] Johnson J A,Grande J P,Roche P C,et al.Immunohistochemical detection and distribution of the 1,25-dihydroxyvitamin D3receptor in rat reproductive tissues[J].HistochemCell Biol,1996,105:7-15.
[5] BlombergJensen M,Nielsen J E,Jørgensen A,et al.Vitamin D receptor and vitamin D metabolizing enzymes are expressed in the human male reproductive tract[J].HumReprod,2010,25:1303-1311.
[6] Aquila S,GuidoC,Perrotta I,et al.Human sperm anatomy:ultrastructural localization of 1,25-dihydroxyvitamin D3receptor and its possible role in the human male gamete[J].J Anat,2008,213:555-564.
[7]Kinuta K,Tanaka H,Moriwake T,et al.Vitamin D is an important factor in estrogen biosynthesis of both female and male gonads[J]. Endocrinology,2000,141:1317-1324.
[8] Zanatta L,Bouraima LelongH,Delalande C,et al.Regulation ofaromatase expression by1,25(OH)2vitamin D3in rat testicular cells[J].Reprod Fertil Dev,2011,23:725-735.
[9] Aquila S,Guido C,Middea E,et al.Human male gamete endocrinology:1alpha,25-dihydroxyvitamin D3(1α,25(OH)2D3)regulate different aspects of human sperm biology and metabolism[J].Reprod Biol Endocrinol,2009,7:140-152.
[10]Osheroff J E,Visconti P E,Valenzuela J P,et al.Regulation of human sperm capacitation by a cholesterol efflux-stimulated signal transduction pathway leading to protein kinase A-mediated up-regulation of protein tyrosine phosphorylation[J].Mol HumReprod,1999,5:1017-1026.
[11]Qi Weiwei,Niu Jianying,Qin Qiaojing,et al.Astragaloside IVattenuates glycated albumin-induced epithelial-to-mesenchymal transition by inhibitingoxidative stress in renal proximal tubular cells[J].Cell Stress and Chaperones,2014,19:105-114.
[12]BollagWB,DucoteJ,HarmonCS,etal.Biphasiceffectof1,25-dihyroxy -vitamin D3on primary mouse epidermal keratinocyte proliferation[J]. J Cell Physiol,1995,163:248-256.
[13]Fortune J E.Ovarian follicular growth and development in mammals[J]. Biol Reprod,1994,50:225-232.
[14]Ginther OJ,Wiltbank MC,Fricke P M,et al.Selection ofthe dominant follicle in cattle[J].Biol Reprod,1996,55:1187-1194.
Effects of Vitamin D on Follicular Granulose Cells of Cattle Ovarian
Jin Guang,ZhangYuanqing,Xue Yanrong,et al
(Animal Husbandryand VeterinaryInstitute,Shanxi AcademyofAgricultural Sciences,Taiyuan,030000,China)
The objectives of present study were to investigate the effects of bioactive vitamin D(1α,25-(OH)2D3)on cell viability,proliferation and estradiol production of follicular granulose cells of cattle ovarian in vitro.The granulose cells were cultured with different concentrations of1α,25-(OH)2D3,then the cell viabilitywas measured byCCK-8,the cell proliferation was measuredby cell counting and the concentrations of estradiol were measured by ELISA.The results showed that 1α,25-(OH)2D3(1,10,100 nM)enhanced cell viability,100 nM1α,25-(OH)2D3worked best.The results also showed that 1α,25-(OH)2D3(10,100 nM)enhanced cell proliferation and estradiol production.When the concentration of1α,25-(OH)2D3was 100 nM,the stimulation on cell proliferation was the strongest.While the concentration of 1α,25-(OH)2D3was 10 nM,the stimulation on estradiol production was the strongest.
vitamin D;cattle;follicular granulose cell;cell viability;proliferation;estradiol
S823.3
A
2095-3887(2015)03-0019-04
10.3969/j.issn.2095-3887.2015.03.006
2015-02-16
山西省研究生创新项目(20133056)
靳光(1981-),男,助理研究员,硕士。
薛艳蓉(1982-),女,助理研究员,硕士。

