左归降糖益肾方含药血浆对高糖培养小鼠足细胞凋亡及Caspase-12表达的影响
陈 聪,吴勇军,喻 嵘*,唐 元,罗文娟,曾 婧,张 翔
(湖南中医药大学,湖南 长沙410208)
足细胞是糖尿病肾病 (Diabetic nephropathy,DN)发生发展的关键靶细胞之一,足细胞的损伤和剥脱,与DN 早期发病相关,明显早于肾小球硬化和肾间质病变[1-2]。 细胞凋亡是足细胞丢失的重要原因之一。内质网应激凋亡信号分子Caspase-12 的活化与细胞凋亡密切相关[3-4]。 高糖环境是引起足细胞凋亡及(或)死亡的原因之一,其具体分子机制尚不清楚[4-5]。 课题组前期研究发现中药复方左归降糖益肾方可以改善糖尿病肾病MKR 鼠肾功能, 保护足细胞结构[6]。 本研究在前期研究基础上,进一步探讨经高糖处理体外足细胞后,足细胞损伤的可能分子机制,并为糖尿病肾病的靶向治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞培养 小鼠足细胞购自北京协和细胞中心(Mouse podocyte;3111C0001CCC000230)。 以含10%胎牛血清,90%的DMEM 完全培养基 (含100 U/mL 青 霉 素、100 μg/mL 链 霉 素、25 mmol/L葡萄糖)在5%CO2,37 ℃培养箱中培养。期间2~3 d更换培养液1 次,相差显微镜观察细胞形态,待细胞体积明显增大,向四周伸出足突分化成熟后用于实验。
1.1.2 动物 Wistar 大鼠40 只,购自湖南斯莱克景达实验动物有限公司, 饲养于湖南中医药大学SPF级实验动物中心,许可证号:SYXK(湘)2013-0005)。
1.1.3 主要试剂 总RNA 提取试剂盒, 购自天根生化科技有限公司;逆转录试剂盒,购自Fermentas公司;PCR 引物,由上海生工公司合成;葡萄糖(分析纯),购自上海国药集团化学试剂有限公司;兔抗小鼠Caspase-12 多克隆抗体,购自北京博奥森生物技术有限公司;Hoechst 33258 荧光染料, 购自合肥博美生物科技有限责任公司;AnnexinV-FITC 细胞凋亡检测试剂盒,购自深圳欣博盛生物技术有限公司。
1.1.4 仪器 WD-9402 A 型PCR 扩增仪, 购自北京六一仪器厂;F1-F2 Fuses Type T2A 型化学发光凝胶成像分析系统, 购自Bio-Rad 公司;BioPhotometer plus 型核酸蛋白分析仪, 购自Eppendorf 公司;Aria2 型流式细胞检测仪, 购自BD 公司;A1 型激光共聚焦显微镜,购自尼康公司。
1.1.5 含药血浆制备 左归降糖益肾方: 由熟地黄、黄芪、山药等9 味药组成(中药汤剂制备:经水煎煮2 次, 混合, 滤过, 浓缩制备成含生药浓度为2 g/mL 的药液,经灭菌后置4 ℃冰箱中备用)。 大鼠按随机原则分为空白组、左归降糖益肾方组、内质网应激抑制剂4-苯基丁酸 (4-Phenylbutyric acid,4-PBA)组,每组10 只,连续7 d 灌胃给药,1 次/d。按人与大鼠体表面积换算法计算给药量,中药给药剂量为30 g/kg,相当于临床人用剂量的3 倍,灌胃容量为15 mL/kg;4-PBA 生理盐水稀释, 浓度为0.20 g/mL,剂量为3 g/kg,灌胃容量为15 mL/kg;空白血浆采集于不给药动物。 末次给药后1 h 腹主动脉 插 管 取 血,7.5% EDTA·Na2抗 凝, 收 集 血 浆0.22 μm 滤膜过滤,56 ℃水浴灭活30 min 后,分装置-20 ℃冰箱备用。
1.2 方法
用完全培养基调细胞密度为1×105/mL 的细胞悬液,然后转种培养瓶中,加入含10%胎牛血清完全培养基总体积5 mL,放入5%CO2,37 ℃培养箱中培养至贴壁。用不含胎牛血清的DMEM 培养液同步化处理12 h 后,分为空白组(A 组)、高糖组(B 组)、左归降糖益肾方含药血浆组(C 组)、4-PBA 含药血浆组(D 组)。 A 组为终浓度25 mmol/L 葡萄糖,含10%空白血浆的DMEM 培养基;B 组为终浓度200 mmol/L 葡萄糖, 含10%空白血浆的DMEM 培养基;C 组、D 组含药血浆组,分别为10%含药血浆,终浓度200 mmol/L 葡萄糖的DMEM 培养基。 根据课题组预实验结果, 选择在48 h 后收集细胞。 用0.25%胰蛋白酶-0.02%EDTA 消化细胞, 加入完全培养基终止消化, 离心管收集细胞悬液,1 000 r/min,5 min 离心, 弃上清; 用PBS 洗涤细胞沉淀2~3 次,1 000 r/min,5 min 离心,弃上清;置冰上,用于Western blot,逆转录-聚合酶链反应等相关检测。
1.2.1 逆转录-聚合酶链反应 用总RNA 提取试剂盒抽提其总RNA,采用核酸蛋白分析仪测定其浓度。 取1 μg 总RNA,随后用逆转录试剂盒以Oligo(dT)为引物进行逆转录反应。 以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因。 应用Primer 5.0 软件,根据GenBank 中小鼠的序列设计引物。
Caspase-12: 上 游5’-TGGCCCATGAATCACATCTA-3’。
下游5’-TGTTGCAGATGATGAGAGCC -3’,产物183 bp。
GAPDH: 上 游5’-ACTTGAAGGGTGGAGCCAAA-3’。
下游5’-CCAGGAAATGAGCTTGACA-3’, 产物608bp。
Caspase-12: 预变性,94 ℃,10 min;94 ℃变性40 s,51.5 ℃退火1 min,72 ℃延伸1 min,共32个循环; 最后72 ℃延伸7 min。 GAPDH: 预变性,95 ℃,5 min;94 ℃变 性30 s,60 ℃退 火30 s,72 ℃延伸30 s, 共28个循环; 最后72 ℃延伸10 min。 PCR 产物进行1.2%琼脂糖凝胶电泳,Bio-Rad 化学发光凝胶成像分析系统分析电泳条带光密度值,以Caspase-12 和GAPDH 电泳条带光密度值比值计算Caspase-12 mRNA 相对表达量。实验重复三次,取均值。
1.2.2 蛋白质印迹法 按试剂盒操作提取总蛋白,蛋白样品100 ℃变性10 min 后, 用50 μg 蛋白样品电泳,浓缩胶电压80 V,分离胶电压120 V。电泳结束后转膜90 min, 将转有蛋白的膜置于5%脱脂奶粉中封闭(用TBST 稀释奶粉),4 ℃过夜,不洗,置于兔抗小鼠Caspase-12 多克隆一抗(1∶500,TBST稀释)中孵育2 h,TBST 洗3 次,每次10 min,加入辣根过氧化物酶山羊抗兔二抗(1∶1000,TBST 稀释),室温孵育1~2 h,TBST 洗3 次,每次10 min。 加入ECL 化学发光试剂,Bio-Rad 化学发光凝胶成像分析系统以目的条带光密度值与同个样品的GAPDH(GAPDH 内参1∶2000,用TBST 稀释)光密度值的比值表示目的基因蛋白表达水平。 实验重复3 次,取均值。
1.2.3 流式细胞术 收集细胞, 调细胞密度为1×106/mL, 按AnnexinV-FITC 细胞凋亡检测试剂盒说明书操作,由专业人员按流式细胞检测仪操作步骤检查。 实验重复3 次,取均值,足细胞总凋亡率=早期凋亡率+中晚期凋亡率。
1.2.4 免疫荧光细胞化学法 在无菌状态下,将防脱盖玻片分别放入6 孔培养板中。 每孔均匀加入含细胞1×105/mL 的完全培养基悬液1 mL, 放入CO2培养箱中培养至贴壁。用不含胎牛血清的DMEM 培养基同步化处理12 h 后, 分为A 组、B 组、C 组、D组。 分别加入相应培养基,48 h 后收集细胞,用PBS洗涤5 min,3 次, 加入4%多聚甲醛固定 (25~30 min),PBS 洗涤5~10 min,3 次。 用1%曲拉通X-100(PBS 配制)打孔,2~5 min,PBS 洗3 次,每次5~10 min。Hoechst 33258 染核(1∶400,PBS 稀释),室温放置15 min,PBS 洗3 次,每次10 min,晾干,抗荧光淬灭封片剂封片,激光共聚焦显微镜下拍片。
1.3 统计学分析
数据满足正态性及方差齐性检验,采用单因素方差分析;若不满足,则采用非参数检验(Kruskal-Wallis 检验),P<0.05 为差异有统计学意义。 使用SPSS 17.0 统计软件处理,结果以“±s”表示。
2 结果
2.1 足细胞观察情况
A 组细胞核呈较均匀的蓝色荧光, 核仁较清晰;B 组凋亡细胞核呈致密浓染, 或呈碎块状致密浓染。C 组与D 组细胞凋亡情况较B 组改善。见第72 页彩图图1。
2.2 各组凋亡率比较
流式细胞仪检测将各组细胞分为4个细胞亚群:正常存活细胞(左下象限,Q3),早期凋亡细胞(右下象限,Q4),中晚期凋亡细胞(右上象限,Q2),坏死细胞(左上象限,Q1)。 与A 组比,B 组足细胞凋亡率明显升高,差异有统计学意义(P<0.05);与B 组比,C 组与D 组足细胞凋亡率明显降低,差异有统计学意义(P<0.05);与C 组比较,D 组凋亡率降低,差异有统计学意义(P<0.05)。 见表1,图2。
表1 足细胞凋亡率的变化 (±s,n=3)

表1 足细胞凋亡率的变化 (±s,n=3)
注:与A 组比较▲P<0.05;与B 组比较★P<0.05;与C 组比较■P<0.05。 下表同。
组别A 组B 组C 组D 组足细胞凋亡率(%)9.80±1.28 39.77±2.51▲18.27±1.07▲★11.00±1.28★■
2.3 各组Caspase-12 表达的比较
Western blot 及RT-PCR 法显示: 与A 组比,B组足细胞Caspase-12 蛋白及mRNA 的表达水平明显升高,差异有统计学意义(P<0.05);与B 组比,C组与D 组Caspase-12 蛋白及mRNA 表达水平均明显降低,差异有统计学意义(P<0.05);但C 组与D组比较,Caspase-12 蛋白及mRNA 表达水平, 差异均无统计学意义(P>0.05)。 见表2,图3。
表2 各组Caspase-12 蛋白、mRNA 表达的比较 (±s,n=3)

表2 各组Caspase-12 蛋白、mRNA 表达的比较 (±s,n=3)
组别A 组B 组C 组D 组Caspase-12 蛋白/GAPDH 0.54±0.06 1.23±0.12▲0.84±0.16▲★0.86±0.11▲★Caspase-12 mRNA/GAPDH 0.35±0.02 0.83±0.04▲0.58±0.10▲★0.55±0.12▲★
3 讨论

图2 AnnexinV-FITC/PI 双染法检测不同组足细胞凋亡
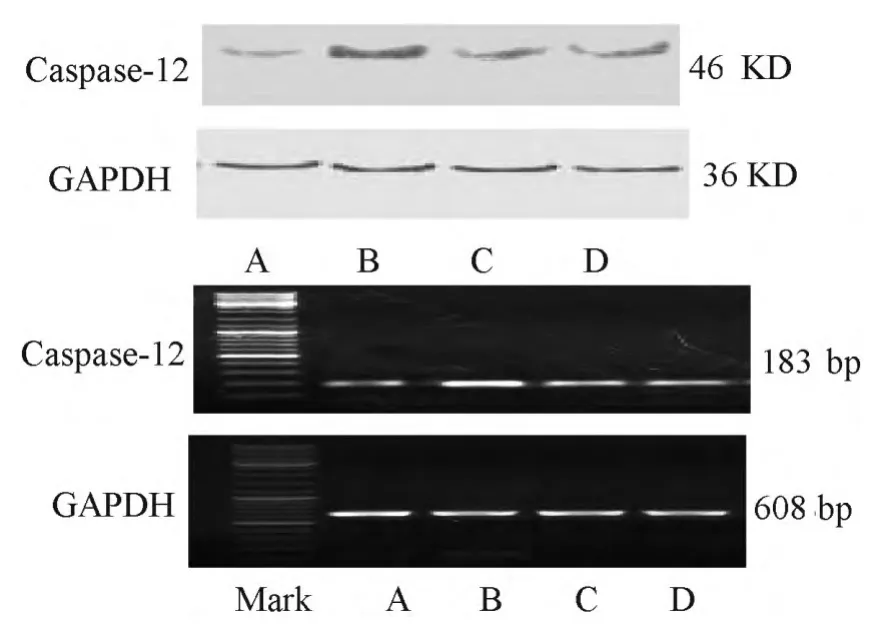
图3 各组Caspase-12 蛋白及mRNA 的表达水平变化
糖尿病肾病(DN)是糖尿病全身微血管病变的肾脏表现,也是糖尿病的主要死亡原因之一,已成为导致终末期肾衰竭的第二病因,仅次于肾小球肾炎[7-8]。 足细胞是糖尿病肾病发生、发展的关键靶细胞之一。 细胞凋亡是导致足细胞丢失的重要因素[9]。内质网应激 (ERS) 是一种新的引起细胞凋亡的途径, 也是造成DN 肾组织足细胞损伤的重要机制之一[10-11]。 Caspase-12 家族是内质网应激过程中最终执行凋亡的水解酶类。 Caspase-12 位于内质网膜,与其他的Caspases 一样以无活性的酶原形式存在。ERS 引起Caspase-12 激活,而死亡受体或线粒体凋亡途径中Caspase-12 不被活化。激活的Caspase-12切割并激活Caspase-9,活化的Caspase-9 激活Caspase-3 等效应Caspases,导致细胞凋亡[3]。Cao Y 等[4]研究发现高剂量D-葡萄糖分别刺激体外小鼠足细胞后,Caspase-12 蛋白或mRNA 的表达水平在48 h达高峰,并与足细胞凋亡率正相关。
本实验用葡萄糖200 mmol/L 体外处理足细胞48 h 后,发现与正常葡萄糖组比:足细胞凋亡率升高,Caspase-12 蛋白及mRNA 的表达水平升高。 证实高糖是造成足细胞凋亡的原因之一,足细胞凋亡的分子机制之一是Caspase-12 蛋白及mRNA 的表达水平升高。 经左归降糖益肾方含药血浆干预后,足细胞凋亡率,Caspase-12 蛋白及mRNA 的表达水平较高糖组明显降低。 同时,与阳性对照4-PBA 含药血浆组比较, 在降低Caspase-12 蛋白及mRNA的表达水平方面,具有相似的作用。
DN 的中医病机课题组认为: 主要病理机制为气阴两虚,夹热毒瘀血。 治疗上,针对糖尿病肾病的“虚、毒、瘀”病机,采用标本兼治的方法,补脾益肾、滋阴益气以治本,解毒活血以治标。 左归降糖益肾方由熟地、黄芪、丹参、玉米须等组成,方中重用熟地滋阴养肾为主药,以填真阴;黄芪等益气健脾;丹参活血化瘀;玉米须等清热利湿,利尿消肿;诸药合用,共奏滋阴益气,活血解毒,利尿消肿之功效。 课题组前期研究表明滋阴益气、 健脾固肾以扶正固本,活血解毒以治标实,可改善或解除炎症因子、氧化应激、脂质代谢障碍、内质网应激等赖以产生和发展的条件,延缓糖尿病肾病的发生发展[6,12-14]。 本实验发现左归降糖益肾方含药血浆可以通过降低高糖诱导的内质网凋亡因子Caspase-12 蛋白及mRNA 的表达水平,降低足细胞凋亡率,从而保护足细胞。 而目前,DN 的发病机制复杂,尚未完全阐明, 中医药在DN 的治疗方面进行了诸多有益的探索,疗效肯定。 因而,左归降糖益肾方含药血浆在其他方面的治疗作用值得进一步研究。
[1]Reddy GR,Kotlyarevska K,Ransom RF,et al. The podocyte and diabetes mellitus:is the podocyte the key to the origins of diabetic nephropathy? [J]. Curr Opin Nephrol Hypertens,2008,17(1):32-36.
[2]Gao P,Meng XF,Su H,et al. Thioredoxin -interacting protein mediates NALP3 inflammasome activation in podocytes during diabetic nephropathy [J]. Biochim Biophys Acta,2014,1843(11):2 448-2 460.
[3]刘光辉.内质网应激在糖尿病肾损害中的作用机制研究[D].济南:山东大学博士学位论文,2014:96.
[4]Cao Y,Hao Y,Li H. Role of endoplasmic reticulum stress in apoptosis of differentiated mouse podocytes induced by high glucose [J]. Int J Mol Med,2014,33(4):809-816.
[5]Kim D, Lim S, Park M, et al. Ubiquitination-dependent CAR M1 degradation facilitates Notch1-mediated podocyte apoptosis in diabetic nephropathy[J]. Cell Signal,2014,26(9):1 774-1 782.
[6]印红爱,吴勇军,喻 嵘.左归降糖益肾方对2 型糖尿病肾病小鼠足细胞nephrin 与podocin 表达的影响[J]. 中国中医药信息杂志,2014,21(3):53-57.
[7]陈 靖.糖尿病肾病早期诊断及肾活检指征[J].肾脏病与透析肾移植杂志,2011,20(4):349.
[8]Eleftheriadis T,Antoniadi G,Pissas G,et al. The renal endothelium in diabetic nephropathy [J]. Ren Fail,2013,35(4):592-599.
[9]王玉洁,曹 灵,孙兴旺.足细胞与蛋白尿发病机制的研究进展[J].山东医药,2012,52(19):90-92.
[10]曹延萍. 内质网应激在糖尿病肾损害过程中的作用及其机制研究[D].石家庄:河北医科大学博士论文,2011:18-99.
[11]关丽英,许彩民,潘华珍.内质网应激介导的细胞凋亡[J].生物化学与生物物理进展,2007,34(11):1 136-1 141.
[12]吴刚强,喻 嵘.滋阴益气活血解毒法与2 型糖尿病及其血管并发症[J].中医药导报,2007,13(5):111-112.
[13]成细华,喻 嵘,明 霞,等.左归降糖益肾方对高脂饮食2 型糖尿病MKR 小鼠糖脂代谢及炎症反应的影响[J].中国实验方剂学杂志,2010,16(12):98-100.
[14]吴勇军,喻 嵘,成细华,等.MKR 转基因2 型糖尿病小鼠脂肪组织p38 丝裂原活化蛋白激酶、c-jun 氨基末端激酶蛋白的表达及左归复方的保护作用[J]. 中国动脉硬化杂志,2011,19(7):547-551.
——疾病防治的新靶标

