Fusariumboothii特异性PCR检测方法的建立与应用
潘 逸, 张 昊, 罗 文, 徐 进, 许景升, 冯 洁
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
Fusariumboothii特异性PCR检测方法的建立与应用
潘 逸, 张 昊, 罗 文, 徐 进, 许景升, 冯 洁*
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
根据报道的Fusariumspp.的reductase-like基因序列,设计合成了1对用于Fusariumboothii的特异性检测引物F-Fg/R-Fg。利用该对引物对包括F.boothii在内的35株镰刀菌的基因组DNA进行了扩增。结果表明:该引物特异性强,仅从F.boothii基因组DNA中扩增出300 bp左右的特异性条带,其他参照菌株及阴性对照均无任何条带;灵敏度验证结果表明,该检测法可以检测出50 pgF.boothii基因组DNA。
镰刀菌; 特异性检测; 聚合酶链式反应;Fusariumboothii
由镰刀菌(Fusarium) 引起的赤霉病是麦类作物的重要病害,广泛分布于世界湿润和半湿润地区[1]。最近十几年来,小麦赤霉病在亚洲、欧洲、加拿大和美国北部等地频繁暴发[2],危害严重。在我国,长江流域是小麦赤霉病的传统流行区,而近年来小麦赤霉病在北方麦区发生也越来越频繁,对小麦生产造成严重威胁[3],不仅引起小麦产量损失, 而且感病谷粒被真菌毒素污染,使人畜的健康安全受到严重威胁。
禾谷镰刀菌(Fusariumgraminearumsensu lato)是引起小麦赤霉病的主要病原菌,根据EF1α、reductase-like基因等13个功能基因系统发育分析结果,目前认为该菌是一个至少包含有15个种的复合种(Fusariumgraminearumspecies complex, FGSC),这些种很难通过形态学进行区分[4]。F.boothii是FGSC中的一个种,在亚洲、非洲和美洲都有一定分布,在玉米和小麦中均有报道[5-7]。任旭通过对多个基因的单核苷酸多态性(SNP)位点分型对玉米穗腐病菌进行鉴定,发现我国玉米穗腐病菌中存在少量的F.boothii[8]。目前,鉴定F.boothii主要采用多位点基因分型法[2]、EF1α基因序列分析[9]2种方法,但均成本较高且耗时较长。因此,亟需开发快速、稳定的检测方法。
真菌的某些基因序列,如 ITS序列、β-tublin(TUB)基因、cox2基因等,在种内不同菌株间具有高度的保守性,但在属间和属内不同种间存在着丰富的多态性,利用这一特性进行PCR扩增、测序及序列分析后再设计特异性引物来进行植物病原真菌的分子检测是目前被广泛接受的一种技术,该技术凭借其快速、准确、重演性好的优点已经成为植物病原检测的核心技术,得到越来越广泛的应用[10]。
本研究旨在建立F.boothii的种特异性PCR检测技术,从而能够快速、低成本地检测小麦赤霉病菌群体,监测F.boothii的种群分布及动态变化。
1 材料与方法
1.1 材料
35株供试菌株分属于28种镰刀菌,相关信息见表1。
1.2 镰刀菌基因组DNA的提取
取少许菌丝接种于PDA平板中央,每个菌株接种2个平板,28 ℃恒温培养5 d,待菌丝长满平板。刮取2个平板的菌丝装入2 mL离心管,放入烘箱里50 ℃过夜干燥。离心管中加入少量石英砂和一个玻璃珠,盖上盖子放入Mini-Beadbeater-96研磨仪模块,用液氮冷冻后装入研磨仪研磨100 s。采用OMEGA公司E.Z.N.A. Fungal DNA Kit (D3390) 提取菌株DNA,DNA于-20 ℃保存。
1.3 特异性引物的设计
对GenBank中已报道的F.boothii和其他多种镰刀菌的reductase-like基因部分序列(GenBank登录号见表1)进行序列比对分析,寻找F.boothii种特异性SNP位点。利用PrimerPremier 5设计特异性PCR引物。引物由上海生工生物工程有限公司合成。
1.4 反应体系与程序
PCR反应体系(20 μL):DNA模板1 μL,10 μmol/L引物各1 μL,20%PVP (W/V) 1 μL,2% BSA (W/V) 1 μL,2×PCR mix 10 μL,无菌水5 μL。
PCR反应程序:95 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,35个循环;最后72 ℃延伸10 min。
1.5 引物特异性验证
以表1所示菌株基因组DNA为模板,用特异性引物F-Fg/R-Fg进行PCR扩增,反应体系及程序见1.4,设置水为模板的阴性对照,扩增产物用1.5%琼脂糖凝胶电泳检测,观察结果。
1.6 引物灵敏度验证
用核酸浓度测定仪(GE公司,NanoVue Plus) 测定F.boothii基因组DNA浓度,并将其稀释为5 ng/μL、500 pg/μL、50 pg/μL、5 pg/μL、500 fg/μL、50 fg/μL、5 fg/μL,然后利用特异性引物F-Fg/R-Fg,按1.4的反应体系和程序分别对稀释的F.boothii基因组DNA进行PCR扩增,1.0%琼脂糖凝胶电泳检测,观察结果。
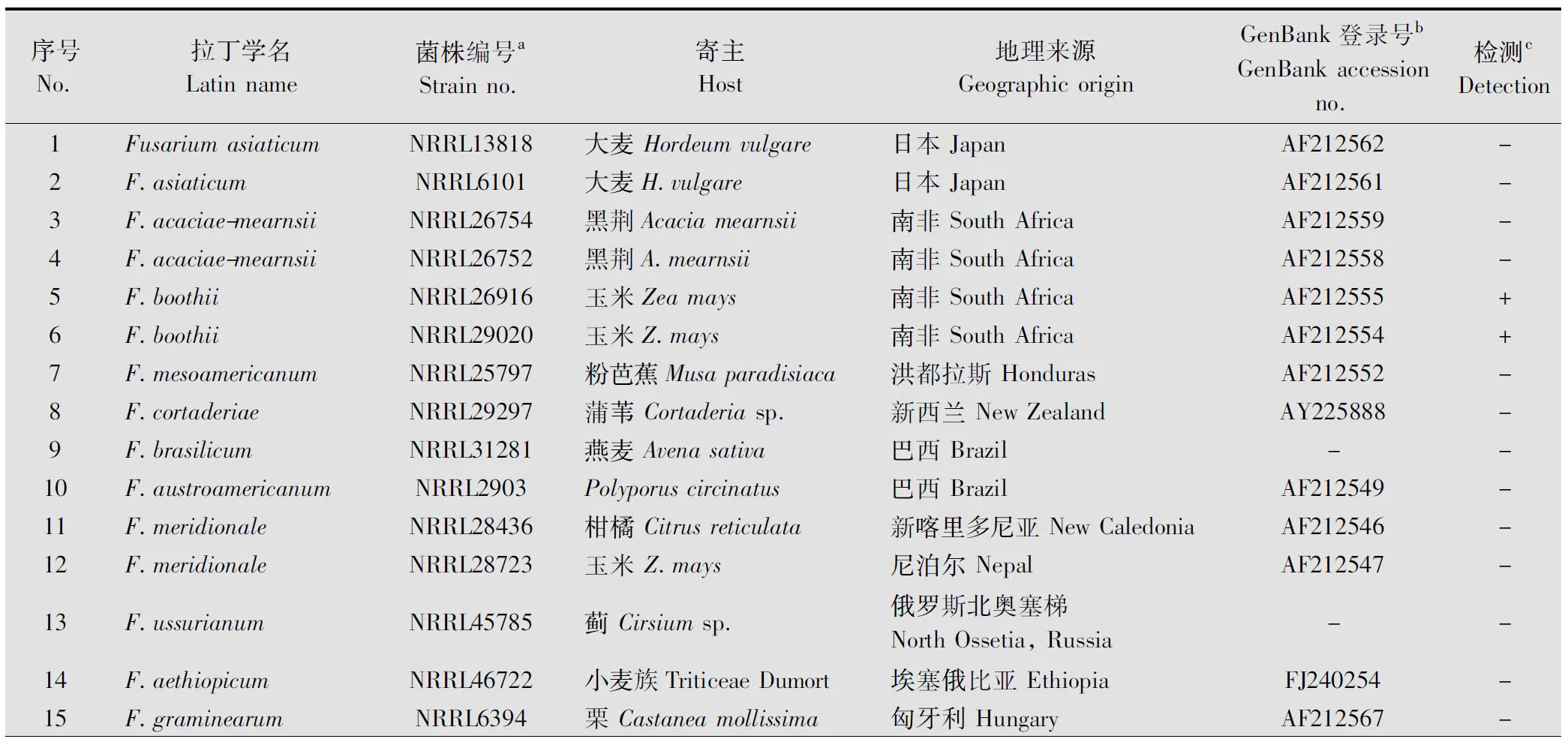
表1 引物F-Fg/R-Fg特异性验证所用菌株及其PCR检测结果1)
续表1 Table 1(Continued)

序号No.拉丁学名Latinname菌株编号aStrainno.寄主Host地理来源GeographicoriginGenBank登录号bGenBankaccessionno.检测cDetection16F.graminearumNRRL5883玉米Z.mays美国俄亥俄州Ohio,USAAF212566-17F.gerlachiiNRRL38380芦竹Arundodonax美国中西部TheupperMidwestoftheU.S.DQ459794-18F.meridionale×F.asiaticumNRRL28721玉米Z.mays尼泊尔NepalAF212565-19F.lunulosporumNRRL13393葡萄柚Citrusparadisi南非SouthAfrica--20F.cerealisNRRL13721洋芋Solanumtuberosum波兰PolandAF212575-21F.vorosiiNRRL38208小麦族TriticeaeDumort日本北海道Hokkaido,JapanDQ459797-22F.culmorumNRRL3288--AF212573-23F.pseudograminearumNRRL28062大麦H.vulgare澳大利亚AustraliaAF212578-24F.pseudograminearumNRRL28338土壤Soil澳大利亚AustraliaAF212581-25Fusariumsp.NRRL29380稗Echinochloa美国俄勒冈州Oregon,USAAY452927-26F.sporotrichioidesCBS448.67///-27F.acuminatumCBS334.75///-28F.verticillioidesCBS218.76///-29F.poaeCBS446.67///-30F.camptocerasCBS544.96///-31F.chlamydosporumCBS635.76///-32F.langsethiaeCBS121451///-33F.solaniCBS224.34///-34F.louisianenseCBS127524///-35F.nepalenseCBS127503///-
1) a: NRRL为美国菌种保藏中心标准菌株,CBS为荷兰皇家艺术与科学院真菌多样性研究中心标准菌株;b: reductase-like基因部分序列在GenBank登录号;c: “+”表示检测结果阳性,“-”表示检测结果阴性。a: NRRL, Agricultural Research Service Culture Collection, CBS, Fungal Biodiversity Centre, the Institute of Royal Netherlands Academy of Arts and Sciences; b: Only a part of reductase-like gene sequences are registered in GenBank;c: “+”means positive,“-”means negative.
2 结果与分析
2.1 特异性引物设计
根据Fusariumspp.的reductase-like基因序列的比对分析结果,设计了检测F.boothii的特异性引物F-Fg/R-Fg(F-Fg:5′-ATGGGTAAGGAGACAAGAC-3′;R-Fg:5′-GGAGTACCAGTATCATGTT-3′),目的片段大小约为300 bp。
2.2 引物特异性验证
以表1所示菌株DNA为模板,用特异性引物F-Fg/R-Fg进行PCR扩增,电泳检测结果显示:该引物仅从F.boothii的基因组DNA中扩增出1条300 bp左右的特异性条带,与预期结果一致,而其他33种参照菌株和阴性对照均无任何条带(图1)。特异性检测结果表明,所设计的引物具有种间相对特异性,能够区别F.boothii与Fusarium属其他病原真菌。

图1 引物F-Fg/R-Fg特异性扩增Fusarium boothiiFig.1 Specificity validation of F-Fg/R-Fg
2.3 引物灵敏度验证
用特异性引物F-Fg/R-Fg分别对不同浓度的F.boothii基因组DNA进行扩增,设置无菌水为模板的阴性对照,结果显示:随着模板浓度的降低,琼脂糖凝胶电泳条带亮度逐渐变暗,模板量为50 pg时还能分辨出1条约300 bp的特异性条带(图2),而模板量小于50 pg以及无菌水对照均无明显的扩增产物,说明该引物的灵敏度为50 pg。

图2 引物F-Fg/R-Fg灵敏度验证Fig.2 Sensitivity validation of F-Fg/R-Fg
3 讨论
镰刀菌属真菌含有多个种,利用形态学方法鉴定比较复杂,而且禾谷镰刀菌复合种内的各个种很难通过形态学进行区分。目前,F.boothii鉴定方法成本较高,不适于大样本筛查。PCR检测技术在真菌中的应用已很广泛,具有低成本、稳定性高的优点,因此开发F.boothii的常规PCR检测方法是十分必要的。
本研究通过对报道的镰刀菌的reductase-like基因序列进行同源性比对分析,设计合成了1对用于F.boothii检测的特异性引物F-Fg/R-Fg。利用该引物对包括F.boothii在内的35株镰刀菌菌株的基因组DNA进行了PCR扩增,结果表明:该引物特异性强,仅从F.boothii基因组DNA中扩增出1条300 bp左右的特异性条带,其他参照菌株及阴性对照均无任何条带。该检测法适用范围广,稳定性和准确性高。
[1] Nganje W E, Bangsund D A, Leistritz F L, et al. Estimating the economic impact of a crop disease: The case ofFusariumhead blight in U.S. wheat and barley [C]∥National Fusarium Head Blight Forum Proceedings, 2002:275-281.
[2] Ward T J, Clear R M, Rooney A P, et al. An adaptive evolutionary shift inFusariumhead blight pathogen populations is driving the rapid spread of more toxigenicFusariumgraminearumin North America [J].Fungal Genetics and Biology, 2008, 45(4): 473-484.
[3] Zhang Hao, Van der Lee T, Waalwijk C, et al. Population analysis of theFusariumgraminearumspecies complex from wheat in China show a shift to more aggressive isolates[J].PLoS ONE, 2012, 7(2): e31722.
[4] Sarver B A J, Ward T J, Gale L R, et al. NovelFusariumhead blight pathogens from Nepal and Louisiana revealed by multilocus genealogical concordance [J].Fungal Genetics and Biology, 2011, 48(12): 1096-1107.
[5] Boutigny A L, Ward T J, Van Coller G J, et al. Analysis of theFusariumgraminearumspecies complex from wheat, barley and maize in South Africa provides evidence of species-specific differences in host preference [J].Fungal Genetics and Biology, 2011, 48(9): 914-920.
[6] Desjardins A E, Proctor R H. Genetic diversity and trichothecene chemotypes of theFusariumgraminearumclade isolated from maize in Nepal and identification of a putative new lineage [J].Fungal Biology, 2011, 115(1): 38-48.
[7] Sampietro D A, Diaz C G, Gonzalez V, et al. Species diversity and toxigenic potential ofFusariumgraminearumcomplex isolates from maize fields in northwest Argentina [J].International Journal of Food Microbiology, 2011, 145(1): 359-364.
[8] 任旭.我国玉米穗腐病主要致病镰孢菌多样性研究[D].北京:中国农业科学院, 2011.
[9] Geiser D M, Jimenez-Gasco M D, Kang S C,et al. FUSARIUM-ID v. 1.0: A DNA sequence database for identifyingFusarium[J].European Journal of Plant Pathology,2004,110:473-479.
[10]王娜,马雅军,王喆之,等.PCR相关技术方法在植物病害检测中的应用(综述)[J].上海农业学报,2004,20(4):112-115.
(责任编辑:杨明丽)
Establishment and application of PCR for detection ofFusariumboothii
Pan Yi, Zhang Hao, Luo Wen, Xu Jin, Xu Jingsheng, Feng Jie
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
A pair of species-specific primers F-Fg/R-Fg was designed for detection ofFusariumboothiibased on reductase-like gene sequences ofFusariumspp. A total of 35 strains ofFusariumwere tested by using the primers, the results showed that the F-Fg/R-Fg were of high specificity, since only a single product of about 300 bp was amplified fromFusariumboothiigenomic DNA. The sensitivity of the detection was 50 pg genomic DNA per 20 μL PCR reaction volume.
Fusarium; detection; PCR;Fusariumboothii

实验方法与技术ExperimentalMethod&Technology
2014-05-12
2014-06-20
公益性行业(农业)科研专项(201303016);国家国际合作专项(2013DFG31930);国家自然科学基金(31201477)
S 435.121.45
A
10.3969/j.issn.0529-1542.2015.04.022
* 通信作者 E-mail: jfeng@ippcaas.cn

