黄帚橐吾乙醇提取物对棉铃虫的生物活性
刘锦霞, 李 晶*, 李 娜, 杜文静, 丁 品, 柳军玺, 张建军, 武建荣
(1.甘肃省科学院生物研究所, 兰州 730000;2.中国科学院兰州化学物理研究所,甘肃省天然药物重点实验室, 兰州 730000)
黄帚橐吾乙醇提取物对棉铃虫的生物活性
刘锦霞1, 李 晶1*, 李 娜1, 杜文静1, 丁 品1, 柳军玺2, 张建军1, 武建荣1
(1.甘肃省科学院生物研究所, 兰州 730000;2.中国科学院兰州化学物理研究所,甘肃省天然药物重点实验室, 兰州 730000)
棉铃虫食性杂,寄主广,为害严重又对现有农药易产生抗药性,为有效防控其对作物的为害, 本文通过室内毒力测定研究了甘南草原有毒植物黄帚橐吾(Ligulariavirgaurea)乙醇提取物对棉铃虫幼虫的农药生物活性,结果表明:黄帚橐吾乙醇提取物对棉铃虫2~3龄幼虫有很强的拒食活性,拒食中浓度(AFC50)为2.59 mg/mL。当提取物浓度为10.00 mg/mL时,拒食率可达95%以上;触杀和胃毒活性也较强,致死中浓度(LC50)在3.00 mg/mL左右,浓度为10.00 mg/mL时,校正死亡率均可达80%以上,而且3种作用的活性强度随浓度增大而增强。 杀卵和熏蒸活性相对较弱,但浓度大于10.00 mg/mL时也有比较明显的杀灭活性。本研究结果证明黄帚橐吾乙醇提取物可以有效防控棉铃虫幼虫的危害,为黄帚橐吾类农药的开发和棉铃虫的有效防治提供了依据和有效途径。
黄帚橐吾; 棉铃虫; 农药; 生物活性
黄帚橐吾[Ligulariavirgaurea(Maxim.) Mattf.]系菊科橐吾属多年生草本有毒植物,主要分布于我国西藏东北部、云南西北部、四川、青海、甘肃、不丹和尼泊尔等地,生长于海拔2 600~4 700 m的高寒草场、沼泽草甸、阴坡湿地及灌丛中,其大毒,性味甘、苦,入药有清宿热、解毒愈疮,催吐等功效[1]。近年来, 青藏高原东部的高寒草场不断退化, 群落结构发生改变,毒杂草增多,黄帚橐吾就是其中之一[2],其综合利用也成为近几年医药和植保等领域研究的热点,据报道,黄帚橐吾茎叶甲醇提取物对菜粉蝶幼虫有较强的拒食和触杀作用,对水稻纹枯病菌和玉米大斑病菌也有较强的抑制作用[3-4],但黄帚橐吾对棉铃虫的农药生物活性国内外尚未见相关报道。棉铃虫(HelicoverpaarmigeraHübner)属鳞翅目,夜蛾科,广泛分布在中国及世界各地。该虫食性杂,寄主植物有20多科200余种。该虫是棉花蕾铃期重要的钻蛀性害虫,主要蛀食蕾、花、铃,其次食害嫩叶。除棉花外,还为害小麦、玉米、高粱、番茄、豆类、瓜类等,由于种植结构调整,气候变化及其对现用农药的抗药性等原因, 目前棉铃虫为害逐年加重, 对农业生产造成极大危害[5-7]。化学农药作为防治棉铃虫的主要手段,起到了非常重要的作用, 但是大量使用化学农药对生态环境和人类健康构成不可逆转的威胁。因此,开发环保、安全、高效的新农药势在必行。植物源杀虫剂以其作用方式多样、害虫不易产生抗药性、低毒、无残留、环保等优点,在植物病虫害防控体系中越来越受到植保工作者的重视。本文以棉铃虫3 龄前幼虫为靶标, 对黄帚橐吾乙醇提取物的农药生物活性进行初步研究, 旨在为有效防控棉铃虫和开发新的无公害生物农药提供基础和参考。
1 材料和方法
1.1 材料
黄帚橐吾(L.virgaurea)提取物为中国科学院兰州化学物理研究所提供的黄帚橐吾全草乙醇浸提物,有特异气味的深褐色浸膏。棉铃虫(H.armigera)2~3 龄幼虫(体重8~11 mg)为该实验室用无菌小豆苗人工饲养的试虫,饲养条件: 温度(25±1)℃,相对湿度(80±5)%,光照时间 12 h/d,光强: 2 000~3 000 lx。
1.2 试验方法
1.2.1 胃毒活性测定
采用叶片载毒法[8],首先将黄帚橐吾提取物用丙酮稀释成1.00、2.50、5.00、10.00、20.00 mg/mL 5个浓度的药液样品。再选取直径0.60 cm的无毒豆苗叶片,用1.00 μL的微量点样器从低浓度开始,在每一片叶上点涂0.50 μL的药液,每个浓度点涂90 片叶,用点涂丙酮作为对照,置于通风处挥发掉溶剂后放入5 cm 培养皿中(皿底铺保湿滤纸,防止叶片干缩),接入3 龄饥饿24 h的幼虫,每头试虫给予一片载毒叶片,24 h后将没有取食完一片叶的试虫淘汰,剩下的处理虫饲喂新鲜叶片。每处理30 头试虫,3 次重复。每天定时观察、记录,连续7 d。计算死亡率、校正死亡率和LC50。
校正死亡率(%)=(处理组死亡率-对照组死亡率)/(100-对照组死亡率)×100。
1.2.2 触杀活性测定
采用点滴法[9],将2~3 龄棉铃虫幼虫置于12.00 cm培养皿中,用微量点样器点滴试虫的前胸背板,每头0.50 μL,每皿10头试虫,20 min后盖上培养皿盖。设置黄帚橐吾提取物1.00、2.50、5.00、10.00、20.00 mg/mL 5个浓度处理,每处理20头试虫,3次重复,丙酮作为对照。处理后的试虫用新鲜豆苗饲喂,连续观察7 d,记录死亡虫数、中毒症状、活动状态、取食情况。计算死亡率、校正死亡率和LC50。
1.2.3 拒食活性测定
采用叶碟法测其选择性拒食活性[9],用丙酮作溶剂,将黄帚橐吾提取物稀释成1.00、2.50、5.00、10.00、20.00 mg/mL 5 个浓度的药液备用。挑选直径为1.00 cm新鲜豆苗叶片,放入待测药液中浸渍5 s取出, 对照叶片以丙酮作相同处理。置于通风处待丙酮自然挥发后,取处理和对照叶碟各一片平行放置于直径5.00 cm的培养皿中,皿底内垫保湿滤纸,每皿接入1 头饥饿24 h 的3 龄棉铃虫幼虫,每处理20 头试虫,重复3 次。24 h 后取出残存叶片,用坐标方格纸法测定取食面积,并据此计算试虫拒食率和拒食中浓度(AFC50):
拒食率(%)=(Sck-S)/Sck×100
式中:Sck、S分别表示对照和处理的取食面积。
1.2.4 熏蒸活性测定
采用三角瓶滤纸密闭熏蒸法[10],在250 mL 磨口三角瓶底部垫保湿滤纸,每瓶接入10 头2~3 龄棉铃虫幼虫,并放适量新鲜豆苗叶片,黄帚橐吾提取物用丙酮稀释成1.00、2.50、5.00、10.00、20.00 mg/mL 5个浓度的药液样品,每个浓度药液取200 μL点滴于滤纸条(7 cm2)上,悬挂于通风处3 min后,用少量凡士林粘于磨口三角瓶内口,迅速盖好瓶塞,以丙酮处理为对照。每处理重复 5 次,将各处理置于光照培养箱中于温度(25±1)℃,光照时间12 h/d的条件下饲养,每12 h检查一次死亡虫数,计算死亡率、校正死亡率和LC50。
1.2.5 杀卵活性测定
采用浸卵法[11],将黄帚橐吾提取物用丙酮稀释成1.00、2.50、5.00、10.00、20.00 mg/mL 5个浓度的药液备用,将计数后的棉铃虫卵块(70 粒/块)放入不同浓度药液中浸 15 s,取出置于吸水纸上,待溶液挥发完后,放入垫有保湿滤纸的直径 15 cm 的培养皿中,每处理3次重复,置于光照培养箱中于温度(25±1)℃,光照时间12 h/d的条件下培养,每天观察卵孵化数及幼虫死亡数,根据是否孵化出幼虫判断死卵与活卵,完全孵化的卵是活卵,未孵化的残存卵或幼虫不能钻出卵壳都判断为死卵,计算其7 d 卵孵化率、幼虫死亡率和抑制卵孵化的LC50。
孵化率(%)=第n天累计孵化虫卵数/供试虫卵数×100。
1.2.6 数据分析处理
采用SPSS 22.0软件进行试验数据处理和分析;校正累计死亡率经反正弦转换后再进行方差分析(ANOVA),多重比较选用Duncan法。
2 结果与分析
2.1 黄帚橐吾提取物对棉铃虫幼虫的胃毒活性
由表1可知,黄帚橐吾乙醇提取物对棉铃虫3龄前幼虫有胃毒活性,这种活性作用与提取物浓度呈正相关,LC50为2.02(1.34~2.72)mg/mL(表6), 当其浓度达10.00 mg/mL 以上时棉铃虫幼虫7 d的校正累计死亡率超过了80%,与低浓度之间在0.05水平上存在显著性差异,而且黄帚橐吾提取物通过胃毒作用对棉铃虫幼虫的致死高峰期在用药后的第5~7天,取食完带毒叶片后70%的试虫取食减少,第5天开始浓度在10.00 mg/mL以上的处理试虫停止取食,行动迟缓,死亡率显著增加。

表1 黄帚橐吾乙醇提取物对棉铃虫2~3龄幼虫胃毒活性1)
1) 表中校正累计死亡率数据为平均值±标准差;表中同列数据后字母相同者,表示在0.05水平上差异不显著。下表同。
The corrected cumulative mortality in the table are mean±SD.The data within the same column followed by the same letters are not significantly different at 0.05 level. The same as in the following tables.
2.2 黄帚橐吾提取物对棉铃虫幼虫的触杀活性
由表2可知, 黄帚橐吾乙醇提取物对棉铃虫3龄前幼虫有较强的触杀活性,其活性与浓度呈正相关, 其浓度在1.00~5.00 mg/mL时,7 d的校正累计死亡率不存在显著性差异,LC50为3.34(2.70~5.15)mg/mL(表6),但药物浓度成倍增加时,死亡率也剧增,当浓度为20.00 mg/mL时校正累计死亡率增至93.22%,与低浓度间存在显著差异。处理24 h后所有试虫活动正常,但取食微减,死亡高峰期在用药后第6~7天。
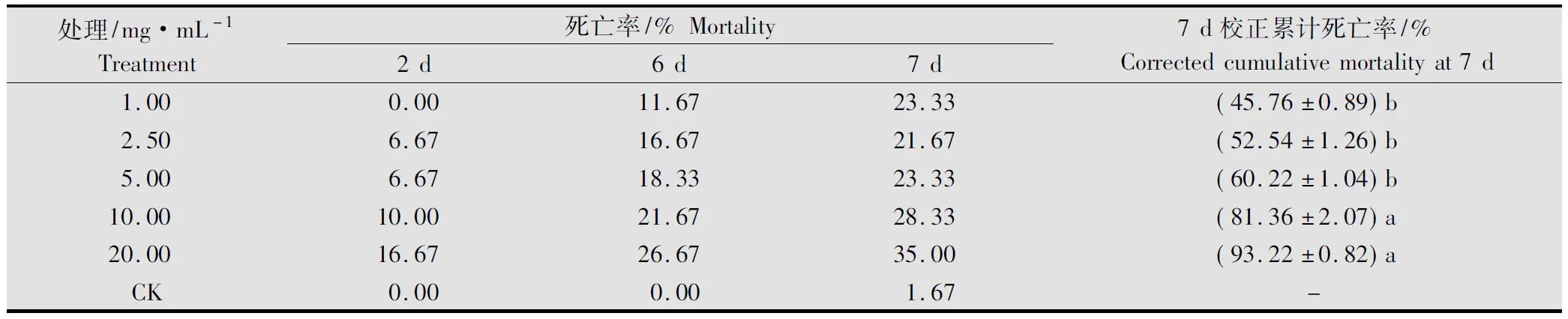
表2 黄帚橐吾乙醇提取物对棉铃虫2~3龄幼虫触杀活性
2.3 黄帚橐吾提取物对棉铃虫幼虫的拒食活性
试验结果显示(见表3),黄帚橐吾乙醇提取物对棉铃虫3龄前幼虫有显著的拒食活性,且与药物浓度呈正相关,AFC50为2.59(2.00~2.81)mg/mL(见表6),浓度越大拒食活性越明显,与低浓度(小于5.00 mg/mL)间存在显著差异,当药物浓度为10.00 mg/mL时,拒食率高达95.81%,浓度为20.00 mg/mL,试虫完全拒食,而且处理后正常饲喂时取食量与低浓度处理及对照相比显著降低,一半试虫甚至不再取食,这说明黄帚橐吾提取物对棉铃虫幼虫的生物毒性作用方式复杂,但以影响其进食能力为主。

表3 黄帚橐吾乙醇提取物对棉铃虫2~3龄幼虫的拒食活性
2.4 黄帚橐吾提取物对棉铃虫幼虫的熏蒸活性
黄帚橐吾体内富含具特殊气味的单萜类、芳香族类挥发性化合物,而有毒植物体的挥发物是一类重要的害虫熏蒸作用物质[12-13]。试验结果显示(表4,表6),黄帚橐吾乙醇提取物对棉铃虫3龄前幼虫具有熏蒸活性,且与浓度呈正相关,LC50为5.86(4.94~7.65)mg/mL,但是低浓度(小于5.00 mg/mL)时熏蒸活性比较弱,只有达到比较高的浓度(20.00 mg/mL), 这种熏蒸活性才比较强,与低浓度间存在显著差异。试验过程中还发现,处理12 h 后,试虫取食明显减少,24 h后90%试虫停止取食,这说明黄帚橐吾提取物中的某个或某些挥发性物质影响了棉铃虫幼虫的取食能力。
2.5 黄帚橐吾提取物对棉铃虫卵的杀卵活性
黄帚橐吾乙醇提取物对棉铃虫卵有一定的杀灭活性,药物浓度越大杀卵活性越强(表5),LC50为6.67 mg/mL(表6),当其浓度在10.00 mg/mL以上时,虫卵的孵化率小于35%,幼虫的存活率也在52%以下,与对照在0.05水平上存在显著性差异。从表6还可知,黄帚橐吾提取物对棉铃虫幼虫的所有活性作用中,杀卵作用的LC50最大(6.67 mg/mL),这说明其对棉铃虫卵的生物活性没有其他作用强,从卵控制棉铃虫为害的能力相对较弱。
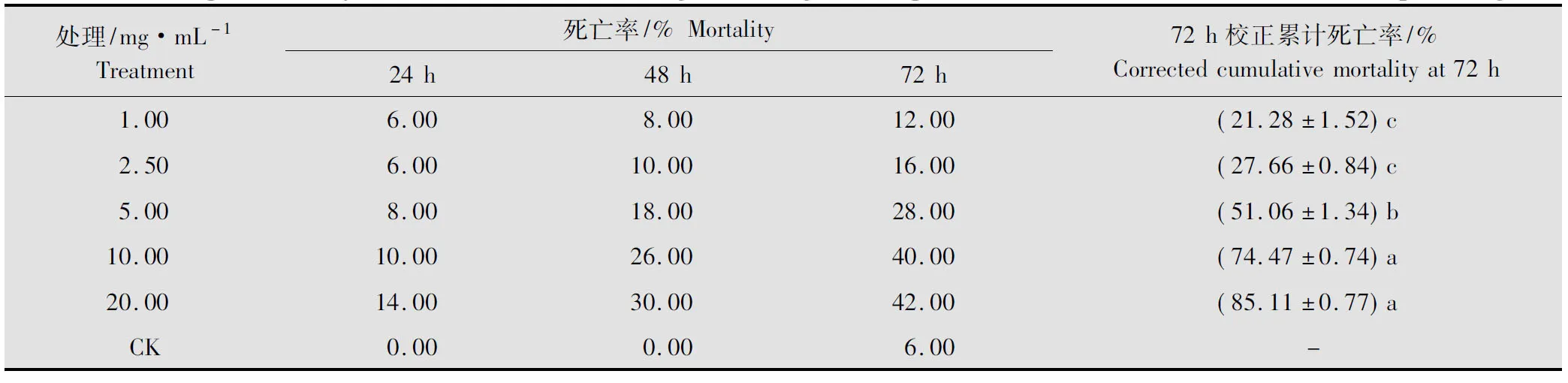
表4 黄帚橐吾乙醇提取物对棉铃虫2~3龄幼虫熏蒸活性
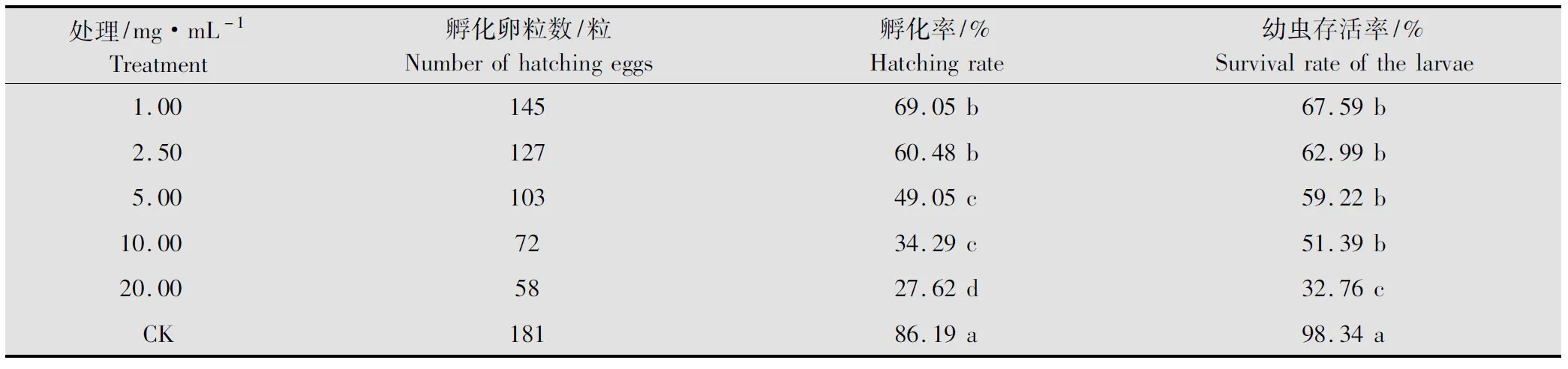
表5 黄帚橐吾乙醇提取物对棉铃虫卵杀卵活性
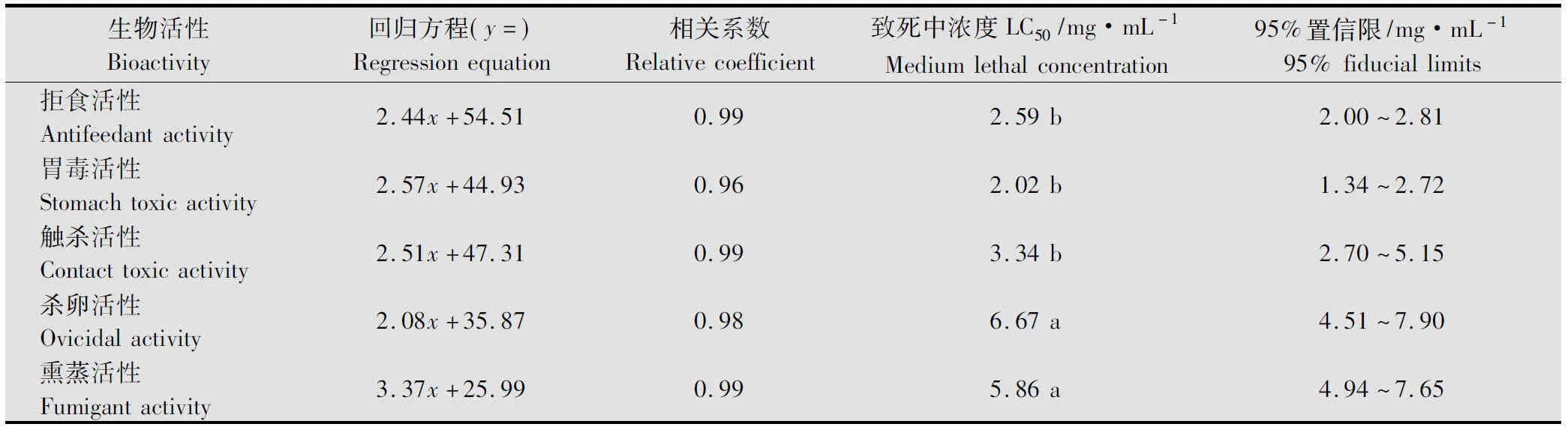
表6 黄帚橐吾乙醇提取物对棉铃虫2~3龄幼虫的生物活性回归分析
3 讨论
长期应用化学农药使得棉铃虫抗药性增强、繁衍猖獗,目前我国棉铃虫已经对拟除虫菊酯、有机磷和氨基甲酸酯及其混配剂均表现出明显的抗药性,加之严重威胁人类健康生存的农药残留问题,促使人们寻求各种趋利避害的方法和安全环保的有效活性物质控制有害生物,从植物次生物质中寻求新的杀虫活性物质是开发新型杀虫剂以及克服或延缓害虫抗药性的有效途径之一[14-16]。本文通过室内毒力测定研究了甘南草原有毒植物黄帚橐吾提取物对棉铃虫幼虫的农药生物活性作用,结果表明:黄帚橐吾乙醇提取物对棉铃虫3龄前幼虫有很强的拒食活性,AFC50为2.59 mg/mL,浓度为10.00 mg/mL时,拒食率可达95%以上;触杀和胃毒活性也较强,LC50在3.00 mg/mL左右,浓度为10.00 mg/mL时,校正死亡率均可达80%以上,而且3 种作用的活性强度随浓度增大而增强。 杀卵和熏蒸活性相对较弱,但浓度大于10.00 mg/mL时也有比较明显的杀灭活性。这证明黄帚橐吾乙醇提取物中含有可以控制棉铃虫幼虫的有效活性物质。
植物次生物质对靶标害虫的活性作用方式是多样和相互交织的,一般不是直接杀灭靶标害虫,而是害虫接触药物后,大多产生拒食反应,停止取食或取食量明显减少,或者药物通过体壁和消化系统进入虫体抑制和诱导昆虫体内的相关活性酶系(如:GSTs、AChE等),使其生长发育受到抑制,不能蜕皮进入下一个发育阶段,最后死亡[17-18]。本研究显示黄帚橐吾乙醇提取物对棉铃虫幼虫的各种生物活性作用中,靶标试虫都在用药后24~48 h内表现出明显的拒食或取食减少,最终死亡的现象,说明黄帚橐吾乙醇提取物对棉铃虫幼虫的生物活性作用可能是其某些活性成分首先影响了幼虫的神经或消化系统酶系,使其不能正常取食,进而影响其正常生长发育,而且触杀、胃毒、拒食和熏蒸活性相互作用,从而导致其较强的靶标生物活性。在高浓度(20 mg/mL)时,也观察到少部分幼虫在用药后12 h死亡的现象,可能是黄帚橐吾乙醇提取物中具有对棉铃虫幼虫直接杀灭的高效活性物质。因此,黄帚橐吾中的高效活性成分及其对棉铃虫的生物活性作用机理还需进一步深入研究,为开发新型高效生物农药和寻找新农药先导化合物奠定基础,提供参考。
甘肃肃南、天祝和甘南等地由于与青藏高原毗邻,其独特的地理、气候环境和自然资源,有毒植物种类十分丰富,近年来由于保护措施不力,过度放牧使得这些地区的天然草场退化,有毒植物大量繁衍,已给畜牧业发展带来严重危害[19-20]。因此在加强对有毒植物实施控制的同时,积极采取科学措施综合利用,变害为宝,使其在农林牧草的病虫害防控中发挥重要作用。
[1] 史志诚. 中国草地重要有毒植物[M].北京:中国农业出版社, 1997.
[2] 马瑞君,王明理,朱学泰,等.黄帚橐吾挥发物的化感作用及其主要成分分析[J].应用生态学报,2005,16(10):1826-1829.
[3] 周丽,高飞,滕云,等.17种高原草地有毒植物对植物病原真菌生物活性的初步研究[J].四川大学学报(自然科学版),2008,45(1):214-218.
[4] 胡冠芳, 刘敏艳, 李玉奇,等.甘肃天然草地30种有毒植物提取物对菜粉碟幼虫的拒食和触杀作用研究[J].草业学报,2011,10(5):169-176.[5] 李晓, 赵志强, 鞠倩, 等. 性诱剂对花生田棉铃虫和小地老虎防治效果研究初探[J]. 江西农业学报, 2013, 25(4): 27-29.
[6] 高明,邓兆荣,孟庆伟,等.11 种杀虫剂对棉铃虫室内毒力测定[J].农药研究与应用, 2011,15(3):17-20.
[7] 史丽,贾明慧. 北方地区棉铃虫发生危害及防治研究[J].内蒙古农业科技,2005(2):15-17.
[8] Ismail F,Wright D J. Synergism of teflubenzuron and chlorfluazuron in an acylurea-resistant field strain ofPlutellaxylostellaL.[J].Pesticide Science, 1992,34(3): 221-226.
[9] 吴文君.杀虫活性的生物筛选[M]∥陈万义,王根龙,李钟华.新农药的研发-方法·进展.北京:化学工业出版社,2007:115-124.
[10]何玉杰,花日茂,李世广,等.八角茴香提取物对长角扁谷盗成虫的熏蒸作用及其酶活性的影响[J].激光生物学报,2013,22(2):159-165.
[11]陈小平.川乌头总生物碱生物活性及作用机理研究[D].南京:南京林业大学,2010.
[12]唐艳丽,邓雁如, 汪汉卿.黄帚橐吾挥发油化学成分的研究[J].中国中药杂志,2003,28(7):627-628.
[13]孙思萧,陈晓斌,赵杰.我国植物源农药研究现状、应用情况及发展[J].中国农资,2006(9):44-45.
[14]Lu Yanhui, Wu Kongming, Jiang Yuying, et al. Mirid bug outbreaks in multiple crops correlated with wide-scale adoption of Bt cotton in China [J].Science,2010,328:1151-1154.
[15]张一宾,张怿,武贤英.世界农药新进展[M].北京:化学工业出版社, 2010:13-159.
[16]李美,高兴祥,高宗军,等.苍耳等48种植物的杀虫活性[J].植物资源与环境学报,2008,17(1):33-37.
[17]董向丽,高希武,郑炳宗. 植物次生物质对棉铃虫谷胱甘肽S 转移酶和乙酰胆碱酯酶的影响[J].植物保护学报,1998,25(1):72-78.
[18]Ranson H,Prapanthadara L,Hemingway J. Cloning and characterization of two glutathione S-transferases from a DDT-resistant strain ofAnophelesgambiae[J].Biochemical Journal,1997,324(1): 97-98.
[19]吕晓英,吕胜利.甘南州草地畜牧业的可持续发展问题[J].草业科学,2002,19(7):1-4.
[20]史志诚,杨旭.草地毒草危害及防除研究概况[J].草业科学,1994,11(3):52-54.
(责任编辑:王 音)
Bioactivity of ethanol extracts ofLigulariavirgaureaagainstHelicoverpaarmigera
Liu Jinxia1, Li Jing1, Li Na1, Du Wenjing1, Ding Pin1, Liu Junxi2, Zhang Jianjun1, Wu Jianrong1
(1. Institute of Biology, Gansu Academy of Sciences, Lanzhou 730000, China; 2. Key Laboratory for Natural Medicine of Gansu Province, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China)
HelicoverpaarmigeraHübner is a major Lepidoptera pest on various crops in China, and it can develop easily pesticide resistance.Ligulariavirgaurea(Maxim.) Mattf. is a kind of poisonous plant growing in the grassland of Gannan Tibetan autonomous prefecture. In order to prevent and controlH.armigeraeffectively, the bioactivity of the ethanol extracts ofL.virgaureaagainstH.armigerawas investigated in laboratory. The results showed that the extracts ofL.virgaureahad strong antifeedant activity against the 2nd-3rd instars ofH.armigerawith the AFC50value of 2.59 mg/mL. Once the concentration of the extracts increased to 10.00 mg/mL, the antifeedant rate could reach to more than 95%. The extracts also demonstrated good contact toxicity and stomach toxicity activity, with LC50value of all above 3.00 mg/mL. The corrected mortality was above 80% when the concentration of the extracts was 10.00 mg/mL. The higher the concentration, the stronger the activity. The extracts had only weak ovicidal and fumigation activities, but the activity was obvious at the concentration of more than 10.00 mg/mL. These results demonstrated that the ethanol extracts ofL.virgaureacould effectively control the harm of ofH.armigeralarvae, which provided a scientific basis for further development of new pesticides withL.virgaureaforH.armigeracontrol.
Ligulariavirgaurea;Helicoverpaarmigera; pesticide; bioactivity

技术与应用Technology&Application
2014-05-07
2014-06-23
全国科学院联盟合作研究项目(2012);2013、2014年陇原青年创新人才扶持计划项目
S 482.39
B
10.3969/j.issn.0529-1542.2015.04.038
* 通信作者 E-mail:93764672@qq.com
——硫酰氟熏蒸应用技术

