Txt5腺病毒载体构建及其在心肌细胞中的表达
彭 浩,陈 宇,李佑锋,朱 旋,周作琼,吴秀山,范雄伟,李永青
(湖南师范大学 心脏发育研究中心 蛋白质化学及鱼类发育生物学教育部重点实验室,湖南 长沙 410081)
Txt5位于2号染色体短臂11区2带,长度为3239 bp,编码蛋白含391个氨基酸,从N 端开始依次为LisH、CTLH、CRA 结构域.LisH 结构域被发现存在于很多病症相关基因的产物之中[1-2].已经有研究证明,Txt5可能参与了MAPK 途径对细胞生命活动的调控[3].RT-PCR 分析显示这一基因在人类早期胚胎的多个组织中有表达,在心脏、肝和肾中表达水平较强.腺病毒转染能够使外源基因在原代细胞中高效表达[4],为了进一步研究Txt5 基因的功能,本文利用Ad-Easy 腺病毒系统研制了小鼠Txt5 基因的过表达腺病毒[5],为后续研究Txt5表达及生物学功能提供实验依据.
1 材料和方法
1.1 实验材料
1.1.1 生物材料
解剖小鼠取心脏提取mRNA,反转录获得cDNAs.连接载体pMD18-T 购买于Takara.穿梭载体pAdTrack-CMV、BJ5183 菌株以及HEK293 A 细胞均为实验室所保存.
1.1.2 所用主要试剂
PmeΙ、Pac Ι 内切酶均购买于NEB公司,T4 DNA连接酶、Sal Ι和Hind III 限制性内切酶买于Takara公司;胶回收纯化试剂盒购买于康维世纪公司,逆转录试剂盒购买于Thermo fisher公司,小量快速质粒提取试剂盒购买于康维世纪公司;兔源HA 一抗为美国圣克鲁斯公司生产;Lipofectamine 2000 试剂购买于英潍捷基公司;高糖DMEM 培养基、F12 培养基和胎牛血清购买于Hyclone公司.
1.2 方法
1.2.1 穿梭质粒pAdTtrack-CMV-Txt5的构建
根据NCBI 数据库,设计特异引物如下:5'-AGATCTATGGATCAGTGCGTGACGGTG-3'和5'-AAGCTTTCAAGCGTAATCTGGAACATCGTATGGGTA GAAAAATATCTGTTTGGCATCTCCT-3'.
PCR 扩增目标片段经测序正确后连接至pMD-18 T 载体,转化大肠杆菌感受态细胞,卡那霉素筛选阳性克隆.
1.2.2 pAd-Txt5的获得
质粒小提试剂盒提取穿梭质粒pAdTrackCMV-Txt5,用Pme Ι 酶37℃酶切过夜线性化,纯化回收酶切产物.将产物转化进入BJ5183 感受态,通过其内的重组组件发生同源重组,涂布于卡那抗性平板上筛选.质粒小提试剂盒提取重组质粒,37℃Pac Ι 酶切过夜线性化,2%凝胶电泳观察是否有两条带,利用酚氯仿法抽提DNA,保存于-20℃.
1.2.3 线性化pAd-Txt5 转染HEK 293 A 细胞
复苏冻存于液氮中的HEK 293A 细胞,培养于10 cm 培养皿中.当细胞融合率达80%左右后,取线性化的pAd-Txt5 4 μg,通过Lipofectamine 2000 转染HEK 293 A 细胞.5 h 后换含10%胎牛血清的培养液10 ml,转染12 h 后通过荧光显微镜观察HEK 293 A 细胞绿色荧光情况,之后每隔12 或24 h 观察荧光并拍照.在第10 d 左右,会有大团细胞漂浮.吸打下细胞,将细胞液用液氮反复冻融2~3次,2 000 r/min,10 min.上清即病毒粗提液,EP 管分装于-80℃保存.
1.2.4 Ad-Txt5 病毒颗粒的扩增
10 cm 皿中293 A 细胞密度约达80%的时候,开始转染:取0.4 ml 病毒粗提液溶液加到皿中,在第3 d左右,会有大团细胞漂浮.将细胞吸打下来,将细胞液用液氮反复冻融2~3次,2 000 r/min,10 min.上清即病毒粗提液,EP 管分装于-80℃保存.
1.2.5 分离和培养原代心肌细胞
解剖出生一或两天SD 大鼠,冰上剪取心脏的心室心尖,PBS 中洗去血液.接着剪碎组织,先后于0.06%胰酶中和II 型胶原酶中进行消化.然后将消化完全后的液体加入10 mL 含10% FBS 培养基中终止消化,混匀,2 000 r/min,10 min,倒去上清.加5 mL含10% FBS的培养基再洗一次,2 000 r/min,5 min.倒去上清,用20 mL 含10% FBS和0.067 mg/mL 浓度Brdu的DMEM-F12 培养液混匀细胞,200 目筛过滤细胞液至两个10 cm 皿中.差速贴壁2 h 后,将悬浮细胞液体吸取到10 cm 皿中,2 d 后更换培养基.
1.2.6 免疫印迹鉴定
将Ad-Txt5 重组腺病毒和Ad-GFP 空载腺病毒感染心肌细胞,72 h 之后可见到绿色荧光,收取心肌细胞,提RNA 及蛋白.将蛋白进行电泳:配置电泳胶,加入等体积的蛋白样品40 μg,120 V 电泳20 min;湿转:100 V,90 min 将蛋白转到PVDF 膜上,15 V,1 h.加封闭液(TBST 加5%脱脂奶粉),37℃封闭1~2 h;用TBST 洗去牛奶的颜色;兔源HA 一抗孵育,4℃过夜;TBST 溶液洗膜,3次,每次5 min,然后进行二抗的孵育,加入二抗,室温1 h;TBST 溶液再次洗膜3次,每次10 min;加入ECL 系统显色,压片,洗膜,观察结果.
1.2.7 RT-PCR
按mRNA Selective PCR Kit 试剂盒说明书取适量的RNA 进行逆转录.利用cDNA为模板,进行一般的PCR实验,反应程序:95℃,预变性2 min,95℃变性30 s,60℃退火30 s,72℃延伸1 min,30个循环;72℃延伸8 min.4℃保存,通过凝胶电泳来分析PCR 结果.
RT-GAPDH-S:5'AGCCCAGAACATCATCCCT3'
RT-GAPDH-A:5'GGTCCTCAGTGTAGCCCAAG3'
2 结果分析
2.1 pAd-Txt5 质粒的获得与鉴定
将pMD18-T-Txt5 利用Sal Ι和Hind III 限制性内切酶进行双酶切,纯化回收目的片段连接于同样双酶切后的穿梭载体pAdtrack-CMV 上,接着进行转化,提取出穿梭质粒pAdTrack-CMV-Txt5.再次Sal Ι和Hind III 限制性内切酶双酶切穿梭质粒进行鉴定,1.8%琼脂糖凝胶电泳结果有2条带,上方条带约为9 200 bp,下方条带约为1 000 bp,证明穿梭质粒构建成功(图1A).将重组完成后的腺病毒质粒用Pac Ι 酶切后进行1.8%琼脂糖凝胶电泳结果有2条带,上方条带约为34 kb,下方条带约为4 kb 亮带,说明腺病毒质粒pAd-Txt5 成功获得(图1B).
2.2 腺病毒颗粒的获得
腺病毒质粒pAd-Txt5 线性化之后转染HEK 293A细胞,24 h 后可见到绿色荧光(GFP),之后荧光逐渐增多,48 h 时荧光大量出现(图2),12 d 左右,细胞大团飘起,移液器将细胞吸打下来,反复冻融获得病毒溶液,过滤后再次感染293 A 细胞,12 h 后依然可以看到绿色荧光.
2.3 Txt5 过表达腺病毒在心肌细胞中的表达

图1 穿梭质粒pAdTrack-CMV-Txt5和腺病毒质粒pAd-Txt5酶切后电泳图
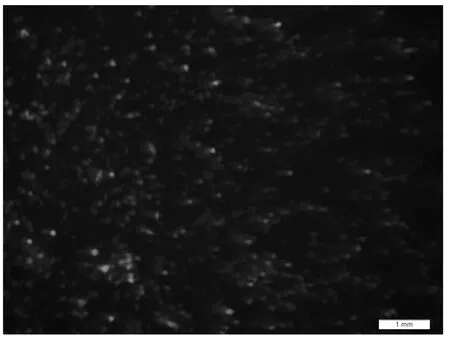
图2 线性化pAd-Txt5转染48 h后观察结果(×20)
Txt5 基因通过IRES 序列与腺病毒载体基本骨架中的GFP 序列共表达,感染了腺病毒的心肌细胞就会出现绿色荧光.Txt5 过表达腺病毒感染SD 大鼠原代心肌细胞,48 h 后出现比较强的绿色荧光.病毒没有使心肌细胞出现明显的死亡现象且形态完整,可见毒性还算安全(图4).
为检测腺病毒是否能发挥应有的作用,将过滤后的病毒粗提液感染SD 大鼠原代心肌细胞.提取RNA和蛋白,然后进行RT-PCR,另外用兔HA 一抗和羊抗兔二抗做Western blot 检测.RT-PCR 显示,Txt5表达上调;Western blot的结果显示,感染Txt5 过表达腺病毒的心肌细胞中检测到与Txt5 融合表达的HA,而感染空载腺病毒Ad-GFP的对照组中未检测到该条带(图4),说明该腺病毒成功介导Txt5 在SD 大鼠原代心肌细胞中的表达.
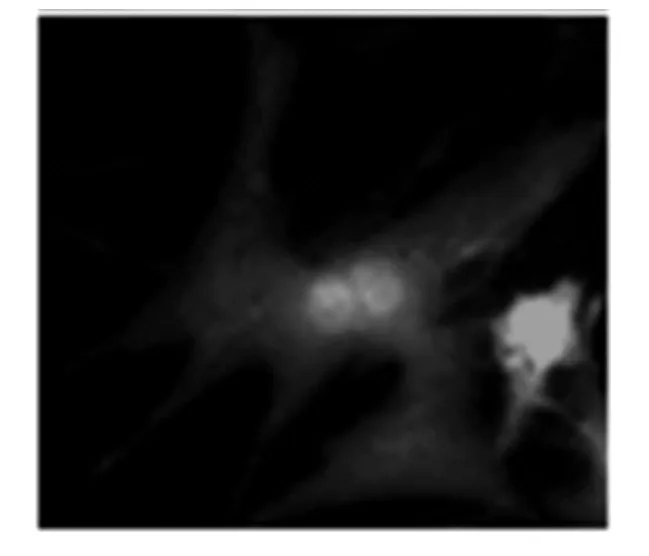
图3 Txt5过表达腺病毒感染原代心肌细胞观察结果

图4 RT-RCR与免疫印迹法检测腺病毒效果
3 讨论
研究发现许多神经系统疾病相关基因的产物都具有LisH 结构域[6].这一结构域可能参与调节微管的动力,参与二聚化或与微管胞质动力蛋白重链相结合.Txt5 蛋白包含有LisH 结构域,这给我们启示,是否Txt5和MAPK 信号通路有关[7].MAPK是一类重要的细胞信号转导激酶,调节多种激素、神经递质、细胞因子、生长因子对细胞生理活动的作用,该激酶作用底物多为例如Elk21、AP21[8]等的转录因子.
腺病毒在研究基因功能和治疗方面的应用具有以下优势:1)比较广的宿主范围,可以感染原代心肌细胞;2)能有效进行增殖,滴度较高,易于培养;3)基本上不插入宿主的基因组,不造突变[9-10].本文所用的腺病毒载体基本骨架中便含有GFP 序列,通过IRES 序列Txt5 基因与GFP 共表达,绿色荧光就会出现在感染了腺病毒的心肌细胞,视觉上就能判定感染效率.而RT-PCR 证明mTxt5 水平的上调,western blot发现HA表达,说明腺病毒效果良好,符合实验要求.
本文研制小鼠Txt5 过表达腺病毒的操作简单,周期较短,并且获得的腺病毒滴度较高,毒性不强,能满足体外实验的要求.而现今市面上检测Txt5的抗体比较少,本文研究设计中将Txt5 与HA 标签融合表达,从而可以通过常用的HA 对应抗体检测Txt5表达,给Txt5表达水平和位置的研究带来了极大的帮助.
[1]SIMS RJ,WEIHE EK,ZHU L,et al.M-Bop,a repressor protein essential for cardiogenesis,interacts with skNAC,a heart-and muscle-specific transcription factor[J].The Journal of Biological Chemistry,2002,277(29):26524-26529.
[2]GOTTLIEB PD,PIERCE SA,SIMS RJ,et al.Bop encodes a muscle-restricted protein containing MYND and SET domains and is essential for cardiac differentiation and morphogenesis[J].Nature Genetics,2002,31 (1):25-32.
[3]唐文岘,王跃群,吴秀山,等.人类新基因RMND5A的克隆及功能研究[J].湖南师范大学自然科学学报,2008,31 (1):85-89.
[4]Ma H,Liu Y,Liu S,et al.Oral adeno-associated virus-TRAIL gene therapy suppresses human hepatocellular carcinoma growth in mice[J].Hepatology,2005,42(6):1355-1363.
[5]He TC,Zhou S,Da Costa LT,et al.A simplified system for generating recombinant adenovi-ruses[J].Proc Natl A cad Sci USA,1998,95 (5):2509-2514.
[6]KIM MH,COOPER DR,OLEKSY A,et al.The structure of the N2 terminal domain of the product of the lissencephaly gene Lis1 and its functional implications[J].Structure,2004,12 (6):987-98.
[7]UMEDA M,NISHITANI H,NISHIMOTO T,et al.A novel nuclear protein,Twa1,and Muslin comprise a complex with Ran BPM[J].Gene,2003,16 (303):47-54.
[8]DAVIS RJ.Signal transduction by the JNK group of MAP kinases[J].Cell,2000,103 (2):239-252.
[9]陈娜娜,向冬喜,郑丛龙,等.腺病毒及其研究进展[J].大连医科大学学报,2010 (5):586-590.
[10]邱峰,陈世知,陈虹,等.新型腺病毒载体的制备及其特性研究[J].重庆医科大学学报,2006 (3):330-333.

