家福捕鸟蛛粗毒对美洲蜚蠊和小鼠半致死剂量的测定
胡朝暾,肖 震,黄 艳,刘中华
(1.怀化学院 生命科学系,湖南 怀化 418008;2.湖南师范大学 生命科学学院,湖南 长沙 410081)
天然生物毒素研究对神经生物学和药理学研究与发展具有重要的意义.许多天然神经毒素已成为研究离子通道、神经递质、受体、神经突触传递等神经生物学和神经药理学基础理论问题不可替代的工具试剂.蜘蛛毒素是这类天然毒素一个新的重要的来源.蜘蛛毒素是离子通道工具试剂、特定药理学活性新型化合物和生物杀虫剂来源物质日益受到人们关注和广泛重视[1-7].
家福捕鸟蛛是一种生活在中国广西、云南边远山区的中等大小,全身长满绒毛的有毒蜘蛛(图1).作为蜘蛛新种,家福捕鸟蛛第一次于2008年在云南被发现并进行了分类方面的研究[8].笔者于2012年4月在广西宁明县中越边境山区采集了该种蜘蛛,并开展了其毒素研究.前期研究表明蜘蛛毒素具有异质性,不同种类的蜘蛛其毒腺分泌的毒素分子具有不同的结构与功能特性.作为最近才发现和鉴定的新种蜘蛛——家福捕鸟蛛包含了许多具有特定药理学活性和生物杀虫剂的毒素分子.因此,本文开展家福捕鸟蛛粗毒对美洲蜚蠊和小鼠的急性毒性实验的测定,来判断粗毒的毒性大小以及粗毒对物种的选择性,可为家福捕鸟蛛毒素的后续研究提供实验依据.
1 材料与方法
1.1 材料

图1 家福捕鸟蛛
1.1.1 实验动物与家福捕鸟蛛
家福捕鸟蛛采于广西宁明的山区;昆明种小鼠购自中南医科大学动物房;美洲蜚镰从网上购买后放置在实验室饲养.
1.1.2 试剂与溶液的配制
昆虫生理盐水:称取7.6 g NaCl、0.3725 g KCl、0.111 g CaCl2,溶解在少量的超纯水中,定容到100 ml.
哺乳动物生理盐水:称取0.9 g NaCl,溶解在少量超纯水中,定容到100 ml.
1.1.3 仪器设备
采毒器 (中国南方蜘蛛养殖所专用);离心机(德国Eppendorf 5424 型).
1.2 实验方法
1.2.1 家福捕鸟蛛毒液
采用电刺激方法采集家福捕鸟蛛毒液.具体过程如下:将一个内径2 cm,高5 cm的塑料杯固定在铁架台上作为毒液接收皿,用纱布包好的大镊子从侧面夹住蜘蛛胸部,让蜘蛛张开螯爪并深入杯内,然后用5~10 V、15~40 Hz的脉冲电流刺激螯爪基部1~3 s,蜘蛛马上将触肢紧紧抱住杯壁,螯爪用力刺向杯壁并射出白色透明的液体.用移液器吸取并计量每只蜘蛛射出毒液的体积,然后将毒液收集转移至进口EP 管里,8 000 rpm 4℃离心20 min,收集上清液,上清液即为家福捕鸟蛛毒液.毒液经真空冷冻干燥后所得粉末即为家福捕鸟蛛粗毒.
1.2.2 LD50测定预实验[9]
选取美洲蜚蠊12只随机分成6组,每组2只用昆虫生理盐水配制一系列浓度的蜘蛛毒液,将20 μl 毒液从蜚蠊第四、五腹板交接处注入,观察蜚蠊的死亡情况.选取昆明小鼠4只,用生理盐水配制一系列的蜘蛛毒液,将100 μl 毒液注射到小鼠的腹腔.观察小鼠的死亡情况.通过蜚蠊和小鼠的死亡情况来确定毒素的大致注射剂量.
1.2.3 家福捕鸟蛛粗毒对美洲蜚蠊LD50的测定[10]
选取体重为1 g 左右的美洲蜚蠊42只,粗毒用昆虫生理盐水溶解.将蜚蠊共分7组,每组6只,按照蜚蠊每克体重0、25.45、38.17、57.26、85.89、128.84、193.25 μg 剂量从第四、五腹板交接处注射毒液20 μl,观察24 h,统计蜚蠊的死亡情况.
1.2.4 LD50的计算公式
测定完成后,统计美洲蜚蠊的死亡数目,计算死亡率(P),LD50的计算按改良寇式法的公式:
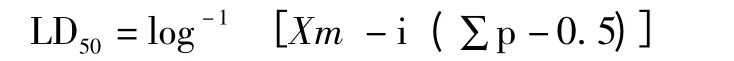
式中Xm为最大剂量的对数值,p为各组动物死亡率,∑p为各组死亡率的总和,i为相邻两组剂量之比的对数.
2 结果
2.1 家福捕鸟蛛毒液
本实验采用电刺激方法采集家福捕鸟蛛毒液,毒液为无色透明的液体,毒液易溶于水.我们对每只蜘蛛每次射毒量、鲜毒液的重量,毒液冻干后的重量,毒液的蛋白质含量等性质进行了初步测定,其结果见表1.
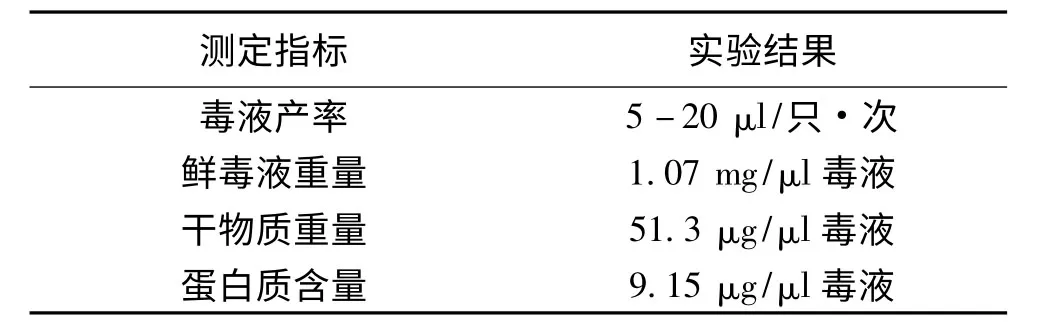
表1 家福捕鸟蛛毒液的部分性质
2.2 家福捕鸟蛛粗毒对美洲蜚蠊LD50的测定
根据预实验的结果,确定家福捕鸟蛛粗毒对美洲蜚蠊急性毒性实验各组剂量为:0、25.45、38.17、57.26、85.89、128.84、193.25 μg/g.粗毒注射后观察各组蜚蠊的中毒症状,24 h 后统计蜚蠊死亡情况.结果见表2.对照组注射等体积的昆虫生理盐水时,蜚蠊没有出现明显的异常情况,说明注射昆虫生理盐水对蜚蠊没有明显的影响.实验组粗毒剂量为25.45 μg/g 时,蜚蠊出现轻微的行动迟缓的中毒症状,症状在几分钟内很快消失,24 h 内蜚蠊无死亡,当粗毒剂量为38.17 μg/g 时,蜚蠊出现后肢麻痹、行动迟缓等较明显的中毒症状,24 h 内统计有1只蜚蠊死亡.随着粗毒剂量的加大,蜚蠊中毒症状加重,死亡数目增加.当粗毒剂量为193.25 μg/g 时,蜚蠊刚开始表现为到处乱串,异常兴奋和全身抖动,然后活动减弱,直至死亡,大部分蜚蠊死亡时腹部朝上.蜚蠊在几分钟内全部死亡.经测定得到家福捕鸟蛛粗毒对美洲蜚蠊LD50为85.90 μg/g.
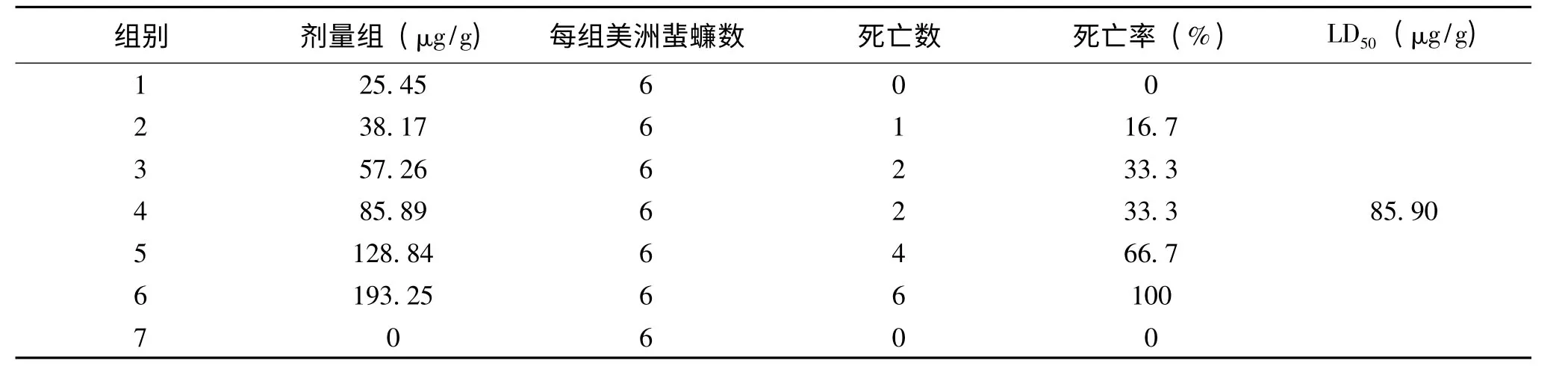
表2 家福捕鸟蛛粗毒对美洲蜚蠊LD50统计结果
2.3 家福捕鸟蛛粗毒对小鼠急性毒性预实验
选取4只小鼠按照10、16.67、19.38和46.30 mg/kg 小鼠体重进行家福捕鸟蛛粗毒对小鼠急性毒性预实验,小鼠经腹腔注射粗毒后的中毒症状如表3.从表中结果可以发现家福捕鸟蛛粗毒对小鼠毒性较弱,当粗毒注射剂量为10 mg/kg 体重时,小鼠未出现明显的中毒症状,说明此剂量粗毒对小鼠无明显影响.当粗毒注射剂量为16.67 mg/kg 体重时,小鼠出现较明显的中毒症状,但症状在一小时内消失.当剂量达到19.38 mg/kg 时,小鼠出现行动迟缓、腹部剧烈抽搐等明显的中毒症状,症状也能在一小时内消失;当剂量达到46.30 mg/kg 时,小鼠出现非常明显的中毒症状,24 min 时中毒死亡.根据预实验结果,推测家福捕鸟蛛粗毒对小鼠的LD50在19.38~46.30 mg/kg之间,其数值远大于以前公布的几种蜘蛛粗毒的数值.因此,从节约毒素的角度和实际意义出发,没有进行粗毒对小鼠LD50实际值的测定.

表3 家福捕鸟蛛粗毒对昆明小鼠急性毒性预实验结果
3 讨论
3.1 电刺激采毒法
电刺激采毒法是笔者在实验室原有塑料软管采毒法基础上探索出来的一种新的蜘蛛毒液采集方法.电刺激采毒法具有很多优点:单蛛毒液采集量多;能够让蜘蛛快速射出全部毒液;所采集的毒液纯度较高;采毒技术简单,易于操作;适合较大规模的毒液采集.不足之处是电刺激采集时容易对蜘蛛造成损伤,如果刺激强度(刺激电流和频率)及刺激时间控制不好蜘蛛很容易被电晕甚至电死(刺激强度大、刺激时间长或者两者兼有不仅直接对蜘蛛机体造成损伤,而且还会造成蜘蛛体液的大量流失,最终影响蜘蛛正常的生理活动甚至导致蜘蛛的死亡).因此,应根据蜘蛛个体的大小严格控制刺激强度和刺激时间,一般以蜘蛛电刺激后不产生明显异常症状为准.
3.2 家福捕鸟蛛粗毒对美洲蜚蠊和小鼠LD50的测定
在早期的药学、毒理学领域研究中,往往需要一个量化指标直观地表述某种药物的毒性.1927年,英国生物学家Trevn 建议用导致一半动物死亡的剂量来表示药物的毒性大小,并发表于皇家学会杂志,由此确立了半数致死量的基本概念.如今在动物急性毒性试验中,使受试的动物半数死亡所需化学药剂的剂量(Median Lethal Dosage),通常称为半数致死量,简称LD50.它是一个经过统计学处理计算得到的数值,通常以有毒物质质量与实验生物体质量之比来表示,如mg/kg[11].
家福捕鸟蛛粗毒对美洲蜚蠊LD50结果表明家福捕鸟蛛粗毒对美洲蜚蠊具有较强的毒性,不同剂量的粗毒注入后,美洲蜚蠊都表现出程度不同的中毒症状.测得家福捕鸟蛛粗毒对美洲蜚蠊LD50为85.90 μg/g.家福捕鸟蛛粗毒对美洲蜚蠊的毒性要强于虎纹捕鸟蛛粗毒(其LD50为300 μg/g)[10],但弱于间斑寇蛛粗毒(其LD50为1.87 μg/g)[12]和大腹园蛛粗毒(其LD50为30.73 μg/g)[13].因此,家福捕鸟蛛粗毒是一种中等毒性的昆虫蜘蛛毒素.家福捕鸟蛛粗毒对小鼠LD50在19.38~46.30 mg/kg之间,该数值远大于虎纹捕鸟蛛粗毒对小鼠的LD50(其LD50为1.16 mg/kg)[10]、海南捕鸟蛛粗毒对小鼠的LD50(其LD50为1.25 mg/kg)[14]、雷氏大疣蛛粗毒对小鼠的LD50(其LD50为2.852 mg/kg)[15]、间斑寇蛛粗毒对小鼠的LD50(其LD50为0.16 mg/kg)[12].因此,家福捕鸟蛛粗毒对小鼠的毒性较弱.家福捕鸟蛛粗毒可能主要是一种选择性作用于昆虫的蜘蛛毒素.据调查,在家福捕鸟蛛栖息地,家福捕鸟蛛主要以直翅目的蟋蟀、蚱蜢、蝗虫,蜚蠊目的蜚蠊等中小型昆虫为主.笔者认为经过亿万年的进化,家福捕鸟蛛粗毒进化为一种麻痹和杀死昆虫高效的毒素.有关家福捕鸟蛛毒素的作用机理有待深入研究.
[1]Saez N J,Senff S,Jensen J E,et al.Spider-venom peptides as therapeutics[J].Toxins (Basel),2010,2(12):2851-2871.
[2]Klint J K,Senff S,Rupasinghe D B,et al.Spider-venom peptides that target voltage-gated sodium channels:pharmacological tools and potential therapeutic leads[J].Toxicon,2012,60 (4):478-491.
[3]Windley M J,Herzig V,Dziemborowicz S A,et al.Spider-venom peptides as bioinsecticides[J].Toxins,2012,4 (3):191-227.
[4]Bende N S,Dziemborowicz S,Herzig V,et al.The insecticidal spider toxin SFI1 is a knottin peptide that blocks the pore of insect voltage-gated sodium channels via a large β-hairpin loop[J].FEBS J,2015,282 (5):904-920.
[5]Sachkova M Y,Slavokhotova A A,Grishin EV,et al.Structure of the yellow sac spider Cheiracanthium punctorium genes provides clues to evolution of insecticidal two-domain knottin toxins[J].Insect Mol Biol,2014,23 (4):527-538.
[6]Smith J J,Herzig V,King G F,et al.The insecticidal potential of venom peptides[J].2013,70 (19):3665-3693.
[7]King G F,Hardy M C.Spider-venom peptides:structure,pharmacology,and potential for control of insect pests[J].Annu Rev Entomol,2013,58:475-496
[8]Zhu M S,Zhang R.Revision of the theraphosid spiders from China (Araneae:Mygalomorphae)[J].J Arachnol,2008,36:425-447.
[9]常征.阿霉素对昆明种小白鼠腹腔给药的半致死剂量研究[J].文山师范高等专科学校学报,2009,22 (2):110-113.
[10]梁宋平,覃于宾,张东裔,等.虎纹捕鸟蛛毒的生物学活性鉴定[J].动物学研究,1993,14 (1):60-65.
[11]杨海智,马海霞,杨信东.国内关于半数致死量及类似生物效应指标测算方法研究进展[J].国外医药抗生素分册,2012,33 (2):62-66.
[12]杨静.间斑寇蛛粗毒的生物学活性分析[D].长沙:湖南师范大学,2007.
[13]段志贵.大腹园蛛粗毒的理化性质及毒素组学研究[D].长沙:湖南师范大学,2012.
[14]肖玉成.蜘蛛钠离子通道抑制神经毒素的结构与功能研究[D].长沙:湖南师范大学,2002.
[15]肖桥斌.雷氏大疣蛛毒素的结构与功能研究[D].长沙:湖南师范大学,2001.

