裂殖壶菌产DHA发酵培养基的优化
王 灿,张 伟,张明亮,黄建忠,*
(1.福建师范大学,工业微生物发酵技术国家地方联合工程研究中心,工业微生物教育部工程研究中心,生命科学学院,福建福州350108;2.福建师范大学生命科学学院,福建福州350108)
裂殖壶菌产DHA发酵培养基的优化
王灿1,张伟2,张明亮1,黄建忠1,*
(1.福建师范大学,工业微生物发酵技术国家地方联合工程研究中心,工业微生物教育部工程研究中心,生命科学学院,福建福州350108;2.福建师范大学生命科学学院,福建福州350108)
从成本控制和发酵罐扩大培养监测控制方面考虑,优化了裂殖壶菌(Schizochytrium sp.FJU-512)产DHA发酵培养基。利用单因素实验和正交实验优化了发酵培养基碳氮源组分,均匀设计实验优化了无机盐组分。最佳产DHA发酵配方为葡萄糖120g/L,酵母浸膏5g/L,谷氨酸钠20g/L,硫酸铵0.25g/L,海水晶25g/L,KH2PO44.0g/L,MgSO4·7H2O 0.5g/L,CaCO35.0g/L,Na2SO43.0g/L,FeSO4·7H2O 20mg/L,维生素B10.005g/L,维生素B120.005g/L。优化后,裂殖壶菌DHA产量到达13.83g/L,提高了22%,且培养基成本降低40%左右。
裂殖壶菌,碳氮源,正交实验,发酵培养基,DHA
DHA(Docosahexaenoic acid,22:6△4.7.10.13.16.19,全名二十二碳六烯酸)是一种重要的长链多不饱和脂肪酸(polyunsaturated fatty acid,简称PUFA),属于ω-3系列[1]。其具有提高和增强婴幼儿智力、记忆力,降低血脂,防动脉硬化和延缓衰老等一系列优点,因此广泛受到市场的追捧[2-5]。
裂殖壶菌生长繁殖快,无毒害,富含DHA[6],其安全性甚至得到美国食品和药品部(Food and Drug Administration)的认可[7],且能有效缓解因渔业资源的紧缺、鱼油中DHA含量过低和提取浓缩工艺复杂等带来的DHA产量和质量问题[8-10],因此已成为工业化生产DHA的热门菌种。裂殖壶菌生长代谢除受到其本身的基因水平调控外,培养基组成等因素亦对其生长代谢产生巨大影响[11]。本实验在前期实验的基础上,从成本控制和发酵罐扩大培养监测控制方面考虑,通过单因素实验、正交实验和均匀设计实验对裂殖壶菌(Schizochytrium sp.FJU-512)产DHA发酵培养基进行了优化,以期为DHA的工业化生产提供一定技术支持。
1 材料与方法
1.1材料与仪器
裂殖壶菌(Schizochytrium sp.FJU-512) 利用松花粉垂钓法从台湾海峡水域中分离获得的一株具独立知识产权的DHA高产菌株;葡萄糖、甘油、蛋白胨、酵母浸汁粉、磷酸二氢钾、硫酸镁、硫酸钠和碳酸钙等分析级,西陇化工有限公司;维生素B1和维生素B12食品级,福州海王福药制药有限公司;海水晶工业级,天津滨海新区汉沽同兴海水晶厂;种子培养基(g/L) 葡萄糖30,蛋白胨10,酵母浸汁粉15,海水晶15,pH自然;初始发酵培养基(g/L) 葡萄糖60,甘油70,(NH4)2SO40.25,酵母浸粉15,蛋白胨15,海水晶25,KH2PO41,Na2SO42,维生素B10.005,维生素B120.005,pH自然。
高压灭菌锅上海博迅实业有限公司;双层全控温摇床上海智诚分析仪器有限公司;高速台式冷冻离心机BeckMan Coultek,Inc;紫外分光光度计Amersham Bioscience;气质联用仪Agilent;循环水多用真空泵郑州长城工贸有限公司;恒温培养箱上海智诚分析仪器有限公司。
1.2实验方法
1.2.1培养方法
1.2.1.1种子活化取保藏于-80℃冰箱中菌种平板划线活化,28℃培养24~36h,挑单菌落转接于斜面,28℃培养24~36h后,转至15~17℃条件下保存。
1.2.1.2种子培养接种环挑取15~17℃恒温保藏菌种一至两环,转接至装量40mL种子培养基的250mL三角烧瓶中,25~30℃恒温摇床180~220r/min培养72h。
1.2.1.3发酵培养取0.5mL种子液移入含有50mL发酵培养基的250mL三角烧瓶中,28℃恒温摇床230r/min培养5d。
1.2.2发酵液残糖含量测定取5mL发酵样品6000r/min,5min离心,去除胞体及固体残渣,取上清液,稀释至合适浓度,使残糖值落至0.6~0.8g/L,应用SBA-40D生物传感器测葡萄糖残留量,测量值×稀释倍数即为残糖含量。
1.2.3发酵液生物量测定取10mL发酵样品于已知重量的50mL离心管中,8000r/min,4℃冷冻离心10min,用去离子水重悬离心,重复2次后,保留胞体,于烘箱80℃烘干至恒重,所得重量减去50mL离心管即为10mL发酵样品生物量。
1.2.4油脂的改进酸热提取法取5mL发酵样品于10mL离心管中,8000r/min,4℃冷冻离心10min,弃上清,用生理盐水离心洗涤,重复三次。得到湿菌体重悬于3mL浓盐酸,70~80℃水浴1h左右,破壁,冷却后加0.75mL无水乙醇与2mL正己烷,充分摇匀,1200r/min,2min离心,萃取油脂,取上清于已知重量螺口管中,重复3次,将螺口瓶放置干燥器中真空过夜抽干即得油脂,再次称重,所得重量减去螺口瓶重即为油脂重量。
Design and Experiment of EGR System with Venturi Tube for Sequential Turbocharged Diesel Engine
1.2.5脂肪酸组成分析粗油脂用正己烷溶解,根据油脂的重量,取适量的正己烷溶解,尽量使油脂浓度为0.05g/mL,取出1mL甲酯化,加2mL 10%HCl/CH3OH(100μL HCl,900μL CH3OH)62℃恒温回流酯化1h,冷却后加入正己烷,充分振荡静置分层,取至少0.5mL上清GC-MS分析。GC-MS条件:6890C-5975 N,HPINNOWAX极性毛细管柱,0.25μm×250μm×30m;载气:He;载气流量:1.0mL/min,恒定流量;上样模式:分流,分流比20∶1;进样量1μL;进样口温度280℃;检测器温度280℃;升温程序:150℃保持1min,10℃/min升温至200℃,2℃/min升温至220℃,保持5min。240℃后运行3min,溶剂延迟时间3min,扫描方式:全扫描。
1.2.6裂殖壶菌产DHA发酵培养基的优化
1.2.6.1碳氮源单因素实验
a.不同碳源配比对裂殖壶菌产DHA的影响选取葡萄糖和甘油作为复合碳源,在初始发酵培养基中,其他组分含量不变,考察不同葡萄糖和甘油配比(1∶0、4∶1、3∶2、2∶3、1∶4、0∶1)对裂殖壶菌发酵产DHA的影响。
b.不同复合氮源对裂殖壶菌产DHA的影响选定四种不同复合氮源作为发酵氮源,分别为谷氨酸钠和玉米浆粉(复合比例为4∶1),谷氨酸钠和酵母浸膏(复合比例为4∶1),酵母浸膏和玉米浆粉(复合比例为1∶1),谷氨酸钠、玉米浆粉和酵母浸膏(复合比例为3∶1∶1),在初始发酵培养基中,其他组分含量不变,考察不同复合氮源对裂殖壶菌发酵产DHA的影响。
1.2.6.2碳氮源正交实验通过碳氮源的单因素分析,确定裂殖壶菌发酵碳氮源组成,以此为基础,进行4因素3水平的正交实验,因素水平表见表1,考察各因素对裂殖壶菌产DHA的显著程度并得出各个因素的最佳水平组合,确定发酵培养基中最佳碳氮源组成成分。
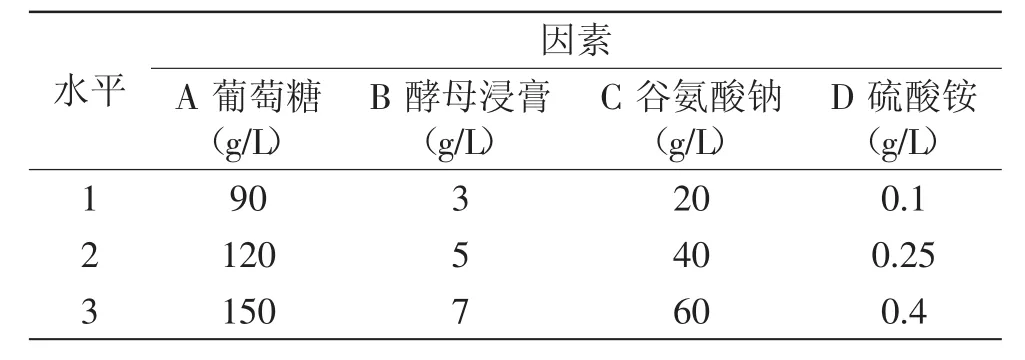
表1 正交实验因素及水平Table.1 Factors and levels of the orthogonal test
1.2.6.3无机盐均匀设计实验通过前期碳氮源的单因素和正交实验,确定了裂殖壶菌发酵培养基的碳氮源,以此为基础,选取六种无机盐(KH2PO4、MgSO4·7H2O、CaCO3、Na2SO4、CaCl2、FeSO4·7H2O)进行六因素六水平的均匀设计实验,考察各因素对裂殖壶菌产DHA的影响并得出各个因素的最佳水平组合。
1.3数据分析
采用单因素、无空列正交实验和均匀设计实验,每组实验三次平行实验,探讨了不同碳氮源和无机盐对裂殖壶菌产DHA的影响并使用SAS 9.2软件对正交实验所得数据进行方差分析,DPS 7.05软件对均匀设计实验数据进行二次多项式逐步回归分析,分别得出各个影响因素的显著性。
2 结果与分析
2.1碳氮源单因素实验结果
2.1.1不同碳源配比对裂殖壶菌产DHA的影响如图1所示,裂殖壶菌DHA产量变化并没有和复合配比变化成相关关系,葡萄糖和甘油比例为2∶3时其产量最高,12.73g/L;其次为3∶2;再次为1∶0即全部以葡萄糖作为碳源,产量为11.6g/L,相比于前两种复合碳源,碳源比例为1∶0培养基中的高浓度糖对裂殖壶菌的生长会产生一定的抑制作用,从而影响了DHA的产量。但在DHA工业化生产中,葡萄糖一般采用流加方式控制,从而可消除高糖抑制,另外由于葡萄糖相对于甘油廉价,且能实现在线检测,因此确定最佳碳源配比为1∶0,即碳源仅为葡萄糖。

图1 不同碳源配比对裂殖壶菌产DHA影响Fig.1 The influence of the ratios of different carbon sources on DHA production
2.1.2不同复合氮源对裂殖壶菌产DHA的影响如下图2所示,在四种复合氮源中,谷氨酸钠和酵母浸膏,最利于裂殖壶菌发酵,DHA产量最高,达到13.2g/L,其次为谷氨酸钠和玉米浆粉,DHA产量为11.8g/L,而以谷氨酸钠、玉米浆粉和酵母浸膏三种为复合氮源时产量最低,因此可确定最佳复合氮源为谷氨酸钠和酵母浸膏。

图2 不同复合氮源对裂殖壶菌产DHA影响Fig.2 The influence of different compound nitrogen source on DHA production
2.2碳氮源正交实验
通过碳氮源的单因素分析,确定裂殖壶菌发酵碳氮源组成,以此为基础,以葡萄糖、酵母浸膏、谷氨酸钠、硫酸铵为主要因素,确定步长和方向,以DHA产量为指标,进行四因素三水平的正交实验,考察各因素对裂殖壶菌产DHA的显著程度并得出各个因素的最佳水平组合,结果见表2,方差分析结果见表3。

表2 L9(34)正交实验结果Table.2 Results of the orthogonal test

表3 正交结果方差分析Table.3 Variance analysis of the orthogonal test
由表2的极差值可知,四个因素对产DHA影响作用大小依次为谷氨酸钠、葡萄糖、硫酸铵、酵母浸膏,由表3方差分析中可看出,因素A(葡萄糖)、因素C(谷氨酸钠)对结果影响极显著(p<0.01),因素B(酵母浸膏)、因素D(硫酸铵)对结果影响不显著(p>0.05),综合各个因素的K值比较可得,此次实验理论最优培养基为A2B2C1D2,即葡萄糖120g/L,酵母浸膏5g/L,谷氨酸钠20g/L,硫酸铵0.25g/L。
由于该组合不在正交实验表中,为进一步确定实验结果,故将理论最优培养基组合A2B2C1D2与正交实验表中结果最优的第6号实验A2B3C1D2进行对比验证,通过三次平行实验,结果表明,理论最优培养基组合A2B2C1D2的DHA产量为12.1g/L,高于第6号实验A2B3C1D2的10.7g/L。因此确定最佳碳源配方为葡萄糖120g/L,酵母浸膏5g/L,谷氨酸钠20g/L,硫酸铵0.25g/L。
2.3无机盐均匀设计实验
以单因素和正交实验优化的碳氮源为基础,选取六种无机盐,按照六因素六水平U6(66)均匀设计实验方案,研究这六种无机盐KH2PO4(x1)、MgSO4·7H2O(x2)、CaCO3(x3)、Na2SO4(x4)、CaCl2(x5)、FeSO4·7H2O(x6)对DHA产量(y)的影响,每组实验3个平行样,取平均值,实验结果表4。
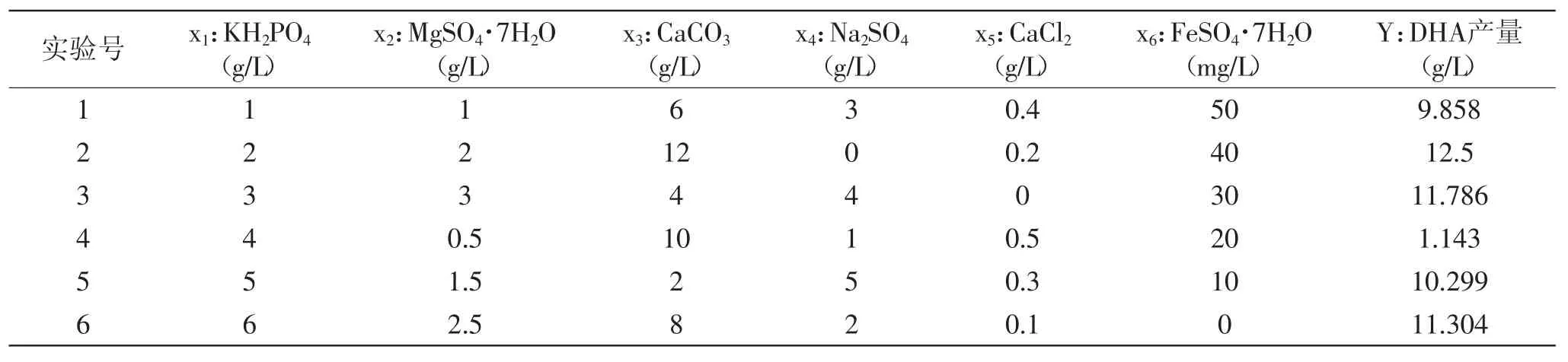
表4 均匀设计实验结果Table.4 The results of homogeneous design
经DPS数据处理系统的二次多项式逐步回归分析,分别进行回归系数的显著性检验,结果见表5。
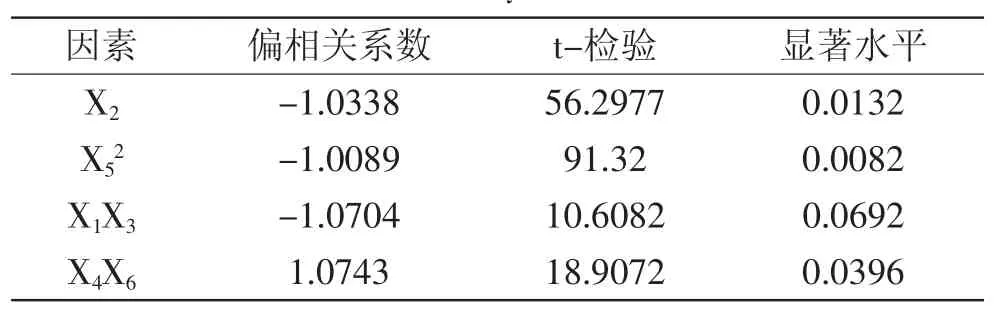
表5 DHA产量-回归方程的显著性检验Table.5 Significance test of regression equation about DHA yield
得回归方程表达式:
Y=27.638-5.733X2-91.725X52-0.024X1X3+ 0.011X4X6
方程复相关系数R=0.999,总体显著性检验值F= 11315.2953,剩余标准差S=0.0432,显著水平p=0.0071,方程极显著,它的可信度高,说明该方程能较好的拟合不同无机盐配方对裂殖壶菌DHA产量的影响。最优无机盐组成为:KH2PO44.0g/L、MgSO4·7H2O 0.5g/L、CaCO35.0g/L、Na2SO43.0g/L、CaCl20g/L、FeSO4·7H2O 20mg/L。
以均匀设计实验优化结果为基础,结合以上优化的最佳碳氮源配方,进行三次平行验证实验,结果显示DHA平均产量到达13.83g/L。对比优化前的初始发酵培养基配方,产量提高了22%,且培养基成本降低40%左右。因此可确定优化后的裂殖壶菌(Schizochytrium sp.FJU-512)最佳产DHA发酵配方为葡萄糖120g/L,酵母浸膏5g/L,谷氨酸钠20g/L,硫酸铵0.25g/L,海水晶25g/L,KH2PO44.0g/L,MgSO4·7H2O 0.5g/L,CaCO35.0g/L,Na2SO43.0g/L,FeSO4·7H2O 20mg/L,维生素B10.005g/L,维生素B120.005g/L。
3 结论与讨论
在裂殖壶菌发酵过程中,碳氮源对裂殖壶菌产DHA过高显著性的影响往往在培养基的优化中极易掩盖含量较少但作用较大的无机盐对裂殖壶菌产DHA的影响,因此本实验先通过碳氮源的单因素实验和正交实验确定最佳碳氮源配比,再用均匀设计实验优化无机盐组分,以避免培养基中高显著性的碳氮源对无机盐作用的掩盖。通过实验优化,不仅提高了裂殖壶菌产DHA的产量,而且明显降低了培养基成本;另外,在优化后的复合氮源中,酵母浸膏含量为5g/L,谷氨酸钠含量为20g/L,后者为发酵的主要氮源,且容易检测,在工业化的扩大培养中,即可通过检测谷氨酸钠的含量,来确定培养基中氮源残留含量。另据文献报道,限氮和低温有利于DHA的合成[12],Yokochi T等[13]发现随氮源浓度的降低Schizochytrium limacinum SR21总脂含量反而增加,在醋酸铵浓度低至1.2g/L时,油脂产量和DHA产量均可达到最大值,Chodchoey K等[14]发现Aurantiochytrium sp.在12℃可以合成很高含量的多不饱和脂肪酸(PUFA),当培养温度升高,DHA含量减少。因此在以后的研究中可结合限氮和低温工艺进行深一步的探讨。
[1]康晶,郑志永,詹晓北,等.氮源和溶氧限制对裂殖壶菌Schizochytrium limacinum SR21合成二十二碳六烯酸的影响[J].工业微生物,2013,43(2):58-63.
[2]Morita E,Kumon Y,Nakahara T,et al.Docosahexaenoic acid production and lipid-body formation in Schizochytrium limacinum SR21[J].Marine Biotechnology,2006,8(3):319-327.
[3]夏小乐,杨海麟,李宇佶,等.碳氮比对Schizochytrium sp. JN-3发酵产DHA的影响及其中试研究[J].安徽农业科学,2012,39(36):22201-22203.
[4]冯云,任路静,魏萍,等.微生物发酵产二十二碳六烯酸代谢机理的研究进展[J].生物工程学报,2010,26(9):1225-1231.
[5]Williams KW,Scott MM,Elmquist JK.From observation to experimentation:leptin action in the mediobasal hypothalamus[J]. The American Journal of Clinical Nutrition,2009,89(3):985S-990S.
[6]朱昱哲,王静凤,毛磊,等.高含量DHA/EPA甘油三酯鱼油改善脂肪肝大鼠脂质代谢作用的研究[J].营养学报,2013,35(4):332-337.
[7]林杰.裂殖壶菌粉碱热法破壁提取其胞内油脂[J].广州化工,2012,40(18):54-56.
[8]Simopoulos AP.Omega-3-Fatty-Acids in health and disease and in growth and development[J].The American Journal of Clinical Nutrition,1991,54(3):438-463.
[9]Dalgaard P.Qualitative and quantitative characterization of spoilage bacterium from packed fish[J].International Journal of Food Microbiology,1995,26(3):319-333
[10]Park EJ,Suh M,Clandinin MT.Dietary ganglioside and long-chain polyunsaturated fatty acids increase ganglioside GD3content and alter the phospholipid profile in neonatal rat retina [J].Invest Ophthalmol Vis Sci,2005,46(7):2571-2575.
[11]张明亮,江贤章,余清梅,等.高密度流加放大培养Schizochytrium sp.FJU-512生产DHA[J].药物生物技术,2013,20(1):34-38.
[12]刘静,高媛媛,江贤章,等.低温胁迫对裂殖壶菌DHA生物合成及SOD表达的影响[J].药物生物技术,2010,17(1):50-54.
[13]Chodchoey K,Verduyn C.Growth,fatty acid profile in major lipid classes and lipid fluidity of Aurantiochytrium mangrovei Sk-02 as a function of growth temperature[M].Braz J Microbiol,2012,43(1):187-192.
[14]Yokochi T,Honda D,Higashihara T,et al.Optimization of docosahexaenoic acid production by Schizochytrium limacinum SR21[J].App Microbiol and Biotech,1998,49(1):72-76.
Optimization of Schizochytrium sp.FJU-512 fermentation medium producing DHA
WANG Can1,ZHANG Wei2,ZHANG Ming-liang1,HUANG Jian-zhong1,*
(1.EngineeringResearchCenterofIndustrialMicrobiology,EngineeringResearchCenterofFujianModernFermentTechnology,Ministry of Education,School of Life Science,Fujian Normal University,Fuzhou 350108,China;2.School of Life Science,Fujian Normal University,Fuzhou 350108,China)
Taking the cost control and monitoring control into consideration,through single factor experiments,orthogonal experiment and homogeneous experiment,the fermentation medium of Schizochytrium sp.FJU-512 was optimized.Results indicated that the optimal fermentation medium formula of DHA production was:glucose 120g/L,yeast extract 5g/L,sodium glutamate 20g/L,ammonium sulfate 0.25g/L,sea crystal 25g/L,KH2PO44.0g/L,MgSO4·7H2O 0.5g/L,CaCO35.0g/L,Na2SO43.0g/L,FeSO4·7H2O 20mg/L,vitamin B10.005g/L,vitamin B120.005g/L. After optimization,the DHA production of Schizochytrium sp.FJU-512 reached 13.83g/L,which increased by 22%,and the cost was reduced by 40%or so.
Schizochytrium sp.;carbon and nitrogen sources;orthogonal experiment;fermentation medium;DHA
TS201.3
A
1002-0306(2015)04-0171-05
10.13386/j.issn1002-0306.2015.04.029
2014-05-12
王灿(1990-),男,硕士研究生,研究方向:微生物油脂。
黄建忠(1966-),男,博士,教授,研究方向:生物催化与生物合成。
福建省自然科学基金重大项目(2011H6007);福建省自然科学基金项目(2009J05057);福建省科技重大专项(2010NZ0001-4);福建省发改委产业化专项(闽财指[2010]358号)。

