Kiss-1高表达抑制结肠癌侵袭与转移能力的影响
,, ,
(1.南华大学附属第一医院消化内科,湖南 衡阳 421001;2.南华大学研究生院)
·基础医学·
Kiss-1高表达抑制结肠癌侵袭与转移能力的影响
刘迪群1*,温彩玲2,钟华1,周伟伟1
(1.南华大学附属第一医院消化内科,湖南 衡阳 421001;2.南华大学研究生院)
目的探讨Kiss-1高表达对结肠癌SW480细胞侵袭与转移能力的影响,初步明确Kiss-1基因对基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)和MMP-2表达的影响。方法用脂质体转染方法将质粒pEGFP-N1-Kiss-1及pEGFP-N1空载体质粒瞬时导入结肠癌SW480细胞,细胞随机分三组:空白对照组、阴性对照组、实验组。应用Transwell实验检测结肠癌细胞的侵袭能力、Western-blot和Real-time PCR分别从蛋白和mRNA水平检测Kiss-1表达对MMP-9、MMP-2表达的影响。结果成功将pEGFP-N1-Kiss-1重组质粒瞬时导入结肠癌SW480细胞。Transwell实验检测出实验组较阴性对照组和空白对照组能明显降低SW480细胞侵袭能力的作用(P<0.05)。Western blot和Real-time PCR检测出实验组Kiss-1 蛋白和mRNA表达水平较阴性对照组或空白对照组显著增加,而实验组MMP-9、MMP-2蛋白和mRNA表达水平显著降低,其差异均具有统计学意义(P<0.05)。结论Kiss-1抑制MMP-9和MMP-2的表达,其调控机制可能与抑制结肠癌的侵袭和转移能力有关。
结肠癌SW480细胞; Kiss-1; MMP-9; MMP-2; 侵袭; 转移
结肠癌是一种常见的消化道恶性肿瘤,在发达国家结肠癌患者死亡率位居恶性肿瘤第2位[1]。近年我国结肠癌发病率呈逐年上升趋势,目前结肠癌的主要治疗方法是外科手术,但仍有40%~50%的结肠癌患者术后会出现复发和转移[2]。肿瘤的侵袭和转移与蛋白酶有关,特别是肿瘤细胞分泌的基质金属蛋白酶(MMPs),其中MMP-9和MMP-2尤为重要[3]。Kiss-1基因被确定为人类一种新的转移抑制基因,通过显微细胞介导将人类6号染色体转移到人黑色素瘤细胞株C8161,其Kiss-1表达能显著抑制在裸鼠中成瘤的转移能力[4]。因此,本研究旨在体外瞬时转染Kiss-1高表达的结肠癌SW480细胞,拟探讨Kiss-1高表达对结肠癌SW480细胞侵袭与转移能力的影响,初步明确Kiss-1对MMP-9、MMP-2的表达影响,为结肠癌的发病机制和寻找新的治疗策略提供理论依据。
1 材料与方法
1.1主要材料结肠癌SW480细胞保存于南华大学附属第一医院临床研究所-80 ℃冰箱中;质粒pEGFP-N1-Kiss-1及空载体(pEGFP-N1)质粒由上海吉凯公司合成,均含有绿色荧光蛋白(GFP),经测序鉴定无误;脂质体转染试剂盒LipofectamineTM 2000购自美国 Invitrogen 公司;鼠抗人Kiss-1购自Millipore公司(原装进口);鼠抗人β-actin购自北京中杉金桥生物公司(国产),兔抗人MMP-9和MMP-2 购自武汉博士得公司(国产);总RNA提取试剂盒购自上海生工生物工程公司,RT-PCR 逆转录试剂盒和qPCR Master Mix购自BIONEER公司;引物均由上海生工生物公司合成,经DNA质谱检测无误。
1.2细胞培养及分组将结肠癌SW480细胞培养于10%新生牛血清的1 640培养基中,置于5%CO2、37 ℃培养箱中培养,当细胞生长达90%以上融合度时将其随机分为三组:空白对照组:未转染细胞组;阴性对照组:转染pEGFP-N1空载体细胞组;实验组:转染质粒pEGFP-N1-Kiss-1细胞组。
1.3实验方法
1.3.1 瞬时转染 取对数期生长细胞[5],以3×106个细胞/孔的密度铺于6孔板培养,当细胞融合度达70%时进行转染,用无血清1 640培养基将3.2 μg pEGFP-N1-Kiss-1质粒和8 μL Lipofectamine2000分别稀释至总体积为250 μL,室温下静置5 min,按照以上组合制备 lipofectamineTM2000- pEGFP-N1-Kiss-1混合物,在室温下孵育 20 min后,将混合物加入6孔板细胞中,用无血清1 640培养基定容至2 mL,在 37 ℃、5% CO2培养箱中孵化6 h后更换含10%新生牛血清的1 640培养基终止转染,转染48 h后在荧光显微镜下观察细胞,确定转染效率。阴性对照组转染方法同实验组。转染效率=(发出绿色荧光细胞数/可见光下的总细胞数) ×100%。
1.3.2 Transwell侵袭实验 将有基质胶的transwell小室(Corning,美国,8.0 μm孔径)置入无菌的 24 孔培养板中。再取已做好转染的实验组、阴性对照组及空白对照组细胞,用胰酶消化细胞,用无血清1 640培养基悬浮、计数,稀释至密度为 1×106/mL,每个上室中分别加入200 μL细胞悬液,24 孔板每个下室加入 600 μL含有 30%新生牛血清的1 640培养基。置于37 ℃、5% CO2培养箱中继续培养,待培养48 h后弃去孔中旧培养液,PBS清洗 2 遍,用4%甲醛500 μL/孔加入下室进行固定30 min,用棉签轻轻擦掉上层未迁移细胞,再用1%结晶紫500 μL染色20 min,用清水洗3遍以上,最后在400倍显微镜下随机观察五个视野并计每个视野内穿透小室微孔膜的细胞数,计算平均侵袭细胞数和侵袭抑制率。侵袭抑制率(IR)的公式为:IR(%)=(空白对照组穿膜数-实验组穿膜数)/对照组穿膜细胞数×100%。
1.3.3 Real-time PCR Kiss-1、MMP-9、MMP-2和GADPH引物均由上海生工生物技术有限公司合成,引物序列见表1。按照总RNA提取试剂盒操作步骤提取已做好转染的实验组和阴性对照组细胞的总RNA,检测其吸光度(OD260/OD280)值和浓度;按AccuPower®RocketScriptTM RT MasterMix试剂盒,将总RNA反转录生成cDNA,反转录条件为:引物退火 37 ℃ 1 min;CDNA合成(反转录反应) 42 ℃ 60 min;灭活(反转录酶的失活反应) 95 ℃ 5 min;最后将cDNA按2X GreenstarTM qPCR Master Mix试剂盒进行PCR扩增反应,每组设三个复孔,反应程序为:预变性,95 ℃ 5 min;PCR反应,95 ℃ 5 s;60 ℃ 30 s,51个循环。PCR反应结束后采用溶解曲线确定产物特异性,以2-△△CT值表示目的基因的相对表达量,以GADPH作为内参;△△CT =实验组目的基因的△CT值-阴性对照组目的基因的△CT值,实验结果均为3次独立重复实验。
表1Kiss-1、MMP-9、MMP-2和GADPH的引物序列

名称引物序列(5'→3')Kiss-1F:CACCCTCTGGACATTCACCR:CAGTAGCTGCCAAGAAACCAMMP-9F:CAGTCCACCCTTGTGCTCTTR:ACTCTCCACGCATCTCTGCMMP-2F:AGTTTCCATTCCGCTTCCAGR:CGGTCGTAGTCCTCAGTGGTGADPHF:AGAAGGCTGGGGCTCATTTGR:AGGGGCCATCCACAGTCTTC
1.3.4 Western-blot 分别提取已做好转染的空白对照组、阴性对照组及实验组中SW480细胞总蛋白,采用BCA试剂盒测定各组样本蛋白浓度,用10%和15%聚丙烯酰胺凝胶电泳,半干转法转移至聚偏二氟乙烯膜(poly vinylidene fluoride,PVDF膜)后,用5%封闭液(TBST中含5%脱脂奶)室温封闭2 h,再依次孵育对应一抗及二抗,最后利用凝胶成像系统(配备有软件BIO-ID)采集图像,采用AlphaImager2200凝胶图像系统对图片进行灰度值扫描,最后采用GraphPad Prism软件进行制图。实验重复3次,分别检测Kiss-1、MMP-9和MMP-2蛋白的表达。
1.4统计学分析方法应用SPSS19.0 进行统计分析,计量资料用均数+标准差表示,采用单因素方差分析比较两组间的差异,P<0.05为差异具有统计学意义。
2 结 果
2.1 pEGFP-N1-Kiss-1质粒转染至结肠癌SW480细胞的转染效率pEGFP-N1-Kiss-1质粒转染48 h后,在荧光显微镜下观察细胞,转染效率达90%以上(图1)。
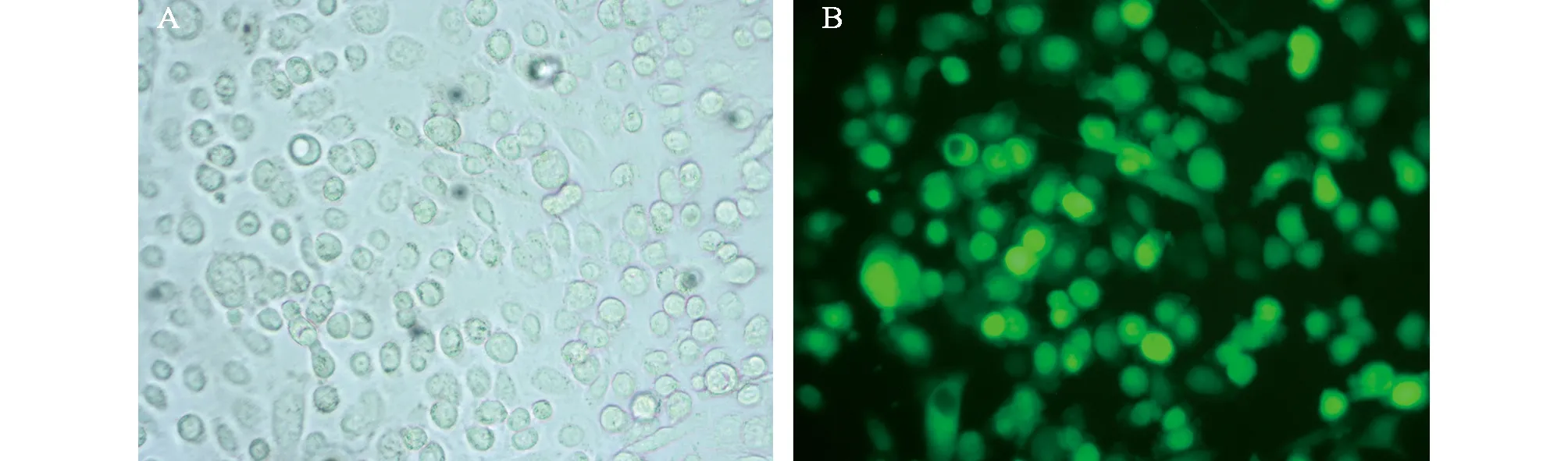
图1 pEGFP-N1-Kiss-1质粒转染至SW480细胞48h后绿色荧光蛋白的表达(400×) A:正常;B:荧光
2.2 Transwell检测Kiss-1对结肠癌SW480细胞侵袭的影响三组结肠癌SW480细胞侵袭实验结果见表2和图2。实验组侵袭细胞数(14.50±3.88)显著低于阴性对照组(19.22±4.87)及空白对照组(21.12±5.12)SW480细胞侵袭数(P<0.05)。实验组侵袭抑制率显著高于阴性对照组(P<0.05)。Kiss-1能明显降低结肠癌SW480细胞的侵袭能力。
表2Transwell检测Kiss-1对三组结肠癌SW480细胞侵袭的影响(n=3)
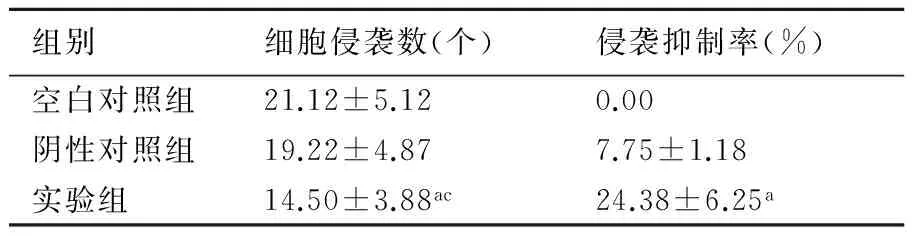
组别细胞侵袭数(个)侵袭抑制率(%)空白对照组21.12±5.120.00阴性对照组19.22±4.877.75±1.18实验组14.50±3.88ac24.38±6.25a
与阴性对照组比较,a:P<0.05;与空白对照组比较,c:P<0.05
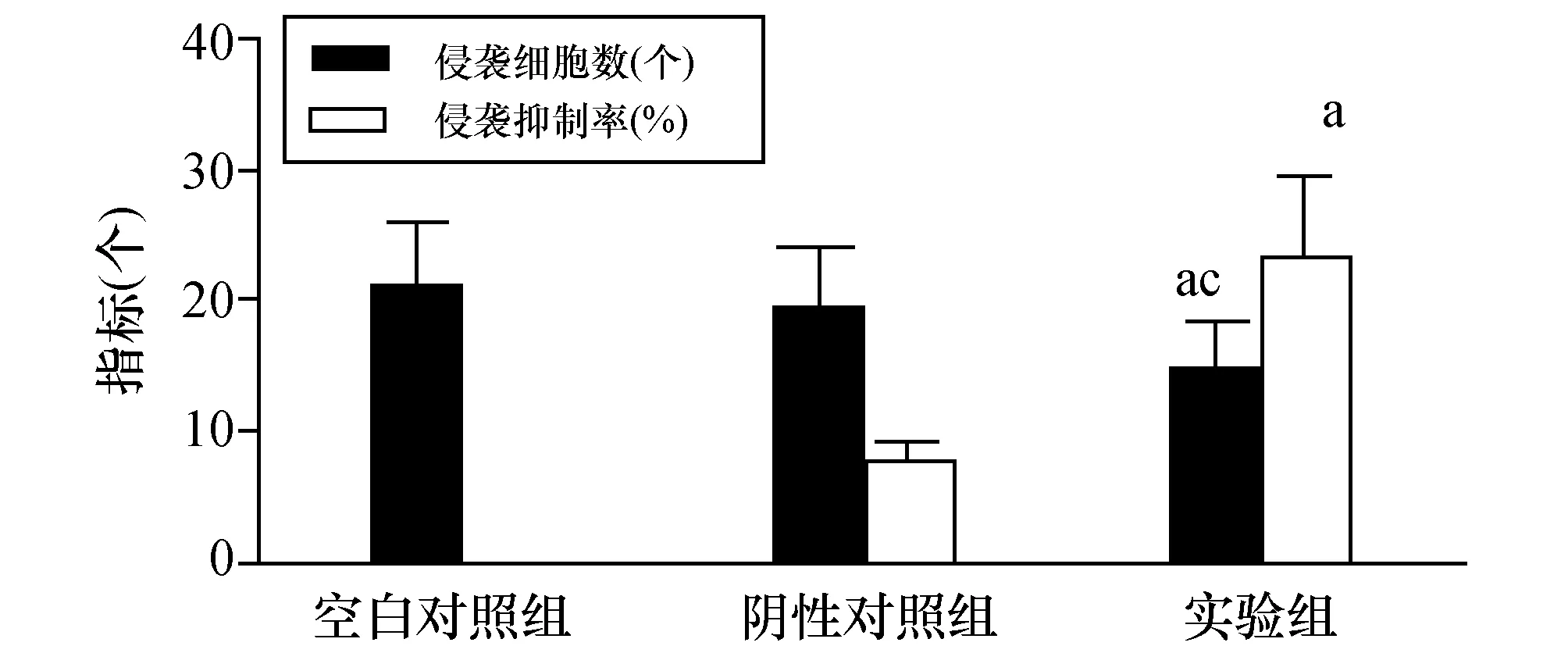
图2 Transwell检测Kiss-1对三组结肠癌SW480细胞侵袭的影响 与阴性对照组比较,a:P<0.05;与空白对照组比较,c:P<0.05
2.3 Real-time PCR检测Kiss-1、 MMP-9和MMP-2在结肠癌SW480细胞中mRNA相对表达量阴性对照组和实验组细胞Kiss-1、 MMP-9和MMP-2mRNA相对表达量结果如图3所示。实验组中Kiss-1mRNA高表达,而MMP-9和MMP-2mRNA的表达水平显著降低,两组比较差异均具有统计学意义(P<0.05)。Kiss-1高表达可抑制MMP-9、MMP-2的表达。
2.4 Western-blot检测Kiss-1、 MMP-9和MMP-2在SW480细胞中蛋白的表达三组SW480细胞中Kiss-1、 MMP-9和MMP-2蛋白的表达结果如图4所示。结果显示: Kiss-1蛋白在实验组中高表达,而在阴性对照组与空白对照组中低表达,三组比较差异具有统计学意义(P<0.05)。MMP-9和MMP-2蛋白在实验组中表达水平明显低于阴性对照组(P<0.05)和空白对照组(P<0.05)。Kiss-1高表达可抑制MMP-9、MMP-2的表达。
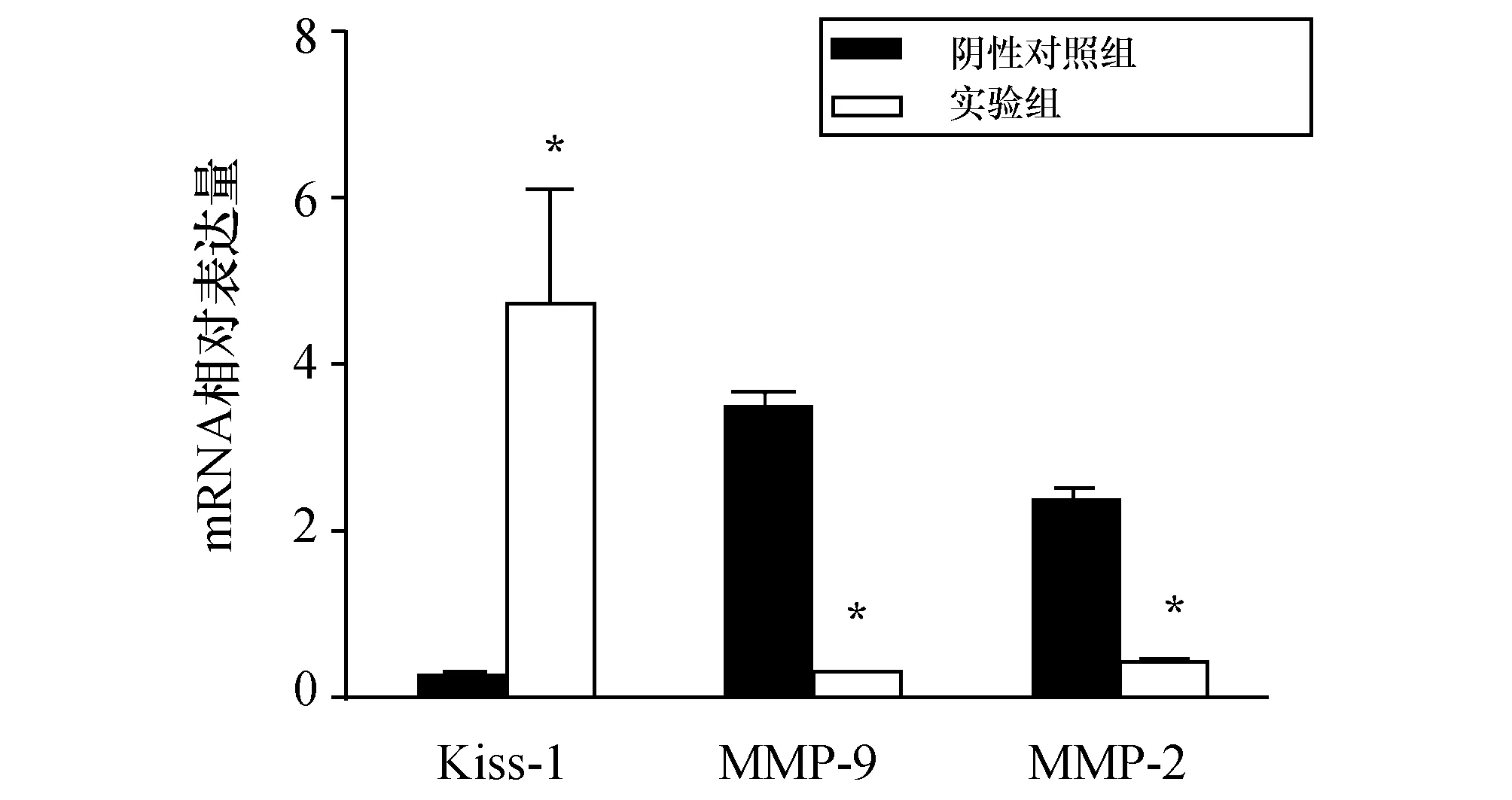
图3 Real-time PCR检测Kiss-1、 MMP-9和MMP-2在结肠癌SW480细胞中mRNA相对表达量 与阴性对照组比较,*:P<0.05
3 讨 论
绝大多数中晚期肿瘤患者预后与是否发生远处转移呈正相关,转移是一个多步骤过程并涉及复杂的肿瘤细胞与宿主细胞间的相互作用[6]。当肿瘤发生发展时可激活MMP-9和MMP-2形成IV型胶原、V型胶原和明胶 ,在细胞外基质(extracellular matrix,ECM)的降解和再塑造中发挥重要作用,并可使肿瘤细胞沿着缺失的基底膜向周围组织产生浸润,从而引起肿瘤发生侵袭和转移[3]。因此,越来越多的研究热点是如何抑制转移性肿瘤的进展。早有研究发现,在多种已发生转移的肿瘤中Kiss-1呈低表达,如胃癌、乳腺癌、鼻咽癌[5,7-8],这表明Kiss-1作为转移抑制基因及其受体的缺失可能与人类肿瘤的进展和转移密切相关。目前Kiss-1基因的抑制机制至今尚未清楚。早有报道说Kiss-1基因抑制转移的机制可能与细胞外调控ERK磷酸化及诱导胞质IkBα降解胞浆中p65/p60含量,进而使MMP-2和MMP-9表达减少有关[9-10]。而最近Ji等[11]在大肠癌中研究发现Kiss-1通过抑制ERK磷酸化途径而不是JNK途径,最终促使NF-kB降解使MMP-9活性下降,这将对于抑制肿瘤转移具有重大作用。除此之外,实验数据报道Kiss-1可明显抑制大肠癌HT115细胞系的侵袭和迁移能力,并且临床队列研究的初步数据也支持这一论点。同时也不乏学者研究大肠癌组织中发现Kiss-1甲基化和蛋白表达对于诊断和判断预后有重要意义[11]。本次研究发现Kiss-1可显著降低结肠癌SW480细胞的侵袭能力,关键是实验数据表明Kiss-1与MMP-9、MMP-2在蛋白和mRNA表达水平均呈显著负相关,这与以往研究的相关结论一致。因此笔者考虑:在结肠癌发病过程中,Kiss-1促使MMP-9和MMP-2基因发生紊乱、酶原产生增加、降解肿瘤细胞基膜的IV型胶原、层黏连蛋白等成分和破坏基底膜的完整性,最终促进肿瘤的发展。由此推测Kiss-1抑制MMP-9和MMP-2的表达,其调控机制可能与抑制结肠癌的侵袭和转移能力有关。
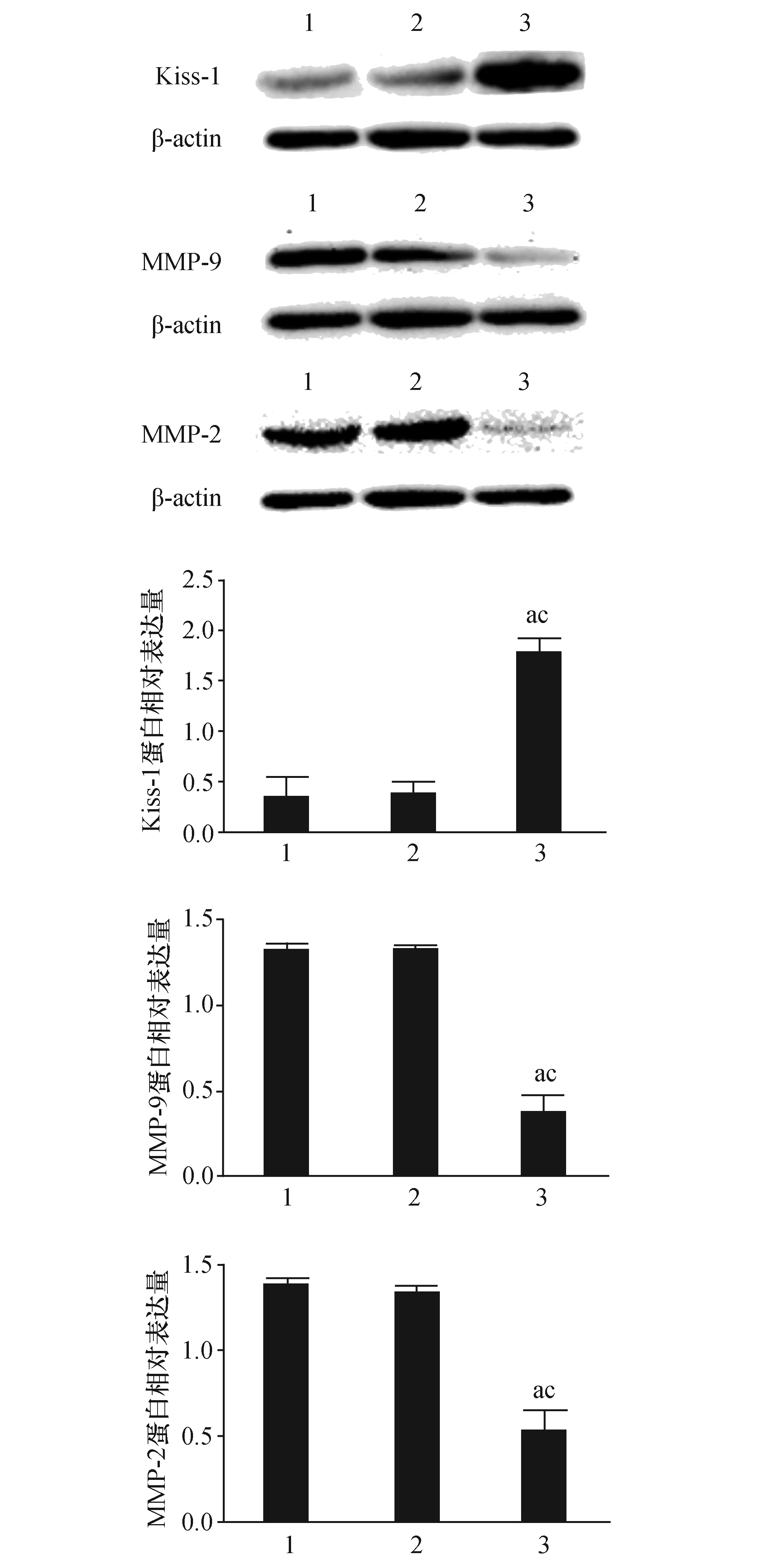
图4 Western-blot检测Kiss-1、 MMP-9和MMP-2在3组结肠癌SW480细胞蛋白的表达 1:空白对照组;2:阴性对照组;3:实验组 与空白对照组比较,a:P<0.05;与阴性对照组比较,c:P<0.05
综上所述,Kiss-1 基因的高表达与抑制结肠癌的侵袭和转移能力的形成密切相关,可能通过抑制MMP-9和MMP-2的表达而抑制结肠癌的侵袭和转移能力的形成。因此,深入研究 Kiss-1 基因表达的调控机制及抑制肿瘤转移的机制将为结肠癌患者的治疗开辟一条新的途径。
[1] Delavari A,Bishehsari F,Salimzadeh H,et al.Adenoma detection rates in an opportunistic screening colonoscopy program in Iran,a country with rising colorectal cancer incidence[J].BMC gastroenterology,2014,14(1):196.
[2] 王志强,徐瑞华.结肠癌术后辅助化疗新进展[C].第四届中国肿瘤内科大会论文集,北京,2010:98-101.
[3] Radenkovic S,Konjevic G,Jurisic V,et al.Values of MMP-2 and MMP-9 in tumor tissue of basal-like breast cancer patients[J].Cell Biochem Biophys,2014,68(1):143-152.
[4] Lee JH,Miele ME,Hicks DJ,et al.KiSS-1,a novel human malignant melanoma metastasis-suppressor gene[J].J Natl Cancer Inst,1996,88(23):1731-1737.
[5] Li N,Wang HX,Zhang J,et al.KISS-1 inhibits the proliferation and invasion of gastric carcinoma cells[J].World J Gastroenterol,2012,18(15):1827-1833.
[6] Sakthivel KM,Prabhu VV,Guruvayoorappan C.WAVEs:a novel and promising weapon in the cancer therapy tool box[J].Asian Pac J Cancer Prev,2012,13(5):1719-1722.
[7] Sun PH,Ye L,Mason MD,et al.Protein tyrosine phosphatase micro (PTP micro or PTPRM),a negative regulator of proliferation and invasion of breast cancer cells,is associated with disease prognosis[J].PloS one,2012,7(11):e50183.
[8] Yuan TZ,Zhang HH,Tang QF,et al.Prognostic value of kisspeptin expression in nasopharyngeal carcinoma[J].Laryngoscope,2014,124(5):E167-174.
[9] Yan C,Wang H,Boyd DD.KiSS-1 represses 92-kDa type IV collagenase expression by down-regulating NF-kappa B binding to the promoter as a consequence of Ikappa Balpha -induced block of p65/p50 nuclear translocation[J].J Biol Chem,2001,276(2):1164-1172.
[10] Yoshioka K,Ohno Y,Horiguchi Y,et al.Effects of a KiSS-1 peptide,a metastasis suppressor gene,on the invasive ability of renal cell carcinoma cells through a modulation of a matrix metalloproteinase 2 expression[J].Life Sci,2008,83(9-10):332-338.
[11] Ji K,Ye L,Ruge F,et al.Implication of metastasis suppressor gene,Kiss-1 and its receptor Kiss-1R in colorectal cancer[J].BMC Cancer,2014,14:723.
TheEffectofKiss-1HighExpressionOnInhibitingInvasionandMetastasisofColonCancer
LIU Diqun,WEN Cailing,ZHONG Hua,et al
(DepartmentofGastroenterology,theFirstAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo explore the effect of Kiss-1 high expression on invasion and metastasis of the colon cancer SW480 cells.To preliminarily define the influence of kiss-1 genes to the expressions of matrix metalloproteinase-9(MMP-9) and MMP-2.MethodsTo guide plasmids pEGFP-N1-Kiss-1 and pEGFP-N1 into the colon cancer SW480 sells instantly with the method of lipofectin transfection.Divide cells into three groups:the blank control group with no transfection cell,the negative group with transfection of the empty pEGFP-N1 cell,the experimental group with transfection of plasmid pEGFP-N1-Kiss-1 cell and up-regulation Kiss-1 expression level in colon cancer cells.Applicate Transwell experiment to detect the invasion ability of the colon cancer cells.Western blot and Real-time PCR,respectively from protein and the level of mRNA,were used to detect the influence of Kiss-1 expression to the expressions of MMP-9 and MMP-2.ResultsSuccessfully guided pEGFP-N1-Kiss-1 recombinant plasmid into the colon cancer SW480 sells.Transwell experiments detected that the experimental group,compared with the negative control group and the blank control group,can obviously reduce SW480 cells invasion ability (P<0.05).Western blot and Real-time PCR detected that the experimental group Kiss-1 protein and mRNA expression level increased significantly,while MMP-9,MMP-2 protein and mRNA expression level decreased significantly,compared with negative control group or blank control group,the differences were statistically significant (P<0.05).ConclusionKiss-1 can inhibit the expressions of MMP-9 and MMP-2.Its regulatory mechanism may be related to its inhibition to the invasion and metastasis ability of colon cancer.
SW480 colon cancer cells; Kiss-1; MMP-9; MMP-2; invasion; metastasis
10.15972/j.cnki.43-1509/r.2015.05.007
2015-05-11;
2015-07-29
湖南省教育厅一般项目(11C1107).
*通讯作者,E-mail:lixiaoyush@163.com.
R735.35
A
(此文编辑:蒋湘莲)
——一道江苏高考题的奥秘解读和拓展

