CGRP通过抑制p38MAPK/ NOX4通路保护氧化应激诱导的血管内皮细胞损伤
,,,,,,*
(1.南华大学附属第二医院心血管内科 湖南 衡阳 421001;2.广东省第二人民医院药物临床试验基地;3.南华大学 湖南省分子靶标新药研究协同创新中心)
·基础医学·
CGRP通过抑制p38MAPK/ NOX4通路保护氧化应激诱导的血管内皮细胞损伤
欧奇林1,曾泗宇2,骆竞妃3,彭虹艳3,洪陈亮3,曾高峰1,秦旭平3*
(1.南华大学附属第二医院心血管内科 湖南 衡阳 421001;2.广东省第二人民医院药物临床试验基地;3.南华大学 湖南省分子靶标新药研究协同创新中心)
目的观察降钙素基因相关肽(CGRP)对氧化应激损伤血管内皮细胞的保护作用及其对p38 MAPK/NOX4信号通路的抑制作用。方法体外培养人脐静脉内皮细胞株(HUVECs),外源性给予过氧化氢(H2O2)或血管紧张素Ⅱ(Ang Ⅱ)作为氧化刺激因素,CGRP作为保护剂处理细胞。噻唑蓝比色法(MTT)观察HUVECs活力;流式细胞仪(FCM)观察分析HUVECs增殖指数的改变; Western Blot和Real-time PCR分别检测p38 MAPK、NADPH氧化酶4 (NOX4)蛋白和mRNA的表达。结果500 μmol/L H2O2或100 nmol/L AngⅡ能浓度依赖性地降低HUVECs活力和增殖指数(PI);CGRP可以显著增加HUVECs活力和及其PI。同时,H2O2、AngⅡ均能诱导p38 MAPK磷酸化,并能上调NOX4蛋白和mRNA表达,p38 MAPK阻断剂能部分增强CGRP抑制AngⅡ或H2O2诱导的NOX4的表达。结论CGRP对内外源性的氧化应激损伤HUVECs的保护机制可能与抑制p38 MAPK/NOX4信号通路有关。
降钙素基因相关肽; 氧化应激; 内皮细胞; NADPH氧化酶4
血管内皮损伤及其功能紊乱是引起心血管疾病发生发展的起始事件[1]。探讨内皮损伤的病理过程对治疗各种心血管疾病具有重要意义。活性氧(ROS)主要包括羟基自由基(-OH)、过氧化氢(H2O2)、超氧阴离子(-O2-)、单线态氧(1O2)等。近年研究表明ROS在内皮损伤中的作用不容忽视。多种细胞生长因子,如血管紧张素Ⅱ (AngⅡ)[2],血小板源性生长因子(PDGF)[3]能通过激发内源性的ROS损伤血管内皮细胞。研究明确烟酞胺腺嘌呤二核苷酸磷酸(nicotinamide-adenine dinucleotide phosphate,NADPH)氧化酶,简称NADPH氧化酶(NADPH oxidase,Nox)是血管内生成ROS的主要酶体[4]。有证据证明,NOX4在内皮细胞中的表达显著高于其它Nox成员,研究数据证实NOX4对内皮氧化还原反应发挥关键作用,并对内皮细胞生理有重要的功能性调节作用[5]。降钙素基因相关肽(CGRP)是目前已知的最强舒张血管的神经多肽,其舒张血管作用与保护内皮细胞功能相关[6]。本研究拟证明,CGRP通过对抗内外源性氧化应激保护内皮细胞功能的机制,为阐明CGRP的生理功能提供实验依据。
1 材料与方法
1.1主要材料与试剂人脐静脉内皮细胞株 (HUVECs)(Catalog Number:C-003-5C) 购自上海拜力生物技术公司。CGRP、AngⅡ(Sigma公司)、β-actin多克隆抗体(长沙艾杰生物技术有限公司)、NOX4多克隆一抗(Santa Cruze公司),P38 MAPK/P-p38 MAPK兔源单克隆抗体(cell signaling technology公司);辣根过氧化物酶(HRP)标记的羊抗兔或二抗(Santa Cruze公司);Real-time quantative PCR试剂盒(广州东盛生物技术有限公司);优质胎牛血清(杭州四季青公司)。
1.2 HUVECs培养HUVEC接种于含10%胎牛血清、100 U/mL青霉素和10 μg/mL链霉素的DMEM培养基中,置于37 ℃、5%的CO2的培养箱内培养。细胞用0.25%的胰酶消化传代,取长势良好的细胞用于实验。
1.3 MTT法检测细胞的活力将HUVECs在DMEM培养基制成单个细胞悬液,以每孔2×103个细胞接种于96孔培养板中,并放入37 ℃、5%CO2培养箱中培养,待细胞长到50%融合时更换含0.1%血清的DMEM培养基(每孔180 μL)同步化24 h,之后分别按实验要求分组处理。①对照组(0.1%血清的DMEM培养),实验组在此基础上分别加入H2O2、AngⅡ或 CGRP处理;观察CGRP保护作用时,CGRP预处理30 min后再加 H2O2或AngⅡ处理24 h。随后在培养板中加入10× MTT 20 μL/孔,继续培养4 h,弃去培养基,加入200 μLDMSO,37 ℃孵育10 min,酶联免疫检测仪测定在波长为570 nm时的光密度值(OD570)。
1.4流式细胞术检测细胞周期和增殖将100 mL细胞培养瓶中的HUVEC用含0.1%血清的DMEM培养基同步化24 h,后按要求(见方法1.3)处理细胞。随后收集细胞,PBS清洗一遍,弃上清,每组用1 mL 75%乙醇固定。样品寄至北京中国中医科学院基础理论研究所检测。
1.5 Western Blot检测蛋白表达按实验要求(见方法1.3)处理细胞,按照细胞浆/核/膜/结构蛋白抽屉试剂盒步骤提取细胞蛋白。按照BCA试剂盒说明用酶联免疫检测仪检测OD570计算蛋白含量。将提取的细胞总蛋白的上样缓冲液100 ℃煮5 min后冰浴,配制10%分离胶和5%积层胶,灌1.5 mm板,100 V电压跑过积层胶后,换160 V电压跑分离胶,将电泳总时间控制在90 min之内。然后转膜、丽春红染色观察蛋白质转移情况。5%脱脂牛奶室温封闭1 h,1∶1000加入p38 MAPK、NOX4和β-actin等一抗,4 ℃孵育过夜,TBST洗涤15 min,每5 min换液1次。1 ∶2 000加入辣根过氧化物酶标记的山羊抗兔二抗、山羊抗鼠二抗,37 ℃孵育45 min,TBST洗涤45 min,每15 min换液1次。然后在暗室中滴加化学发光试剂激发荧光,压片,然后显影、定影。图片用AlphaImager2200进行灰度扫描。
1.6 RT-PCR检测NOX4 mRNA表达NOX4和GAPDH引物由艾杰生物公司设计,并由北京三博远志生物公司合成。NOX4正义链:AACTTATGTTCCCTGGCTATC,反义链:TCTTGAACTCTGACCTCGT;GAPDH正义链:CTGCACCACCAACTGCTTAG,反义链:AGGTCCACCACTGACACGTT。
细胞按实验要求处理后,提取总RNA并合成cDNA。-20 ℃长期保存。在八联管中依次加入:第一链cDNA1μL、引物2 μL,2×SYBR Green qPCR Mix 15 μL,ddH2O补至25 μL。荧光PCR仪上按以下步骤进行:94 ℃预变性5 min,94 ℃变性45 s、NOX4和GAPDH 50 ℃退火延伸共1 min,40个循环。最后72 ℃终延伸10 min。55 ℃到95 ℃之间每0.5 ℃为一个梯度,每个梯度延续10 s,测定引物的融解曲线。统计Ct值,根据2-ΔΔCt法表示相对定量结果。以GAPDH作为内参,根据公式ΔCt=[Ct(NOX4)]-[Ct(GAPDH)]、ΔΔCt=[ΔCt(实验组)-ΔCt(对照组)],2-ΔΔCt表示实验组NOX4相对于对照组原始拷贝数的倍数差异。

2 结 果
2.1 CGRP逆转Ang Ⅱ或H2O2对HUVECs生长的抑制作用根据本组前期研究结果和本次结果可以看出,CGRP能剂量依赖性增加HUVECs活力(图1A),Ang Ⅱ或H2O2剂量依赖性地降低HUVECs活力(图1B,1C)。按照保护或损伤有明细差异的原则,我们选择处理细胞的剂量分别是: CGRP 100 nmol/L、H2O2500 μmol/L、Ang Ⅱ 100 nmol/L;给予CGRP分别预处理HUVEC 30 min,如图1D所示,CGRP能使Ang Ⅱ 或H2O2损伤的HUVEC活力增加,说明CGRP具有明显的抗氧化作用。另外,从流式细胞仪结果(表1)看,CGRP具有明显的促进内皮细胞增殖,并对抗Ang Ⅱ 或H2O2对HUVECs的抑制增殖或损伤作用。

图1 CGRP对Ang Ⅱ或H2O2 抑制HUVECs生长作用的影响 A、B、C 分别为 CGRP 、H2O2、Ang Ⅱ对细胞作用的量—效关系,D:CGRP(100 nmol/L) 预处理对Ang Ⅱ(100 nmol/L)或H2O2(500 μmol/L)损伤细胞的保护作用。与对照组(Control)比较,*:P<0.05,**:P<0.01;与AngⅡ比较,#:P<0.05;与 H2O2比较 +:P<0.05,(n=3)
2.2 H2O2,Ang Ⅱ通过P38 MAPK磷酸化诱导NOX4表达为了观察Ang Ⅱ 或H2O2对氧化应激p38 MAPK信号通路的影响,用Ang Ⅱ (100 nmol/L) 或500 μmol/L H2O2以及SB 203580 (p38 MAPK磷酸化抑制剂)分别处理HUVECs 10 min,观察p38 MAPK磷酸化水平的变化。如图2所示,Ang Ⅱ 或H2O2能显著增加磷酸化p38 MAPK(p-p38 MAPK)表达(A)和NOX4的蛋白表达(B)水平,给予SB 203580后,p-p38 MAPK表达显著降低,同时,也降低了NOX4的蛋白表达。说明内源性(Ang Ⅱ)和外源性(H2O2)氧化应激均通过p38 MAPK信号通路发生作用。
2.3 CGRP对Ang Ⅱ (A)或H2O2对NOX4表达的影响如图3所示,与对照组相比,单独CGRPG1/G0:停留于G1/G0期(无增殖活动期)细胞的百分数;S:DNA合成期细胞的百分数;G2:DNA合成后期细胞的百分数;M:DNA分裂细胞的百分数.PI=(S+G2M)/(G1G0+S+G2M),与对照组(Control)a:P<0.01;与Ang Ⅱ 或H2O2比较,b:P<0.05
表1CGRP对ANGⅡ或H2O2引起的HUVECs周期分布的影响

组别G1/G0%S%G2/M%PI值%Control44.8±0.3543.9±0.2711.3±0.1155.2±0.35AngⅡ50.5±0.1542.6±0.427.1±0.4649.6±0.21aH2O251.0±2.640.6±2.2a8.4±0.846.8±0.45aCGRP+AngⅡ41.0±0.6147.6±0.83b11.4±0.3159.0±0.60bGRP+H2O240.8±4.245.6±4.1b10.0±1.261.1±1.3b
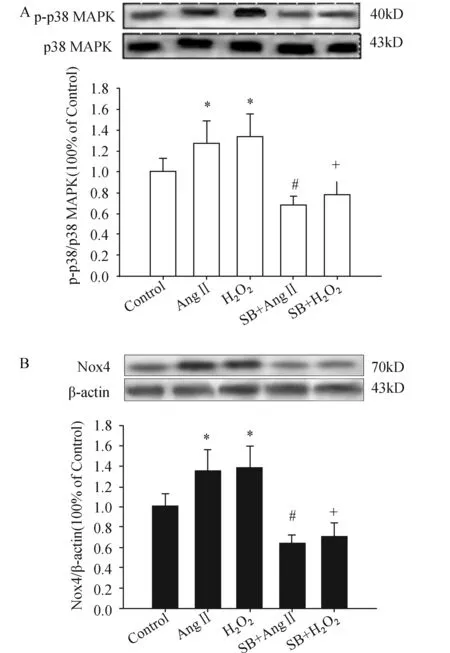
图2 抑制 p38MAPK磷酸化对AngⅡ或H2O2 诱导细胞内NOX4表达的影响 A:p38MAPK磷酸化蛋白表达,B:NOX4蛋白表达;SB:SB 203580(p38 MAPK磷酸化抑制剂);与对照组(Control)比较,*:P<0.05,与AngⅡ比较,#:P<0.01,与H2O2比较,+:P<0.01(n=3)
能明显降低NOX4蛋白(图3A)和mRNA(图3B)的表达,p38 MAPK磷酸化抑制剂SB203580能取消CGRP这种抑制作用,说明CGRP是通过p38 MAPK磷酸化诱导NOX4表达增加;给细胞预孵育CGRP 30 min,再给予Ang Ⅱ 或H2O2共培养细胞24 h。 与比对照组相比,NOX4表达并没有增加,且略有降低,结合图2B中Ang Ⅱ 及H2O2单独应用的结果,说明CGRP对Ang Ⅱ 或H2O2诱导的NOX4表达增加有抑制作用; CGRP加p38 MAPK磷酸化抑制剂SB203580共预孵育细胞30 min,并能进一步降低CGRP对Ang Ⅱ 或H2O2诱导的NOX4表达能力。说明CGRP对Ang Ⅱ 或H2O2诱导的NOX4表达的抑制作用可能部分通过p38 MAPK信号途径。

图3 CGRP对AngⅡ或H2O2诱导的NOX4表达影响 A:蛋白质表达;B:mRNA表达(n=3),SB:SB 203580是p38 MAPK磷酸化抑制剂;与对照组(Control)比较,*:P<0.05,与CGRP比较,#:P<0.05;与CGRP+Ang Ⅱ比较,+:P<0.01;与CGRP+H2O2比较,$:P<0.05(n=3)
3 讨 论
本研究发现,无论是外源性H2O2还是AngⅡ内源性刺激血管内皮细胞可能通过激活p38 MAPK磷酸化导致内源性氧化应激增加NOX4表达,导致内源性ROS增加并引起HUVEC损伤;CGRP保护HUVEC的机制可能与通过抑制p38 MAPK磷酸化水平、下调NOX4表达有关。

研究显示,MAPK家族中的p38 MAPK信号通路主要介导细胞氧化应激损伤[11]。本实验结果显示,H2O2和AngⅡ能显著升高磷酸化p38 MAPK及NOX4表达水平,可能是由于过多的AngⅡ和H2O2处理内皮细胞后引发p38 MAPK磷酸化使内源性ROS浓度升高,进而引起细胞损伤,降低内皮细胞增殖,甚至是细胞凋亡。100nmol/LCGRP干预后,能明显下调H2O2和AngⅡ引起的磷酸化p38 MAPK水平,且给予p38 MAPK磷酸化抑制剂SB203580能抑制H2O2和AngⅡ诱导的NOX4蛋白和mRNA的表达,提示CGRP可能不是直接作用于NOX4,而可能通过抑制p38 MAPK磷酸化进而抑制NOX4表达。
总之,本实验证明,在H2O2和AngⅡ诱导的HUVEC损伤过程中,NOX4呈激活状态,说明NOX4与HUVEC损伤密切相关,CGRP对HUVECs的保护作用也可能与下调p38 MAPK磷酸化和进而抑制NOX4表达有关。
[1] Kasprzak JD,Klosinska M,Drozdz J.Clinical aspects of assessment of endothelial function[J].Phamacol Rep,2006,58(Suppl):33-40.
[2] Griendling KK,Sorescu D,Lassègue B,et al.Modulation of protein kinase activity and gene expression by reactive oxygen species and their role in vascular physiology and pathophysiology[J].Arterioscler Thromb Vasc Biol,2000,20 (10):2175-2183.
[3] Sundaresan M,Zu-Xi Y,Ferrans VJ,et al.Requirement for generation of H2O2for platelet-derived growth factor signal transduction [J].Science,1995,270 (5234):296-299.
[4] Di Lisa F,Kaludercic N,Paolocci N.β2-Adrenoceptors,NADPH oxidase,ROS and p38 MAPK:another ‘radical’ road to heart failure[J].Br J Pharmacol,2011,162(5):1009-1011.
[5] Petry A,Djordjevic T,Weitnauer M,et al.NOX2 and NOX4 mediate proliferative response in endothelial cells[J].Antioxid Redox Signal,2006,8 (9-10):1473-1484.
[6] Chattergoon NN,D’Souza FM,Deng W,et al.The anti-proliferative effects of calcitonin generelated peptide in aortic and pulmonary artery smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2005,288 (1):L202-L211.
[7] Peng H,Li W,Seth DM,et al.(Pro)renin Receptor mediates both angiotensin Ⅱ dependent and -independent oxidative stress in neuronal cells [J].PLoS One,2013,8(3):e58339.
[8] Shi R,Hu C,Yuan Q,et al.Involvement of vascular peroxidase 1 in angiotensin Ⅱ-induced vascular smooth muscle cell proliferation[J].Cardiovasc Res,2011,91(1):27-36.
[9] Liu T1,Shen D,Xing S,et al.Attenuation of exogenous angiotensin Ⅱ stress-induced damage and apoptosis in human vascular endothelial cells via microRNA-155 expression[J].Int J Mol Med,2013,31(1):188-196.
[10] 朱怡,周孝钱,全海燕,等.Caveolae在CGRP保护人脐静脉内皮细胞中的作用及机制[J].中南医学科学杂志,2015,43(2):132-133.
[11] Guo RW,Yang LX,Li MQ,et al.Angiotensin Ⅱ induces NF-kappa B activation in HUVEC via the p38MAPK pathway[J].Peptides,2006,27(12):3269-3275.
Inhibitionofp38MAPK/NOX4SignalPathwayMediatestheProtectionofCGRPontheHUVECsInjuredbyOxidativeStress
OU Qilin,ZENG Siyu,LUO Jingfei,et al
(DepartmentofCardioMedicine,TheSecondAffiliatedHosptial,UniversityofSouthChina,Hengyang421001,Hunan,China)
ObjectiveTo study the protection of cacitonin gene-related peptide (CGRP) on human umbilical vein endothelial cells (HUVECs) injured by oxidative stress,and explore whether the mechanism involved in inhibition of p38MAPK/ NOX4 signal pathway.MethodsHUVECs cell line were cultured in vitro,angiotensin Ⅱ (AngⅡ) or hydrogen peroxide (H2O2) serves as the gent of oxidative stress,CGRP serves as the protection agent.MTT was used to test the viability of cells,distribution of cell cycles and proliferation of cells were observed by flow cytometry.The protein or mRNA expressions of the p38 MAPK、NADPH oxidase 4 (NOX4) was measured by Western blot or RT-PCR,respectively.RethodsCompared with control group,AngⅡ or H2O2decreased the cell viability and proliferation index (PI)dose-dependently,which were inhibited by 100 nmol/L CGRP;Meantime,the level of phosphated p38 MAPK was induced by AngⅡ or H2O2,and increased the expression of NOX4.Pretreatment with CGRP and SB 203580 can inhibit the up-regulation of NOX4 induced by AngⅡ or H2O2.ConclusionsThe protection of CGRP on the HUVECs injured by oxidative stress from in vitro(H2O2) or in vivo(AngⅡ) is related to inhibition of p38MAPK/ NOX4 signal pathway.
CGRP; oxidative stress; endothelial cell; NADPH Oxidase4
10.15972/j.cnki.43-1509/r.2015.04.004
2015-05-08;
2015-06-07
广东省医学基金,A2014159;分子靶标新药研究协同创新中心湘教通(2014)405号.
*通讯作者,E-mail:qinxuping@sohu.com.
R54
A
(此文编辑:秦旭平)

