TGA转录因子在植物氧化胁迫应答中的调控作用
罗秀云,李园园,周 赓,田 云,卢向阳
(1.湖南农业大学生物科学技术学院,湖南长沙410128;2.湖南省农业生物工程研究所,湖南长沙410128)
植物体内各组织器官(如根、茎、叶、花、果)时刻都在发生生理代谢,在代谢过程中会产生活性氧(ROS)。环境胁迫(如干旱、低温、高温、盐害、外源H2O2等)会导致植物体内积累大量的ROS,破坏机体内ROS氧化还原的平衡,从而产生氧化胁迫。氧化胁迫会使植物体内ROS的清除能力减弱,造成植物伤害甚至死亡[1-2],在很大程度上影响植物的生长发育、作物品质和产量[3]。
目前,氧化胁迫的研究主要集中在两方面:一是病毒、微生物引起的植物机体抗氧化应答机理;二是外源H2O2和光照等条件诱导产生的植物抗氧化调控[4]。ROS是氧化胁迫研究的关键信号分子,主要存在于线粒体、内质网等膜系统中,植物体内清除过量的ROS途径主要有两类:抗氧化酶系统(NADPH 酶、脂氧合酶等)和抗氧化剂(GSH、Vc等)[5]。此外,植物机体内ROS的信号转导途径易受机体自身激素的影响[6]。在植物ROS信号途径中,硫基类蛋白,尤其是半胱氨酸蛋白对ROS的信号转导途径起关键作用。目前,在ROS信号转导途径的研究中,主要有NPR1/TGA 和Rap2.4两类关键蛋白[7]。作者主要综述了植物TGA转录因子的分类、结构和作用,重点介绍了TGA 转录因子在植物ROS应答途径中的调控作用。
1 植物TGA转录因子
转录因子是由DNA 结合结构域和转录激活结构域构成的能与DNA 分子相互作用的蛋白质,根据DNA 结合位点的不同可分为多类,如bZIP 类转录因子、MYC类转录因子等[8]。植物TGA 转录因子是能够识别TGACGT 特异性结合序列且含有一个典型的锌指结构域和2个谷氨酰胺转录激活位点的一类转录因子,属于bZIP 转录因子家族中的一个亚家族。TGA 转录因子中锌指结构域是螺旋-旋转-螺旋类的DNA 结构域,且在DNA 结构域的C 端含有一个亮氨酸拉链和碱性结构的二聚体,此外,其谷氨酰胺激活结构域是一类酸性转录激活域。
1.1 植物TGA转录因子的分类与结构
1989年,利用花椰菜花叶病毒(CaMV)35S 启动子,首次在烟草中发现了TGA1a转录因子并确定其能识别TGACGT 特异性结合序列[9]。之后在水稻、拟南芥中陆续发现了TGA 转录因子。
根据TGA 转录因子的结构差异,植物TGA 转录因子可分为6 类:TGA1a、TGAⅠ、TGAⅡ、TGAⅢ、TGAⅣ、TGAⅤ,见表1。
根据植物TGA 转录因子的DNA 结构域和转录激活域的结构特征,可明显地比较这6类转录因子的结构异同[10],见图1。

表1 植物TGA转录因子的分类Tab.1 Classification of TGA transcription factors in plant
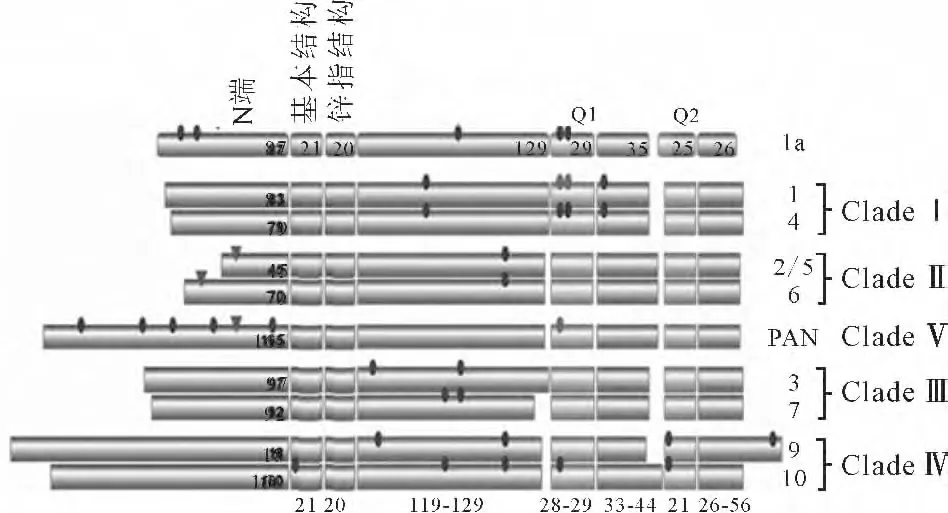
图1 植物TGA转录因子的结构Fig.1 Structures of TGA transcription factors in plant
有研究表明,在拟南芥中发现了10个TGA 转录因子,根据其结构的不同可以分为5类:TGAⅠ、TGAⅡ、TGAⅢ、TGAⅣ、TGAⅤ。其中TGAⅠ包括TGA1(At5g65210)和TGA4(At5g10030),其调控作用类似于烟 草 中 的 TGA1a;TGA Ⅱ 包 括 TGA2(At5g06950)、TGA5(At5g06960) 和 TGA6(At3g12250),相对其它类别而言,其DNA 结构域含有较短的N 端序列,是TGA 转录因子中研究最多的一类;TGA Ⅲ包括TGA3(At1g22070)和TGA7(At1g77920);TGAⅣ主要包括TGA9(At1g08320)和TGA10(At5g06830)[17];TGA Ⅴ 包 括 PAN(At1g68650)。
1.2 植物TGA 转录因子的作用
TGA 转录因子参与调节植物根系的生长、胁迫应答、开花调节等多种生理代谢过程。目前,主要通过拟南芥研究TGA 转录因子的功能,对水稻、烟草中TGA 转录因子的研究较少。
TGAⅠ类转录因子参与植物根系的生长调节。Alvarez等[18]利用免疫共沉淀及生物信息学分析法研究了拟南芥中TGA1和TGA4转录因子,结果表明,TGAⅠ作为关键调节因子参与拟南芥根系中硝酸盐的调节。
TGAⅡ类转录因子参与植物胁迫的应答。Stotz等[19]研究表明,拟南芥TGA2转录因子参与环境胁迫诱导的氧化胁迫途径及ROS的氧化还原调控途径,恢复植物生长发育,避免外界不利条件对植物产生影响。此外,丁香假单胞菌会侵染拟南芥,产生生物胁迫,激活机体内细胞分裂素途径,促使TGA3 转录因子与ARR2互作形成复合物启动pr1基因表达,从而调节拟南芥的生长发育[14]。
2 植物ROS应答途径
氧化胁迫信号转导的关键是植物机体内ROS的氧化还原途径,植物TGA 转录因子因其螺旋-折叠-螺旋的DNA 结构域,通过特异性识别并结合TGACGT序列而参与氧化胁迫[20]。Chen等[21]报道了as-1 顺式元件能结合bZIP 类转录因子PIF1/PIF3与HY5/HYH 互作的复合物,激活ROS 相关基因的表达,调控ROS应答途径。作为ROS应答途径的关键调节蛋白as-1顺式元件与TGAⅠ、TGAⅡ转录因子相互作用,激活ROS 相关基因的表达,调节机体内ROS 水平,使ROS达到氧化还原平衡状态,从而恢复植物的正常生长发育[12]。ROS的氧化还原途径主要有两条:一条是活性电子物质(RES)途径,另一条是茉莉酸(JA)途径,见图2。
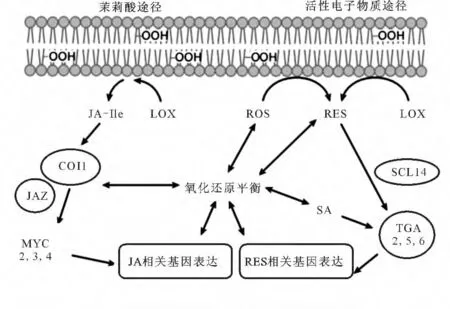
图2 植物ROS的调控过程Fig.2 Regulation process of ROS in plant
2.1 TGA转录因子通过介导RES途径调控植物体内ROS水平
植物抗氧化实质是植物机体中光系统控制植物ROS的去氧化过程,且ROS主要通过植物光合作用产生[22]。当植物体内积累过量的ROS,就会打破机体内ROS的氧化还原平衡态,导致ROS 转变成RES,RES在SCL14蛋白的作用下,激活TGAⅡ类转录因子,启动RES相关基因的表达,调控ROS途径中产生的脂质胁迫,达到ROS 的氧化还原平衡态[12,23]。此外,在外源物质诱导产生的植物ROS 信号途径中,SCL14蛋白结合TGAⅡ类转录因子形成复合物TGA/SCL14后,与MYC2 转录因子相互作用,诱导Cyp81D11基因的表达,响应机体内脂质胁迫,达到ROS去氧化的目的[24]。
Rojas等[25]报道了光合作用中光反应会干扰植物光系统中氧化激发态,作为光反应中的关键酶乙二醛酶(GLO)催化乙醇酸产生ATP和H2O2[26-27]。H2O2是ROS的一种形态,当其浓度超过机体适宜浓度时,GLO 会抑制H2O2以达到植物正常生长的浓度。在烟草中,GLO 参与Pro/AurPto防御反应,使NADPH氧化成NADP+,促使TGA 转录因子和NPR1蛋白相互作用并识别TGACGT 特异性序列,激活pr1 基因表达,响应植物ROS途径[28]。在水稻信号转导途径中,谷氧还蛋白(GST)与GLO 互作形成复合物后,与TGA 转录因子相互作用,介导NPR-1的调节,此外,NH1/NH3蛋白通过与TGA 转录因子互作形成复合物后与阻遏调控蛋白NRR 结合,使植物获得氧化胁迫抗性[29]。
2.2 TGA 转录因子通过介导JA 途径调控植物体内ROS水平
植物响应氧化胁迫途径需依赖JA[30],其JA 信号转导途径与外源物质诱导机体内JA 信号转导途径类似[31]。目前,对植物体内JA 信号转导的机制尚不清楚,还需深入研究[32-33]。
在植物ROS途径中,茉莉酸-亮氨酸途径(JA-Ile)与RES途径具有协同作用,都能恢复机体内ROS的氧化还原平衡。脂氧合酶(LOX)能催化植物机体ROS去氧化,在LOX 的催化下,COI1与JAZ蛋白的复合物与MYC转录因子相互作用,激活JA 相关基因的表达,调控ROS 的氧化还原,恢复机体正常生长[34]。有研究表明,TGA 转录因子调控的JA/ET 途径与ROS 的去氧化过程息息相关,EINs 蛋白如EIN2、EIN3 在内质网中磷酸化后进入核内,激活GRX 与TGA2 相互作用,诱导ORA59、ERF1 的表达[13,35-36]。ORA59 会下调JA 的靶基因PDF1.2 和MYC2、MYC3、MYC4的表达[37-38],参与ROS的氧化还原过程。此外,NPR1 蛋白与TGA 转录因子(如TGA2、TGA3、TGA5、TGA6)相互作用,激活JA 相关基因的表达,参与ROS水平调控[39-40]。
2.3 TGA 转录因子通过SA 的参与调控植物体内ROS的水平
SA 作为阻遏因子不仅在植物机体内RES的去氧化途径中起拮抗作用,在JA 途径中亦然。有研究表明,机体内SA 阻遏TGA 转录因子与NPR1蛋白相互作用,弱化ROS去氧化相关基因的表达,抑制植物机体内ROS 氧化还原态的恢复,影响植物的生长发育[17]。
拟南芥中,用SA 处理野生植物和AtTTM 突变株,部分突变株获得SA 抗性,获得抗性的植物在胁迫应答中依赖SA、PAD4、NPR1 激活相关蛋白的合成[41-43]。无SA 诱导时,TGAⅢ类转录因子TGA3参与HopMⅠ的胁迫应答激活pr1基因的表达,参与调控植物ROS水平,减少胁迫对植物伤害[44-47]。
3 展望
植物转录因子调控作用的研究一直是生物学研究的热点。目前,主要从生物胁迫信号转导调控方面来研究植物TGA 转录因子,而对TGA 转录因子介导氧化胁迫调控的研究非常有限。TGA 转录因子中,研究较多的是TGAⅡ类转录因子,对其它TGA 转录因子研究较少。此外,相对其它转录因子而言,植物TGA转录因子的功能研究有限,除了在拟南芥中研究较多,在其它植物中研究甚少。
针对目前植物TGA 转录因子的研究现状,今后主要从以下几方面对TGA 转录因子展开研究:(1)研究TGA 转录因子在氧化胁迫中的复杂的调控网络;(2)从不同植物材料、不同生理途径中研究TGA 转录因子的调控作用;(3)在植物非宿主防御反应方面对TGA 转录因子的调控研究较多,在氧化胁迫应答机制方面研究较少,尤其在ROS应答机制方面的研究还有待进一步加强。
可以预见,随着分子生物学和细胞生物学的发展,对TGA 转录因子在氧化胁迫应答中的作用将会剖析得更加详细。
[1]WASTERNACK C,HAUSE B.Jasmonates:Biosynthesis,perception,signal transduction and action in plant stress response,growth and development.An update to the 2007review in Annals of Botany[J].Annals of Botany,2013,111(6):1021-1058.
[2]ZHOU X F,JIN Y H,YOO C Y,et al.CYCLIN H;1Regulates drought stress responses and blue light-induced stomatal opening by inhibiting reactive oxygen species accumulation inArabidopsis[J].Plant Physiology,2013,162(2):1030-1041.
[3]YING S,ZHANG D F,FU J,et al.Cloning and characterization of a maize bZIP transcription factor,ZmbZIP72,confers drought and salt tolerance in transgenicArabidopsis[J].Planta,2012,10(235):253-266.
[4]PARK J M,LEE J S,LEE K R,et al.Cordyceps militaris extract protects human dermal fibroblasts against oxidative stress-induced apoptosis and premature senescence[J].Nutrients,2014,6(9):3711-3726.
[5]SHINOHARA A,IMAI Y,NAKAGAWA M,et al.Intracellular reactive oxygen species mark and influence the megakaryocyte-erythrocyte progenitor fate of common myeloid progenitors[J].Stem Cells,2014,32(2):548-557.
[6]LI C H,WANG G,ZHAO J I,et al.The receptor-like kinase SIT1 mediates salt sensitivity by activating MAPK3/6and regulating ethylene homeostasis in rice[J].Plant Cell,2014,26(6):2538-2553.
[7]VOLODYMYR I L.Adaptive response to oxidative stress:Bacteria,fungi,plants and animals[J].Comparative Biochemistry and Physioligy,Toxicology &Pharmacology:CBP,2011,153(2):175-190.
[8]WATSON J D,TANIA A B,STEPHEN P B.Molecular Biology of the Gene[M].Fifth Edition.Addison-Wesly Long man,Amsterdam,2010:35-44.
[9]KATAGIRI F,LAM E,CHUA N H.Two tobacco DNA-binding proteins with homology to the nuclear factor CREB[J].Nature,1989,340(6236):727-730.
[10]CHRISTIANE G.From pioneers to team player:TGA Transcription factors provide a molecular link between different stress pathways[J].Molecular Plant-Microbe Interactions,2013,26(2):151-159.
[11]YAMAMOTO K,TESHIBA S,SHIGEOKA Y.Characterization of an omega-class glutathione S-transferase in the stress response of the silkmoth[J].Insective Molecular Biology,2011,20(3):379-386.
[12]EDWARD E F,MARTIN J M.ROS-Mediated lipid peroxidation and RES-activated signaling[J].Annual Review Plant Biology,2013,64:429-450.
[13]ZANDER M,CHEN S X,IMKAMPE J,et al.Repression of theArabidopsisthalianajasmonic acid/ethylene-induced defense pathway by TGA-interacting glutaredoxins depends on their Cterminal ALWL motif[J].Molecular Plant,2012,5(4):831-840.
[14]CHOL J,HUH S U,KOJIMA M.The cytokinin-activated transcription factor ARR2 promotes plant immunityviaTGA3/NPR1-dependent salicylic acid signaling inArabidopsis[J].Developmental Cell,2010,19(2):284-295.
[15]MURMUM J,BUSH M J,de LONG C.Arabidopsisbasic leucine-zipper transcription factors TGA9and TGA10interact with floral glitaredoxins ROXY1and ROXY2and are redundantly required for anther development[J].Plant Physiology,2010,154(3):1492-1504.
[16]LI S,LAURI A,ZIEMANN M.Nuclear activity of ROXY1,agl-utaredoxin interacting with TGA factors,is required for petal development inArabidopsisthaliana[J].Plant Cell,2009,21(2):429-441.
[17]MARK Z,CORINNA T,CHRISTIANE G.TGA Transcription factors activate the salicylic acid-suppressible branch of the ethylene-induced defense program by regulatingORA59expression[J].Plant Physiology,2014,165(4):1671-1683.
[18]ALVAREZ J M,RIVERAS E,VIDAL E A,et al.Systems approach identifies TGA1and TGA4transcription factors as important regulatory components of the nitrate response ofArabidopsisthalianaroots[J].Plant Journal,2014,80(1):1-13.
[19]STOTZ H U,FINDLING S,NUKARINEN F,et al.A tandem affinity purification tag of TGA2for isolation of interacting proteins inArabidopsisthaliana[J].Plant Singaling & Behavior,2014,9:e29990.
[20]BERGAMO P,LUONGO D,MAURANO F,et al.Butterfat fatty acids differentially regulate growth and differentiation in Jurlat T-cells[J].Journal of Cell Biochemistry,2005,96(2):349-360.
[21]CHEN D,XU G,TANG W,et al.Antagonistic basic helix-loophelix/bZIP transcription factors from transcriptional modules that integrate light and reactive oxygen species singnaling inArabidopsis[J].Plant Cell,2013,25(5):1657-1673.
[22]CHERN M,BAI W,CHEX X W,et al.Reduced expression of glycolate oxidase leads to enhanced disease resistance in rice[J].Peerj,2013,1:e28.
[23]DOMBRECHT B,XUE G P,SPRAGUE S J,et al.MYC2differentially modulates diverse jasmonate-dependent functions inArabidopsis[J].Plant Cell,2007,19(7):2225-2245.
[24]KOSTER J,THUROW C,KRUSE K,et al.Xenobiotic-and jasmonic acid-inducible signal transduction pathways have become interdependent at theArabidopsisCYP81D11 promoter[J].Plant Physiology,2012,159(1):391-402.
[25]ROJAS C M,SENTHIL-KUMAR M,WANG K,et al.Glycolate oxidase modulates reactive oxygen species-mediated signal transduction during nonhost resistance inNicotianabenthamianaandArabidopsis[J].Plant Cell,2012,24(1):336-352.
[26]FOYER C H,BLOOM A J,QUEVAL G,et al.Photorespiratory metabolism:Genes,mutants,energetics,and redox signaling[J].Annual Review of Plant Biology,2009,60:455-484.
[27]ZELITCH I,SCHULTES N P,PETERSON R B,et al.High glycolate oxidase activity is required for survival of maize in normal air[J].Plant Physiology,2009,149(1):195-204.
[28]ROJAS C M,MYSORE K S.Glycolate oxidase is an alternative source of H2O2production during plant defense responses and functions independently from NADPH oxidase[J].Plant Signaling &Behavior,2012,7(7):752-755.
[29]CHERN M,CANLAS P E,FITZGERALD H A,et al.Rice NRR,a negative regulator of disease resistance,interacts withArabidopsisNPR1and rice NH1[J].The Plant Journal,2005,43(5):623-635.
[30]PIETERSE C M J,VANDER D D,ZAMIOUDIS C,et al.Hormonal modulation of plant immunity[J].Annual Review of Cell and Developmental Biology,2012,28:489-521.
[31]HOWE G A,JANDER G.Plant immunity to insect herbivores[J].Annual Review of Plant Biology,2008,59:41-66.
[32]ATTARAN E,MAJOR I T,GRUZ J A,et al.Temporal dynamics of growth and photosynthesis suppression in response to jasmonate signaling[J].Plant Physiology,2014,165(3):1302-1314.
[33]LIN Z,ZHONG S,GRIERSON D.Recent advances in ethylene research[J].Journal of Experimental Botany,2009,60(12):3311-3336.
[34]FERNANDEZ-CALVO P,CHINI A,FERNADEZ-BARBERO G,et al.TheArabidopsisbHLH transcription factors MYC3 and MYC4are targets of JAZ repressors and act additively with MYC2in the activation of jasmonate responses[J].Plant Cell,2011,23(2):701-715.
[35]STEPANOVA A N,ALONSO J M.Ethylene signaling and response:Where different regulatory modules meet[J].Current Opinion in Plant Biology,2009,12(5):548-555.
[36]JU C,YOON G M,SHEMANSKY J M,et al.CTR1Phosphorylates the central regulator EIN2to control ethylene hormone signaling from the ER membrane to the nucleus inArabidopsis[J].Proceeding of the National Academy of Sciences of the United States of America,2012,109(47):19486-19491.
[37]van der DOES D,LEON-REYES A,KOORNNEEF A,et al.Salicylic acid suppresses jasmonic acid signaling downstream of SCFCOI1-JAZ by targeting GCC promoter motifsviatranscription factor ORA59[J].Plant Cell,2013,25(2):744-761.
[38]MUR L A,PRATS E,PIERRE S,et al.Integrating nitric oxide into salicylic acid and jasmonic acid/ethylene plant defense pathways[J].Fromtiers in Plant Science,2013,215(4):1-7.
[39]BARGMANN B O R,LAXALT A M,RIET B T,et al.Reassessing the role of phospholipase D in theArabidopsiswounding response[J].Plant Cell Environ,2009,32(7):837-850.
[40]ZANDER M,LACAMERA S,LAMOTTE O,et al.Arabidopsis thalianaclass-ⅡTGA transcription factors are essential activators of jasmonic acid/ethylene-induced defense responses[J].The Plant Journal,2010,61(2):200-210.
[41]VLOT A C,KLESSIG D F,PARK S W.Systemic acquired resistance:The elusive signal(s)[J].Current Opinion in Plant Biology,2008,11(4):436-442.
[42]SHAH J,ZEIER J.Long-distance communication and signal amplification in systemic acquired resistance[J].Frontiers in Plant Science,2013,4:30.
[43]UNQ H,MOEDER W,YOSHIOKA K.Arabidopsistriphosphate tunnel metalloenzyme2(AtTTM2)is a negative regulator of the salicylic acid-mediated feedback amplification loop for defense responses[J].Plant Physiology,2014,10(1104):1-41.
[44]KESARWANI M,YOO J,DONG X.Genetic interactions of TGA transcription factors in the regulation of pathogenesis-related genes and disease resistance inArabidopsis[J].Plant Physiology,2007,144(1):336-346.
[45]KALDE M,NUHSE T S,FINDLAY K,et al.The syntaxin SYP132contributes to plant resistance against bacteria and secretion of pathogenesis-related protein 1[J].Proceeding of the National Academy of Sciences of the United States of America,2007,104(28):11850-11855.
[46]GANQADHARAN A,SREEREKHA M N,WHITEHILL J,et al.ThePseudomonassyringaepv.tomato type Ⅲeffector HopM1suppressesArabidopsisdefenses independent of suppressing salicylic acid signaling and of targeting AtMIN7[J].PLoS One,2013,8(12):e82032.
[47]GATZ C.From pioneers to team players:TGA Transcription factors provide a molecular link between different stress pathways[J].Molecular Plant-Microbe Interactions,2013,26(2):151-159.

