p130Cas对胃癌细胞AGS增殖和凋亡的影响
p130Cas对胃癌细胞AGS增殖和凋亡的影响
李丹丁健1王锦坡吴婷1王小众
(福建医科大学附属协和医院消化内科,福建福州350001)
摘要〔〕目的探讨p130Cas对胃癌恶性生物学表型的影响及可能的分子机制。方法构建p130Cas siRNA慢病毒载体、p130Cas过表达慢病毒载体和相应的对照载体,转染AGS细胞株,筛选获得稳定转染株;RT-PCR及Western印迹证实载体的有效性;采用四甲基偶氮唑蓝比色法(MTT)比较慢病毒载体转染后各组细胞增殖情况;运用AnnexinV-PI流式细胞实验检测各组细胞凋亡情况。结果成功构建了p130Cas siRNA慢病毒载体及p130Cas过表达慢病毒载体,构建的慢病毒载体均能高效率的感染AGS细胞,感染慢病毒过表达载体后细胞p130Cas mRNA 及蛋白表达水平明显升高,感染慢病毒干扰载体后p130Cas mRNA 及蛋白表达水平显著降低。p130Cas高表达细胞株无外界刺激时p130Cas磷酸化水平未发现有明显增加(P>0.05);p130Cas低表达细胞株p130Cas磷酸化水平明显下降(P<0.05)。高表达p130Cas细胞的增殖和凋亡无明显影响(P>0.05);低表达p130Cas组细胞增殖受到抑制,凋亡率明显升高(P<0.05)。结论p130Cas总蛋白及磷酸化表达水平降低可抑制胃癌细胞株AGS细胞增殖,并促进AGS细胞凋亡,但其总蛋白表达增高对AGS细胞的增殖和凋亡无明显影响。
关键词〔〕p130Cas;增殖;细胞凋亡;胃癌
中图分类号〔〕R735.2;R322.4〔文献标识码〕A〔
基金项目:国家自然基金资助项目(81300321);福建省自然科学基金重点项目(2013J01369); 福建省自然科学资助项目(2014J01419);福建省2012临床医学重点专科资助项目(闽卫科教〔2012〕149号)
Effects of p130Cas on the proliferation and apoptosis of gastric cancer cells AGS
LI Dan,DING Jian,WANG Jin-Po,etal.
Department of Digestive Diseases,Union Hospital of Fujian Medical University,Fuzhou 350001,Fujian,China
Abstract【】ObjectiveTo detect the effects of p130Cas on the malignant biological phenotype and possible molecular mechanism.MethodsLentiviruses,produced with the corresponding plasmids and the packaging plasmids,were used to block expression of p130Cas with p130Cas siRNA and to overexpress p130Cas protein in AGS cells respectively.After transfection,the expression level of p130Cas in cell was detected by PCR and Western blot respectively.Proliferation of cell was examined by MTT.Apoptosis was detected by AnnexinV-PI flow cytometry.ResultsThe recombinant lentiviral vectors carrying human p130Cas siRNA and p130Cas gene were constructed and transfected into AGS cells successfully.The expressions of mRNA and p130Cas protein in AGS cells were increased transfected with recombinant lentiviral vector carrying human p130Cas,both mRNA and p130Cas protein were decreased in AGS cells transfected with recombinant lentiviral vector carrying human p130Cas siRNA.Proliferation was suppressed in AGS cells transfected with recombinant lentiviral vector carrying human p130Cas siRNA(P<0.05).However,proliferation maintained without increasing in AGS cells transfected with recombinant lentiviral vector carrying human p130Cas gene(P>0.05).The apoptotic rate was increased in AGS cells transfected with recombinant lentiviral vector carrying human p130Cas siRNA(P<0.05).Nevertheless,overexpression of p130Cas in AGS cells transfected with recombinant lentiviral vector carrying human p130Cas gene had no effect on cell apoptosis(P>0.05).ConclusionsDownregulation of p130Cas inhibits proliferation and promotes apoptosis in gastric cancer cell line AGS.Upregulation of p130Cas has no effect on proliferation and apoptosis of AGS cells,which presents p130Cas is an overexpressed gene in AGS.p130Cas gene plays an important role on proliferation and apoptosis of gastric cancer cell,which makes itself a target for treatment of gastric cancer.
【Key words】p130Cas; Proliferation;Cell apoptosis;Gastric cancer
1福建医科大学附属第一医院消化内科
第一作者:李丹(1976-),女,博士,副主任医师,副教授,硕士生导师,主要从事胃癌致病机制的研究。
BCAR1/p130Cas定位于16q22-q23染色体,由7个外显子组成,参与黏着斑的形成和相应的信号转导。p130Cas在多种肿瘤细胞中过表达,且与肿瘤细胞增殖、凋亡等生物学行为密切相关〔1,2〕。本研究旨在了解p130Cas对胃癌AGS细胞增殖和凋亡的影响。
1材料与方法
1.1细胞株和质粒载体病毒包装细胞293T细胞及胃癌细胞系 AGS购自ATCC。大肠杆菌DH5α购自上海吉凯基因公司,过表达慢病毒载体系统pGC-FU载体及RNA干扰慢病毒载体系统均购自上海吉凯基因公司,RNA干扰慢病毒载体系统包括pGCSIL-GFP 载体、pHelper 1.0 载体和 pHelper 2.0 载体。
1.2主要试剂M-MLV逆转录酶、Rnase Inhibitor、 dNTPs为美国promega公司产品; SYBR Master Mixture、DL 2 000 DNA Marker、Taq polymerase、各种内切酶、T4DNA ligase 、Taq polymerase等购自日本Takara公司;质粒提取试剂盒由德国QIANGEN 公司生产;MTT 试剂盒、细胞凋亡试剂盒(Annexin-V-FITC/PI)、SDS-PAGE 凝胶配制试剂盒为上海碧云天公司产品;BSA及台酚蓝由上海捷倍思基因技术有限公司生产; ECL-PLUS/Kit由美国Amersham公司产品; Lipofectamine 2000、Trizol由美国Invitrogen公司产品; AxyPreP Plasmid MiniPrep Kit、Axyprep PCRCleanuP Kit、AxyprepDNA Gel Extraction Kit、AxyPrep Plasmid Miniprep Kit产生美国Axygen公司;胎牛血清、RPMI1640培养基、Opti-MEM、 DMEM培养基购自美国GIBCO公司;抗p130Cas和抗p130Cas磷酸化抗体为英国Abcam公司生产; NC膜、ECL试剂盒由美国millpore 公司提供。
1.3方法
1.3.1细胞培养和处理AGS细胞常规培养于RPMI 1640培养液含10%胎牛血清、链霉素(100 μg/ml)和青霉素(100 μg/ml),于5%CO2、37℃的细胞培养箱中培养,隔天换液,3到4 d传代。
1.3.2Real-time PCR检测胃癌细胞系p130Cas基因表达Trizol法提取胃癌细胞SGC-7901,H1299, MKN45,AGS的总RNA,紫外分析测定所抽提RNA的浓度,RNA 逆转录获得 cDNA ,Real-time PCR 法检测 p130Cas基因表达。
1.3.3p130Cas siRNA慢病毒载体的构建设计的siRNA序列信息为:CCTTGCAGTACCCATCGCCTT。复苏并扩增DH5α菌种(含有pGCSIL-GFP质粒),抽提pGCSIL-GFP质粒,以EcoRI对质粒进行双酶切后回收酶切产物,利用T4 DNA连接酶将线性化的pGCSIL-GFP载体和目的基因p130Cas在连接缓冲液中16℃过夜连接。以氯化钙法制备大肠杆菌感受态细胞,重组载体的转化感受态细胞。由上海吉凯基因公司对重组siRNA-p130Cas慢病毒载体进行测序及比较。将重组慢病毒载体转染293T细胞后收获病毒并测定病毒滴度。
1.3.4p130Cas 过表达慢病毒载体构建设计合成如下引物:p130Cas (正义):5'-gaattcatgcctgccaagcccttcct-3 ',p130Cas(反义):5'- ggatcctcaggcggctgccagctggc-3 '复苏并扩增DH5α菌种(含有pGC-FU质粒),抽提pGC-FU质粒,以Age I 和 BamH I对质粒进行双酶切后回收酶切产物,连接后重组载体转化感受态细胞,同上步骤测序及进行病毒包装。
1.3.5重组慢病毒载体感染AGS细胞和获取稳定转染细胞株取对数生长期的AGS细胞,按每孔2×105个细胞铺入24孔板,37℃细胞培养箱过夜,第2天细胞约为密度约50%。取包装好的慢病毒p130Cas siRNA载体, p130Cas过表达载体及相应的对照载体,置于冰上融化,除去AGS细胞的培养液,加入稀释混匀的病毒液,上下左右轻轻摇匀,37℃细胞培养箱培养 8~12 h,移除含病毒的培养液,更换含10%胎牛血清的1640培养液,继续培养2~3 d,利用荧光显微镜观察绿色荧光表达情况结合流式分选获得稳定感染细胞株。
1.3.6逆转录PCR检测各转染细胞系p130Cas基因表达抽提各转染细胞组的质粒进行PCR反应,循环参数为94℃预变性5 min,94℃变性30 s,56℃退火45 s,72℃延伸1 min,共25~35个循环,最后72℃延伸7 min。 取8 μl PCR产物在琼脂糖凝胶上进行电泳,紫外光下自显影,经计算机扫描成像。
1.3.7细胞总蛋白提取胰酶消化收集各转染组及对照组细胞,加入混有PMSF的RIPA细胞裂解液,于冰上利用超声仪超声裂解细胞,4℃,12 000 r/min离心5 min,转移上清至新的EP管,采用Bradford法测定目的蛋白浓度。
1.3.8Western印迹检测各组细胞 p130Cas蛋白水平各组取80 μg总蛋白量的样品液,聚丙烯酰胺凝胶电泳后经硝酸纤维素膜转移,将膜在含10%脱脂奶粉TBS中封闭2 h后,与p130Cas单克隆抗体中4℃孵育过夜,洗涤后再与相应的二抗室温下作用1 h,经ECL底物化学发光显影,扫描为图片,经Image J软件测量胶片中条带灰度值。
1.3.9Western印迹检测各组细胞p130Cas磷酸化水平各组取80 μg总蛋白量的样品液,电泳后转移至硝酸纤维素膜,封闭后与抗p130Cas磷酸化抗体4℃孵育过夜,洗涤后再与相应二抗室温下作用1 h,发光显影后测量胶片中条带灰度值。
1.3.10四甲基偶氮唑蓝比色(MTT)实验检测各组细胞增殖能力MTT粉溶解于PBS缓冲液配制成MTT工作液,浓度为5 mg/ml,4℃避光保存。 取对数生长期的稳定感染p130Cas siRNA和过表达p130Cas的AGS细胞及对照组细胞,胰酶消化重悬为单个细胞悬液,接种7块96孔板,每孔细胞数为 2 000个,每孔体积200 μl,每孔设置4个复孔,培养3 d后取出96孔板,每孔加入20 μl MTT工作液溶液,二氧化碳孵育箱培养4 h,吸去培养上清液,每孔加入DMSO 150 μl,振荡10 min,将 96孔板放入酶联免疫读数仪,595 nm波长处,测定各孔的吸光度,其中设置只加培养液的孔作为空白对照孔,计算各组的平均吸光度(OD)值。
1.3.11流式细胞术检测各组细胞凋亡状况采用 AnnexinV-PI 法检测细胞凋亡率。收集对数生长期的稳定感染p130Cas siRNA和过表达p130Cas的AGS细胞及对照组细胞于离心管中,每样本细胞数为(1~5)×106/ml,500~1 000 r/min离心5 min,弃去培养液,孵育缓冲液洗涤1次,离心后用标记溶液重悬细胞,室温下避光孵育10~15 min,离心5 min后沉淀细胞用孵育缓冲液洗1次,加入荧光(SA-FLOUS)溶液4℃下孵育20 min,流式细胞仪分析(流式细胞仪激发光波长用488 nm,用一波长为515 nm的通带滤器检测FITC荧光,另一波长大于560 nm的滤器检测PI)。结果判断:在双变量流式细胞仪的散点图上,左下象限显示活细胞,为(FITC-/PI-);右上象限是非活细胞,即坏死细胞,为(FITC+/PI+);而右下象限为凋亡细胞,显现(FITC+/PI-)。
1.4统计分析处理使用SPSS17.0软件行t或χ2检验。
2结果
2.1p130Cas在各胃癌细胞系中的表达为检测p130Cas是否在胃癌细胞株中普遍表达,首先在胃癌细胞系SGC-7901,H1299, MKN45,AGS中利用Real-time PCR检测p130Cas的表达情况,对照GAPDH和BCAR1基因表达引物采用软件Beacon designer 2设计。SGC-7901,H1299, MKN45,AGS细胞均高表达BCAR1/p130Cas基因表达丰度能满足检测实验要求,本实验选取AGS细胞为研究对象。见图1。

1:SGC-7901 2:H1299 3:MKN45 4:AGS M:DNA Marker DL1 000 内参扩增产物电泳图 图1 P130Cas在各胃癌细胞系中的表达
2.2p130Cas siRNA慢病毒载体的鉴定
2.2.1pGCSIL-GFP载体的酶切鉴定使用EcoRI对pGCSIL-GFP载体进行酶切,酶切产物电泳检测结果。见图2。
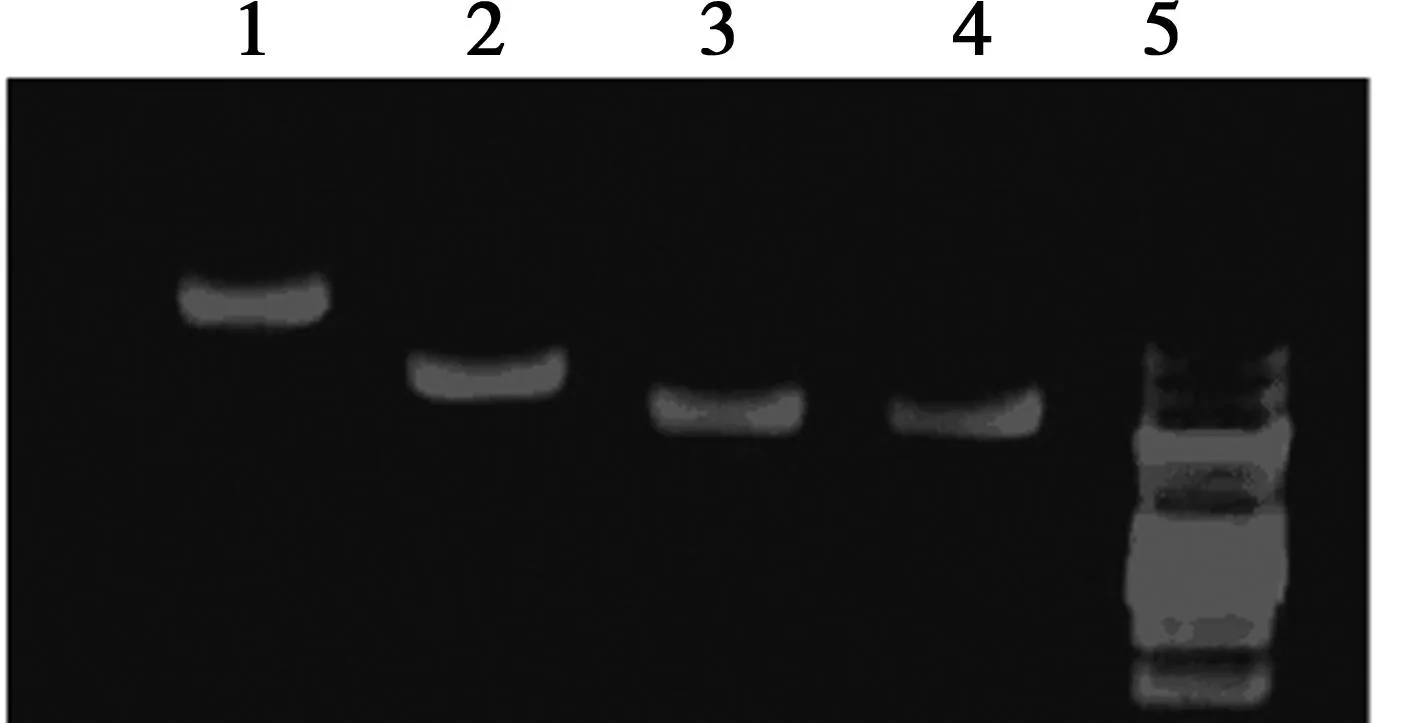
1.未酶切的载体质粒;2、3、4:EooRI酶切线性化后的载体质粒;5.Marker 图2 pGCSIL-GFP载体酶切产物电泳结果
2.2.2p130Cas siRNA慢病毒载体的测序鉴定 设计的p130Cas siRNA慢病毒载体经上海吉凯公司测序鉴定,经验证siRNA插入正确, siRNA慢病毒载体构建成功。
2.3p130Cas过表达慢病毒载体的鉴定
2.3.1pGC-Fu载体的酶切鉴定使用Age I和 BamH I对pGC-Fu载体进行双酶切。酶切产物电泳检测结果。见图3。
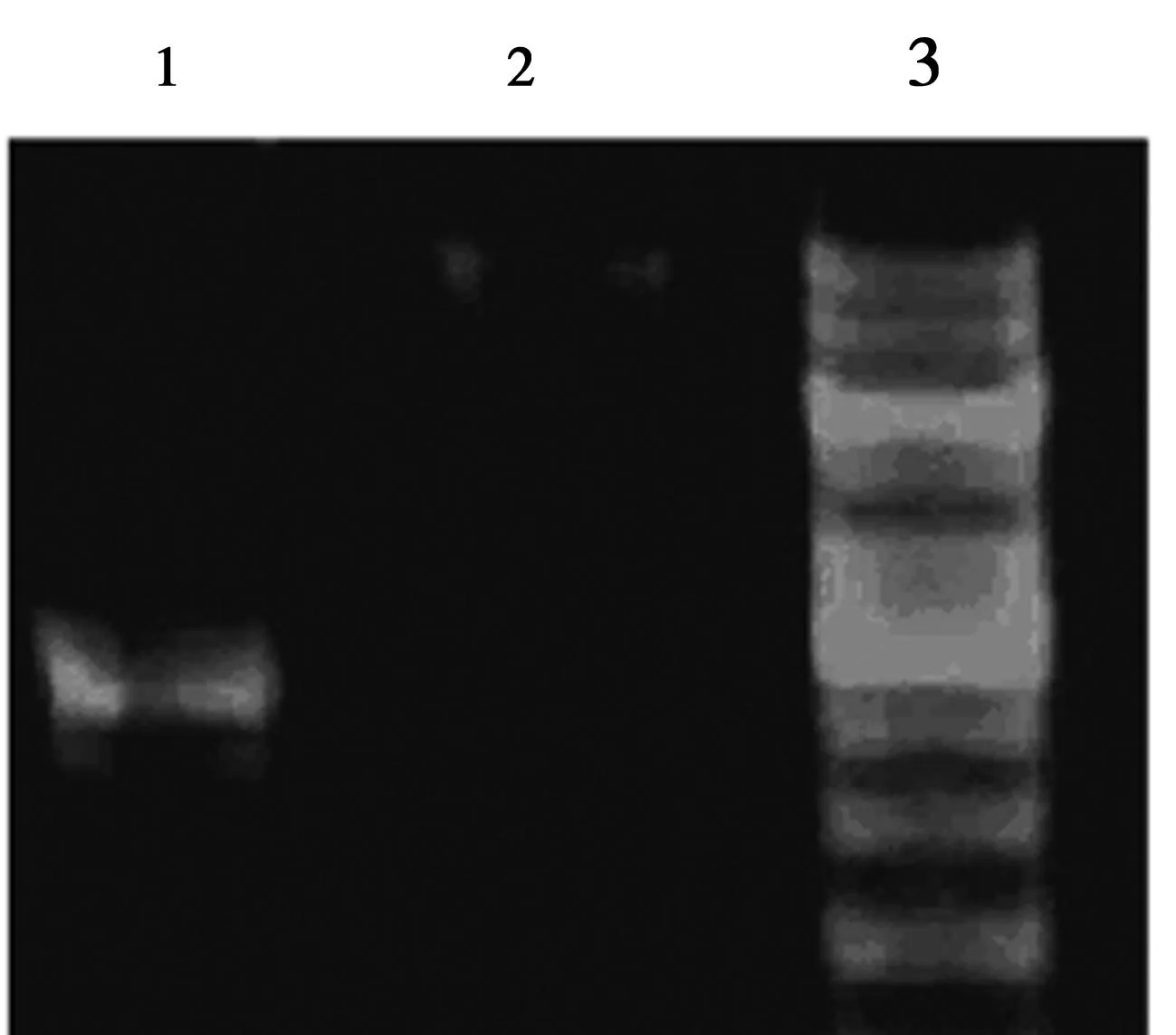
1.没有酶切的载体质粒;2.AgeⅠ和BamHⅠ酶切线性化后的载体质粒;3.Marker 图3 pGC-Fu载体酶切产物电泳结果
2.3.2p130Cas过表达慢病毒载体的测序鉴定 设计的p130Cas慢病毒载体经上海吉凯公司测序鉴定,经验证p130Cas插入正确,慢病毒过表达载体构建成功。
2.4PCR检测慢病毒载体转染后各组细胞p130Cas表达情况p130Cas慢病毒过表达载体及慢病毒siRNA载体分别感染胃癌AGS细胞,半定量PCR检测p130Cas表达结果提示转染慢病毒过表达组p130Cas表达明显增高,感染慢病毒siRNA载体组p130Cas基因表达明显受到抑制,见图4。
2.5各细胞组中总p130Cas的表达情况及磷酸化水平检测与对照组及空载体组相比,慢病毒过表达载体组p130Cas表达量明显增加(P<0.05);而慢病毒siRNA载体组p130Cas表达量与其对照组和空载体组比较显著下降(P<0.05)。同时为了明确细胞体外的磷酸化水平,Western印迹法检测在未添加任何刺激物情况下的各组细胞p130Cas蛋白的磷酸化情况,结果发现,在未添加刺激物的情况下体外细胞AGS细胞、NCRNAi组及NC过表达组即可检测到p130Cas磷酸化,三者两两之间无差异(P>0.05);与对照组及空载体组相比,转染siRNA载体组的胃癌细胞中p130Cas磷酸化水平下降(P<0.05);而转染过表达载体组与对照组和空载体组相比,胃癌细胞中p130Cas磷酸化水平无变化(P>0.05),见图5。
2.6p130Cas 的表达对 AGS细胞体外增殖能力的影响p130Cas过表达组与其对照组和空载体组间分别比较均无差异(0.353±0.075、0.374±0.045、0.401±0.026,P>0.05);p130Cas siRNA组(0.233±0.055)与其对照(0.386±0.065)及空载体组间分别比较两者的差异显著(P<0.05)。
2.7p130Cas 的表达对AGS细胞凋亡的影响与空载体组及NCRNAi转染的AGS细胞相比,利用p130Cas siRNA载体下调p130Cas基因表达后,AGS细胞凋亡率增加,达到49.78%(P<0.05);上调胃癌细胞株AGS细胞p130Cas基因表达后,AGS细胞凋亡与其对照组及空载体组相比较无差异(P>0.05)。

1.marker;2.p130cas过表达组;3.NC表达组;4.p130cas阻断组;5.NCRNAI组;6.AGS细胞组 图4 PCR检测慢病毒载体转染后各组细胞 p130Cas表达情况
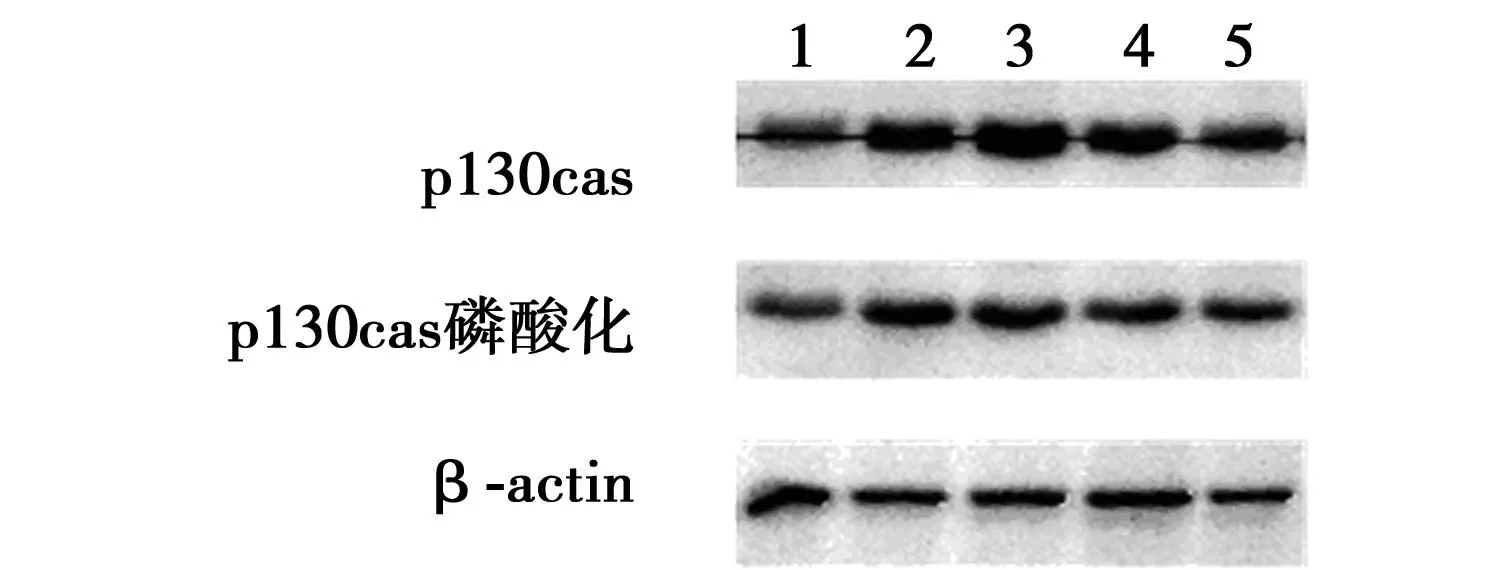
1~5:p130Cas阻断组、NC RNA组、p130Cas过表达组、NC过表达组、AGS细胞组 图5 Western印迹检测各细胞组p130Cas蛋白 表达及磷酸化水平变化
3讨论
本研究结果提示p130Cas的表达可能在胃癌细胞生物学功能中发挥重大作用。在此基础之上本实验分别成功构建了p130Cas慢病毒干扰载体和过表达载体及相应的对照载体,在证实慢病毒载体构建成功之后,分别用上述病毒载体感染AGS细胞,筛选出稳定感染的细胞株。
本研究提示阻断p130Cas表达和活化可以抑制胃癌细胞的增殖。阻断p130Cas可以促进胃癌细胞凋亡。
本研究结果与既往研究并不矛盾,Cabodi等〔3〕通过动物实验发现,p130Cas过表达可促进乳腺上皮广泛增生,只有磷酸化的p130Cas才能激活小GTPases Ras和Rac,使下游的JNK和Erk1/2-MAPK激活〔4〕,最后形成的AP-1转录激活子能够提高特定靶基因的转录水平进而调节细胞增殖〔5〕。本研究提示在体外未添加刺激物情况下胃癌细胞p130Cas即有多量磷酸化,属于过表达的分子,这可能与整合素活化、生长因子刺激、G蛋白耦联受体的肽激素配体、机械牵张等多种原因诱导p130Cas磷酸化有关,并导致p130Cas磷酸化程度在细胞中呈现饱和状态,这解释了MTT试验结果显示的p130Cas高表达组未能促进细胞增殖的原因。同样,目前大部分研究证实p130Cas有抗凋亡作用〔6〕。最近一项研究显示野生型p130Cas的过表达在凋亡中起保护细胞的作用〔7〕,而抑制p130Cas表达诱导细胞凋亡。Ta等〔8〕研究表明p130Cas过表达事实上对促凋亡刺激来说是个障碍。结合本研究结果证实胃癌p130Cas自身磷酸化水平呈现“过表达”的饱和状态,发挥着重要的抗凋亡作用。
4参考文献
1Uedo N,Iishi H,Tatsuta M,etal.Longterm outcomes after endoscopic mucosal resection for early gastric cancer〔J〕.Gastric Cancer,2006;9(2):88-92.
2Matsuda M,Mayer BJ,Fukui Y,etal.Binding of transforming protein,P47gag-crk,to a broad range of phosphotyrosine-containing proteins〔J〕.Science (New York,N.Y.),1990;248(4962):1537-9.
3Cabodi S,Tinnirello A,Bisaro B,etal.p130Cas is an essential transducer element in ErbB2 transformation〔J〕.FASEB J,2010;24(10):3796-808.
4Giancotti FG,Tarone G.Positional control of cell fate through joint integrin/receptor protein kinase signaling〔J〕.Ann Rev Cell Dev Biol,2003;19(1):173-206.
5Minden A,Karin M.Regulation and function of the JNK subgroup of MAP kinases〔J〕.Biochim Biophys Acta,1997;1333(2):F85-104.
6Nick AM,Stone RL,Armaiz-Pena G,etal.Silencing of p130Cas in ovarian carcinoma:a novel mechanism for tumor cell death〔J〕.J Natl Cancer Inst,2011;103(21):1596-612.
7Cho SY,Klemke RL.Extracellular-regulated kinase activation and CAS/Crk coupling regulate cell migration and suppress apoptosis during invasion of the extracellular matrix〔J〕.J Cell Biol,2000;149(1):223-36.
8Ta HQ,Thomas KS,Schrecengost RS,etal.A novel association between p130Cas and resistance to the chemotherapeutic drug adriamycin in human breast cancer cells〔J〕.Cancer Res,2008;68(21):8796-804.
〔2015-04-18修回〕
(编辑李相军)

