普伐他汀对人胰腺癌细胞SW1990的影响及其协同吉西他滨的抑瘤作用
张敏


[摘要] 目的 研究普伐他汀(pravastatin,Pra)对人胰腺癌细胞SW1990增殖和凋亡的影响及其联合吉西他滨(gemcitabine,GEM)对该细胞的作用。 方法 MTT比色法测定普伐他汀对SW1990细胞生长的抑制作用。不同浓度普伐他汀处理细胞48 h后,流式细胞仪测定细胞凋亡率,光学显微镜下观察细胞形态学改变。吉西他滨、普伐他汀联合吉西他滨作用细胞48 h,MTT法测定各处理组的OD值,并计算相互作用指数。 结果 MTT比色法显示普伐他汀对SW1990细胞具有抑制增殖的作用,5、15、25 μmol/L普伐他汀处理SW1990细胞后,SW1990细胞出现典型的形态学改变,且凋亡百分率随浓度增大而逐渐增加。普伐他汀联合吉西他滨作用细胞后,GEM的IC50值降低。结论 普伐他汀具有抑制胰腺癌细胞SW1990增殖和诱导该细胞凋亡的作用,普伐他汀联合吉西他滨对SW1990细胞具有协同抗瘤作用。
[关键词] 普伐他汀;吉西他滨;胰腺癌;增殖;凋亡;SW1990
[中图分类号] R735.9 [文献标识码] A [文章编号] 1673-9701(2016)27-0009-04
胰腺癌是消化道常见的恶性肿瘤之一,在欧美等西方发达国家发病率高,致死率在美国仅次于结肠癌居第4位[1]。近年来,随着环境污染加重、饮食结构调整及糖尿病年轻化等原因,我国胰腺癌发病率呈明显上升趋势[2]。胰腺癌起病隐匿,进展迅速,确诊时超过80%的患者已属中晚期而失去手术机会,需采用以化疗为主的综合治疗手段。吉西他滨为脱氧胞苷类似物,是治疗进展期和转移性胰腺癌的一线标准药物,但有效率不高,且易发生耐药。如何提高化疗药物的敏感性并逆转耐药,是目前胰腺癌治疗领域研究的难点和热点。他汀类药物通过抑制内源性胆固醇合成的限速酶——羟甲基戊二酸单酰辅酶A(HMG-CoA)还原酶,具有降低细胞内胆固醇合成的作用,是临床治疗高脂血症的主要药物[3],广泛用于治疗和预防其他心脑血管疾病[4]。越来越多的研究发现,他汀类药物除降胆固醇作用外,还可抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡,并能增加肿瘤细胞对化疗药物的敏感性。本实验初步研究了普伐他汀对人胰腺SW1990细胞的体外作用及其协同吉西他滨的抗瘤作用。
1材料与方法
1.1 细胞和主要试剂
人胰腺癌细胞株SW1990购自中国科学院细胞研究所。普伐他汀购自Sigma公司,将普伐他汀溶解、激活、滴定后加无菌蒸馏水配制成1 mmol/L备用。吉西他滨为市售齐鲁制药公司产品,溶解于无菌0.9%生理盐水,按实验设定用培养基稀释成所需终浓度。胎牛血清为杭州四季青生物技术公司产品,四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)均购自美国Sigma公司。试剂均为分析纯。
1.2 细胞培养
在37℃、饱和湿度、5%CO2的培养箱内,将SW1990细胞于含10%胎牛血清、含青霉素100 U/mL、含链霉素100 U/mL的RPMI-1640培养基中常规传代培养。
1.3 实验方法
1.3.1 MTT比色法检测普伐他汀对SW1990细胞增殖的影响 取对数生长期细胞,经胰酶消化后制备成单细胞悬液(浓度为1×105/mL),接种于96孔板培养,待细胞贴壁后,加入含不同浓度普伐他汀的RPMI-1640培养液,培养24、48、72 h收集细胞,上机测定OD值(代表细胞存活率)。实验设空白对照组(培养基调零)、细胞对照组(未经普伐他汀处理)、含5、15、25 μmol/L普伐他汀的处理组,每组设6个平行孔,所有实验重复3次。收集细胞前预先加入MTT液,培养4 h后于波长570 nm处测定OD值并计算细胞生长抑制率: 生长抑制率%=(细胞组OD值-处理组OD值)/(细胞组OD值-空白组OD值)×100%。
1.3.2 光学显微镜下细胞形态学变化 SW1990细胞接种于培养瓶中,贴壁后,加入0、5、15、25 μmol/L普伐他汀,继续生长48 h,培养瓶置于倒置显微镜下观察细胞形态并随机拍照。
1.3.3 流式细胞仪测定细胞凋亡率 将对数生长期细胞接种于培养瓶中,待细胞贴壁后,加入0、5、15、25 μmol/L的普伐他汀处理48h后收获细胞,采用流式细胞仪对细胞进行DNA分析并计算凋亡率。
1.3.4 MTT比色法检测普伐他汀联合吉西他滨对SW1990细胞增殖的影响 将对数生长期的SW1990细胞接种于96孔板上,细胞贴壁后加入含不同组别、不同浓度药物的培养基培养48 h,收集细胞后上机测定OD值并计算不同组别细胞生长抑制率。实验设空白对照组、细胞对照组、浓度为0.1、0.5、2 μg/mL单药吉西他滨组、浓度为5、15、25 μmol/L普伐他汀分别联合0.1、0.5、2 μg/mL吉西他滨组。
通过iobolanalysis分析按公式CI值=普伐他汀1/普伐他汀2+吉西他滨1/吉西他滨2计算两药联合的相互作用指数(combination index,CI)。其中,普伐他汀1、吉西他滨1为两药联合达到某一生长抑制率时各自的浓度,普伐他汀2、吉西他滨2为两药单独应用达到相同生长抑制率时的各自的浓度。CI值<1.0表明两药联合具有协同作用;CI值=1.0表明两药联合具有相加作用或无关作用;CI值>1.0表明两药联合具有拮抗作用。
1.4统计学方法
采用SPSS 13.0软件对数据进行统计学处理,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1普伐他汀对SW1990细胞增殖的影响
MTT法结果显示,5、15、25 μmol/L普伐他汀处理细胞24~72 h后,各处理组OD值逐渐下降,呈现明显的剂量和时间依赖性(表1)。方差分析结果显示同一作用时间,各组OD值差异有统计学意义(24 h 组别:F=99.905,P<0.05;48 h 组别:F=274.000,P<0.05;72 h 组别:F=316.670,P<0.05)。
2.2 细胞形态学观察
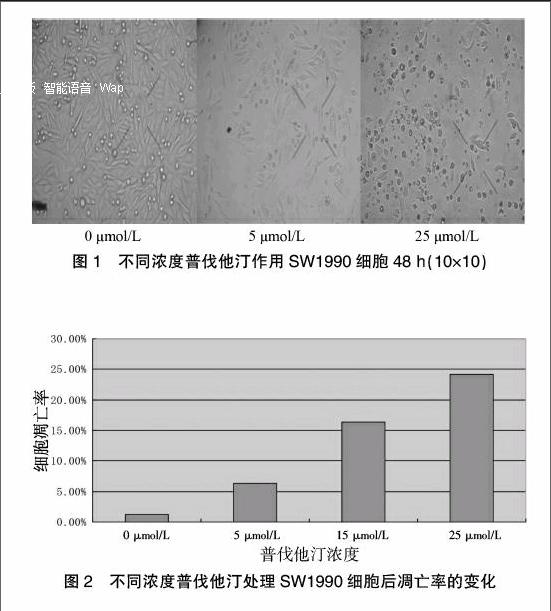
对照组细胞呈扁长形,形态规则、连接紧密。细胞经不同浓度普伐他汀处理48 h后,出现凋亡的形态学改变:细胞皱缩变形,有的胞质中可见中空的空泡,细胞破裂增多,在细胞周围可见大量裂解片段,细胞之间空隙增加,见图1。
图1 不同浓度普伐他汀作用SW1990细胞48 h(10×10)
2.3普伐他汀对SW1990细胞凋亡的影响
如图2所示:SW1990细胞经5、15、25 μmol/L普伐他汀处理48 h后,流式细胞仪测得的细胞凋亡率随处理浓度增加逐渐升高。
2.4 普伐他汀联合吉西他滨对SW1990细胞增殖的影响
MTT比色法分析了普伐他汀联合吉西他滨对SW1990细胞增殖的作用,如表2所示,0.1、0.5、2 μg/mL吉西他滨作用细胞后,OD值显著低于细胞对照组(F=851.059,P<0.05)。5、15、25 μmol/L普伐他汀分别配伍联合0.1、0.5、2 μg/mL吉西他滨,不同浓度普伐他汀联合某一浓度吉西他滨后,联合组OD值显著低于该浓度单药吉西他滨组0.1、0.5、2 μg/mL吉西他滨组别(F值分别为93.543、124.774、14.060,P均<0.05)。
根据公式计算出普伐他汀联合吉西他滨作用SW1990细胞后的生长抑制率并绘制成抑制率曲线(图3)。从抑制率曲线中可以看出联合5、15、25 μmol/L普伐他汀可显著降低吉西他滨的IC50值,且随着普伐他汀浓度增加,吉西他滨的IC50值降低愈明显。根据CI值公式,我们计算了普伐他汀联合吉西他滨达到细胞生长抑制率为50%时的CI值,发现普伐他汀联合吉西他滨的CI值均<1,说明普伐他汀和吉西他滨可协同抑制SW1990细胞增殖。
3 讨论
HMG-CoA还原酶是内源性胆固醇合成的限速酶。他汀类药物包括辛伐他汀、美伐他汀、普伐他汀等,通过竞争性抑制HMG-CoA还原酶的活性阻滞甲羟戊酸(mevalonic acid,MVA)通路,减少细胞内胆固醇的合成,并能增加血清胆固醇的清除,从而起到降低胆固醇的作用。胆固醇合成过程中的中间产物MVA是体内许多生物活性物质的前体,如泛醌、血红素A、异戊烯腺嘌呤、焦磷酸法呢酯(FPP)、焦磷酸牻牛儿基牻牛儿酯(GGPP)等[5]。他汀类药物可通过阻碍MVA途径从而抑制其一系列下游产物的合成,进而影响细胞生长、分化、凋亡及细胞间信号传导,发挥调控肿瘤生长和转移的作用[6-8]。随着分子生物学技术的发展和研究的不断深入,他汀类药物的抗肿瘤作用日益受到重视。近年来一系列的研究表明,他汀类药物对前列腺癌[9]、肺癌[10]、乳腺癌[11,12]、结直肠癌[13]、恶性胶质瘤[14]、头颈部肿瘤[15]等多种肿瘤细胞具有明确的抑制作用。
本实验通过MTT法观察普伐他汀对胰腺癌细胞SW1990的影响,发现普伐他汀可明显抑制细胞生长。如表1所示,不同浓度普伐他汀作用SW1990细胞24~72 h后,抑制率由14.47%增至65.37%。光学显微镜下,我们可以看到普伐他汀作用细胞后的凋亡形态学改变,DNA凝胶电泳则显示药物组出现阶梯状排列的DAN梯带,说明普伐他汀可诱导SW1990细胞发生凋亡。在联合用药的实验中,经计算普伐他汀联合吉西他滨的CI值均小于1,证实普伐他汀可增强吉西他滨的抑瘤作用,二者联合具有协同作用。实验结果提示,在临床应用吉西他滨单药或含有吉西他滨的联合化疗方案治疗胰腺癌,同时加用普伐他汀,可能起到增加化疗药物敏感性、减少化疗药物剂量的作用,进而提高进展期或晚期胰腺癌患者的化疗耐受性,改善生活质量,延长生存期。
近年来越来越多的体外实验和动物实验证实他汀类药物具有抗肿瘤作用,但确切的分子机制尚未阐明。本实验的结果为临床治疗胰腺癌提供了一些有益的借鉴,关于普伐他汀抗胰腺癌细胞及增敏吉西他滨的作用机制尚待进一步深入研究。
[参考文献]
[1] Siegel R,Naishadham D,Jemal A. Cancer statistics 2012[J].CA Cancer J Clin,2013,62(1):10-29.
[2] Long J,Luo GP,Xiao ZW,et al. Cancer statistics:Currentdiagnosis and treatment of pancreatic cancer in Shanghai,China[J]. Cancer Lett. 2014,346(2):273-277.
[3] Benghozi R,Bortolini M,Jia Y,et al. Frequency of creatine kinase elevation during treatment with fluvastatin[J]. Am J Cardiol,2002,89(2):231-233.
[4] Khush KK,Waters DD. Effects of statin therapy on the development and progression of heart failure:Mechanisms and clinical trials[J]. J Card Fail,2006,12(8):664-674.
[5] Hager MH,Solomon KR,Freeman MR. The role of cholesterol in prostate cancer[J]. Curr Opin Clin Nutr Metab Care,2006,9(4):379-385.
[6] Desai CS,Martin SS,Blumenthal RS. Non-cardiovascular effects associated with statins[J]. BMJ,2014,349(Jul1711):g3743.
[7] Borahay MA,kilic GS,Boehning DF. Induces calcium-dependent apoptosis of human leiomyoma cells[J]. J Biol Chem,2014,289(51):533-534.
[8] Chang HL,Chen CY,Hsu YF,et al. Simvastatin induced HCT116 colorectal cancer cell apoptosis through p38MAPK-p53-survivin signaling cascade[J]. Biochim Biophys Acta,2013,1830(8):4053-4064.
[9] Xu WP,Shen E,Bai WK,et al. Enhancede antitumor effects of low-frequency ultrasound and microbubbles in combination with simvastatin by downregulating caveolin-1 in prostatic DU 145 cells[J]. Oncol Lett,2014,7(6):2142-2148.
[10] Gallelli L,Falcone D,Scaramuzzino M,et al. Effects of simvastation on cell viability and proinflammatory pathways in lung adenocarcinoma cells exposed to hydrogen perxide[J]. BMC Pharmacol Toxicol,2014,15(1):67.
[11] Shen YY,Yuan Y,Du YY,et al. Molecular mechanism underlying the anticancer effect of pravastatin on MDA MB 231 human breast cancer cells[J]. Molecular Medicine Reports,2015,12(1):623-630.
[12] Sanchez CA,Rodriguez E,Varela E,et al. Statin-induced inhibition of MCF-7 breast cancer cell proliferation is related to cell cycle arrest and apoptotic and necrotic cell death mediated by an enhanced oxidative stress[J]. Cancer Invest,2012,26(1): 698-707.
[13] Al-Haidaril AA,Syk l,Thoriacius H. HMG-CoA reductase regulates CCL17-induced colon cancer cell migration via geranylgeranylation and RhoA activation[J].Biochem Biophys Res Commun,2014,446(1):68-72.
[14] Cemeus C,Zhao TT,Barreett GM,et al. Lovastatin en-hances gefitinib activity in glioblastoma cells irrespec-tive of EGFRⅧ and PTEN status[J]. J Neurooncol,2012,90(1):9-17.
[15] 蔡文燕,严斐,董晶,等. 辛伐他汀对唾液腺腺样囊性癌细胞生长及suivivin表达的影响[J]. 中国口腔颌面外科杂志,2016,14(3):213-217.
(收稿日期:2016-04-27)

