水团花不同种源抗寒性比较研究
郭玮龙,岳春雷,胡国伟,苏 燕,汤梦芸,金水虎*
(1. 浙江农林大学,浙江 临安 311300;2. 浙江省林业科学研究院,浙江 杭州 310023;3. 浙江森禾种业股份有限公司,浙江 杭州 310007)
水团花不同种源抗寒性比较研究
郭玮龙1,岳春雷2,胡国伟3,苏 燕1,汤梦芸1,金水虎1*
(1. 浙江农林大学,浙江 临安 311300;2. 浙江省林业科学研究院,浙江 杭州 310023;3. 浙江森禾种业股份有限公司,浙江 杭州 310007)
对浙江建德、遂昌、苍南三种源地的水团花一年生播种苗的抗寒性进行比较研究,测定其在 4、0、-4、-8和-12℃ 5个温度梯度处理下离体叶片的细胞膜透性、可溶性糖含量、可溶性蛋白含量、丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性等生理生化指标,并结合Logistic曲线方程计算植株低温半致死温度(LT50)。结果表明,随着温度降低,3种源地植株叶片的细胞膜透性均有增加,可溶性糖含量、可溶性蛋白含量、丙二醛(MDA)含量呈上升趋势,SOD活性先上升后下降,低温半致死温度为:建德-3.49℃、遂昌-2.4℃、苍南-
水团花;抗寒性;低温胁迫;生理生化指标
水团花(Adina pilulifera)属于(Rubiaceae)水团花属(Adina),该属有3种,我国有2种,即水团花和细叶水团花。水团花主要分布于长江以南各省区及陕西南部。在浙江省主要分布于中西部的建德地区,中部的金华、丽水地区,南部的温州等地,多生于海拔300~610 m的山坡谷底及溪边路旁灌丛中[7],作为乡土树种,水团花生态适应性强,生长快,根系发达,同时具有抗逆性强、耐瘠薄、病虫危害少、易管护等特点,而且作为常绿植物,其花果均有较高的观赏价值,值得开发应用。
水团花的生长受温度的局限相对较大,而目前对它的研究也主要集中在繁殖技术和化学成分方面,在抗性研究方面较少。为此,本研究开展其抗寒性研究,旨在为河道生态护坡等提供植物新材料、提高生态效益、增加生物多样性和植物群落稳定性提供理论依据。
1 材料与方法
1.1 实验材料
实验用水团花为一年生播种苗,其种子于2012年10月采自苍南县马站(27° 25′ 46.4″ N,120° 23′ 25.9″ E)、遂昌县妙高(28° 32′ 26.3″ N,119° 13′ 16.6″ E)、建德市梅城(30° 14′ 20″ N,119° 43′ 37″ E)3个种源地。2013 年11月至2014年3月,选择生长良好、长势基本一致的一年生植株,采集其长势一致的叶片,于浙江农林大学实验室进行试验。
1.2 实验方法
1.2.1 低温处理 选取生长正常的叶片,在蒸馏水中洗净后,用吸水纸吸干,塑封袋包装后分别置于Heto(丹麦)制冷循环水容器中。温度设定为4、0、-4、-8和-12℃ 5个温度梯度,低温处理时间为12 h,设3次重复。
相较于医院院区间的信息共享,区域卫生信息共享需要克服不同医院在区域医疗体系中由于角色与定位不同带来的共建共享障碍。医联体通常由一所综合强的医院牵头,通过签署协议将一定区域内的三级医院与二级医院、社区医院等组成的一个医疗联合体,构建分级医疗、急慢分治、双向转诊的诊疗模式,促进分工协作,合理整合资源,实现信息共享[20]。
1.2.2 生理生化指标测定
电导率测定 将低温处理后的叶片剪成约0.6 cm的段,称取0.2 g,放入试管中,加入5 mL蒸馏水真空渗入15 min,振荡一下,于25℃环境下放置3 h,取出再振荡一下,静置后用DDS-11A型电导仪测电导率值R1,然后水浴15 min,静置冷却后测煮沸后电导率R2,计算相对电导率k[8]:

丙二醛(MDA)含量测定 采用硫代巴比妥酸(TBA)显色法。可溶性糖含量测定 采用蒽酮比色法。
可溶性蛋白含量测定 采用考马斯亮蓝G-250染色法。
超氧化物歧化酶(SOD)活性测定 采用NBT光照化学还原法[8~10]。
1.2.3 数据处理 利用SPSS软件进行方差分析,利用Logistic曲线方程计算植物半致死温度,拟合公式:

式中,y为电解质外渗率,t为处理温度,a、b为方程参数[8]。
2 结果与分析
2.1 低温胁迫下相对电导率的变化
3种源地水团花低温处理后相对电导率的变化情况见图1。
随着温度的降低,建德、遂昌、苍南三种源地水团花的相对电导率均呈上升趋势,并且三地相对电导率总体呈现苍南 > 遂昌 > 建德的现象。对各处理温度下三种源地的相对电导率进行方差分析(表 1),随着温度的下降其相对电导率差异显著:在0~-4℃,建德地区和其他两地差异极显著,在-4~-8℃,建德、遂昌两地与苍南地区差异显著,根据相对电导率50%时为拐点温度推论3种源地水团花的低温半致死温度在-2~-4℃。结合Logistic曲线方程计算,求二阶导数,并令其等于0,由t = lna/b计算建德的低温半致死温度最低,为-3.49℃,遂昌次之为-2.4℃,苍南最高为-
2.23℃(表1)。
叶片相对电导率是常用的衡量植物受温度肋迫影响的生理指标,低温胁迫使细胞膜透性增加,越不耐寒的植物,膜透性增加的速度越快,相对电导率上升的趋势也就越快[11]。分析比较相对电导率测定结果表明,建德的水团花抗寒性相对最强,其次是遂昌的水团花,苍南的水团花抗寒能力较弱。

图1 三种源地水团花相对电导率变化趋势Figure 1 Variation of relative electrical conductivity of A. pilulifera from different provenances
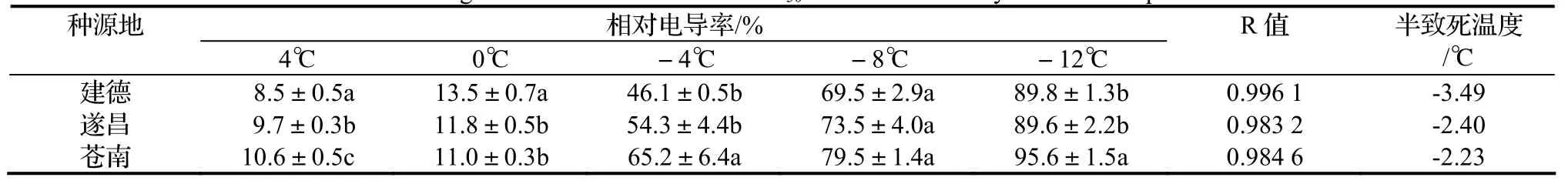
表1 不同低温处理相对电导率的差异显著性比较及半致死温度(P < 0.05)Table 1 Significance of difference and LT50of leaves treated by different temperature
2.2 低温胁迫对丙二醛含量的影响
各处理下的丙二醛含量变化见图2。
随着温度降低,低温胁迫的加强,3种源地水团花丙二醛含量的积累为建德<遂昌<苍南,变化趋势相似,其中在4℃至0℃时丙二醛含量略有下降,随着处理温度的持续下降,各处理的丙二醛含量缓慢增加。说明建德和遂昌的水团花抗寒能力较强,而苍南的水团花则受寒害更为显著。
当植物受到低温胁迫时,体内可溶性糖的含量就会增加。从图3结果显示,随着低温胁迫的加强,3种源地水团花可溶性糖的含量都呈显著上升趋势,呈建德>遂昌>苍南的结果,且均在-8℃时达到峰值,但上升幅度存在差异,建德的水团花可溶性糖含量变化较为明显,峰值为0.127±0.008 mg/g,遂昌为0.107±0.005 mg/g,苍南为0.093±0.008 mg/g。所以,建德地区的水团花抗寒能力较强,遂昌次之,苍南最弱。
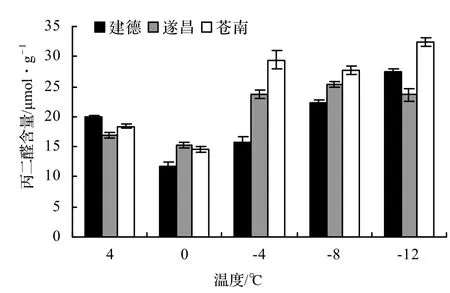
图2 低温胁迫对水团花丙二醛含量的影响Figure 2 Effect of low temperature on MDA of tested leaves

图3 低温胁迫对水团花可溶性糖含量含量的影响Figure 3 Effect of low temperature on soluble sugar content of tested leaves
2.4 低温胁迫对可溶性蛋白含量的影响
由图4可知,随着温度的下降,可溶性蛋白含量在4~0℃有下降趋势,在0~-8℃含量总体呈上升趋势,其峰值分别为建德879.379±20.779 mg/g,遂昌833.31±25.518 mg/g,苍南371.625±30.690 mg/g,结合3种源地水团花理论低温半致死温度在0℃~-4℃的结论,发现建德和遂昌的水团花受低温胁迫所产生的可溶性糖总量明显高于苍南的,所以,这两地的水团花抗寒能力相对较强。
2.5 低温胁迫对超氧化物歧化酶(SOD)活性的影响
由图5可知,水团花受低温胁迫时,SOD活性总体呈先上升后下降的趋势,在-4~-8℃时达到峰值,其峰值为建德422.401±12.492,遂昌374.236±7.857,苍南353.989±7.315,活性强度为建德 > 遂昌 > 苍南。这一趋势变化也符合水团花理论低温半致死温度的计算结果,表明在抗寒性上,建德 > 遂昌 > 苍南。

图4 低温胁迫对植物可溶性蛋白含量的影响含量的影响Figure 4 Effect of low temperature on soluble protein content of tested leaves
3 讨论
本研究中,人为低温处理,模拟低温胁迫环境,测定浙江建德、遂昌、苍南3种源地水团花一年生播种苗离体叶片的相对电导率,随着胁迫温度的持续降低,呈平稳态势后急剧上升的趋势,这说明在4~0℃,水团花受到伤害较小,具有较强的抗寒能力,在低温胁迫后期,电导率急剧增加,说明此时水团花细胞膜透性已受到损害,细胞内溶质渗出,植物受到严重损害。根据相对电导率曲线图和 Logistic曲线方程计算得出了理论低温半致死温度,依次为建德最低-3.49℃,遂昌居中-2.4℃,苍南最高-2.23℃。
MDA是膜脂过氧化的产物,它的积累会导致膜的完整性受到破坏,MDA一旦升高,表明细胞膜脂质过氧化程度加剧,植物细胞膜系统受到破坏,即膜系统失去其原有的选择性透性,研究结果表明,在4~0℃时丙二醛含量略有下降,可能是由于在降温过程中植物体内通过增加保护酶活性发挥其保护作用,从而降低了丙二醛的含量[12]。
可溶性糖能提高细胞的渗透浓度,降低植物冰点,抗寒能力越强的种类可溶性糖含量增加的就越多[13];可溶性蛋白则有利于合成特异性蛋白和对低温更稳定、活性更强的同工酶来保证低温环境中的物质代谢以及维持膜的稳定。研究结果显示在降低温度过程中,3种源地地水团花可溶性糖含量一直呈上升趋势;而可溶性蛋白含量在4~0℃有下降趋势,可能是由于在这个温度范围内各种保护酶活性的加强导致了可溶性蛋含量的下降。
SOD酶活性在低温下,维持较高的活性水平,能防止因冷害产生的毒害物质如活性氧自由基的积累,减轻由膜脂过氧化所引起的膜伤害,从而增加植物体的抗寒能力,抗寒性强的品种其SOD酶活性高,抗寒性差的品种酶活性低[14]。水团花在低温胁迫下SOD活性则呈先上升后下降的趋势,低温胁迫初期活性的上升说明在低温胁迫下其清除自由基的能力增强。在降温初期植物对低温具有一定的防御反应,来减缓细胞内多余的自由基对细胞伤害的速度与程度,胁迫后期不断下降说明,此时植物体已受到严重损伤,清除活性氧自由基能力下降。综合比较结果显示,建德的水团花抗寒性较好,遂昌的居中,苍南的水团花抗寒能力较弱。
结合以往试验,发现电导率是研究植物细胞膜破坏程度最简单和最直接的方法[4]。而其他生理指标变化与植物抗寒性也有着密切的关联,如对葡萄[15]和马蹄金[16]的抗寒性研究将可溶性糖作为筛选抗寒性的生理指标,研究认为,随着低温胁迫的加强,可溶性糖的含量会增加;对山茶[16]和果梅[17]的抗寒性研究则认为,可溶性蛋白或丙二醛含量更为可靠,其含量也会随着温度的下降而升高;而通过对玉兰[18]和景天科植物[19]的抗寒性研究发现,在植物受低温胁迫时,SOD酶的活性大致呈先上升后下降的规律。本实验测定的生理生化指标变化趋势与上述研究结果基本相符,实验结果为水团花在河道绿化、生态恢复和其它园林绿地的美化推广应用等提供了一定的理论依据。
[1] Lyons J M,Raison J K,Oxidative activity of mitochondria isolated from plant tissues sensitive and resistant to chilling injury[J]. Plant Physiol,1970,4(5):386-389.
[2] 张钢. 国外木本植物抗寒性测定方法综述[J]. 世界林业研究,2005,18(5):14-18.
[3] 蔡仕珍,潘远智,陈其兵,等. 低温胁迫对花叶细辛生理生化及生长的影响[J]. 草叶学报,2010,19(1):95-102.
[4] 董军生,张昕欣,袁惠贞. 几种生理生化指标与植物抗寒性关系研究概况[J]. 河北林业科技,2009(B09):44-45.
[5] 王永红,李纪元,田敏,等. 低温胁迫对山茶物种2个抗寒性生理指标的影响[J]. 林业科学研究,2006,19(1):121-124.
[6] Keinänen L,Palonen P,Linden L. Flower bud cold hardiness of 'Muskoka' red raspberry as related to water content in late winter[J].
Int J Fruit Sci,2006,6(1):63-76.
[7] 浙江植物志编辑委员会. 浙江植物志(第6卷). 杭州:浙江科学技术出版社,1993.
[8] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[9] 李合生. 植物生理生化实验原理与技术[M]. 北京:高等教育出版社,2001.
[10] 姚士才,秦贺兰,古润泽. 5个小菊新品种耐热性综合评价与鉴定[J]. 中国农学通报,2006,22(12):217-219.
[11] 项延军,李新芝,王小德. 5种藤本植物的抗寒性研究初探[J]. 浙江大学学报(农业与生命科学版),2011,37(4):421-424.
[12] 缴丽莉,倪志云,路丙社,等. 低温胁迫对青榨槭幼树抗寒指标的影响[J]. 河北农业大学学报,2006,29(4):44-47.
[13] 张兆英,宋立立. 园林植物抗寒性鉴定指标的分析[J]. 黑龙江农业科学,2012(2):60-62.
[14] 金波. 五种常绿攀缘藤本植物抗寒性研究[D]. 南京:南京林业大学,2007.
[15] 牛锦凤,王振平,李国,等. 几种方法测定鲜食葡萄枝条抗寒性的比较[J]. 果树学报,2006,23(1):31-34.
[16] 李君,周守标,黄文江. 马蹄金野生种与栽培种在自然降温过程中的抗寒性研究[J]. 草业科学,2005,22(6):105-107.
[17] 高志红,章镇,韩振海. 果梅种质枝条抗寒性鉴定[J]. 果树学报,2005,22(6):709-712.
[18] 王静,丛日晨,朱书香,等. 玉兰花瓣抗寒性研究[J]. 北京园林,2009(4):34-37.
[19] 王倩,冷平生,关雪莲,等. 九种景天植物在越冬期间生理生化指标的变化[J]. 北方园艺,2010(19):114-117.
Cold Hardiness of Adina pilulifera from Different Provenances
GUO Wei-long1,YUE Chun-lei2,HU Guo-wei3,SU Yan1,TANG Meng-yun1,JIN Shui-hu1*
(1. Zhejiang A & F University, Lin’an 311300, China; 2. Zhejiang Forestry Academy, Hangzhou 310023, China; 3. Zhejiang Senhen Seed Company Limited, Hangzhou 310007, China)
Experiments were conducted on cold resistance of 1-year seedlings of Adina pilulifera from Jiande, Suichang and Cangnan of Zhejiang province. Cell membrane permeability, soluble sugar content, soluble protein content, MDA and SOD were determined of excised leaf treated under 4, 0, -4, -8 and -12℃. Semi-lethal temperature (LT50) was calculated with logistic curve equation. The results showed that cell membrane permeability, soluble sugar content, soluble protein content and MDA of tested leaves from different provenances increased with the decrease of temperature, and the SOD activity increased first and then decreased. The LT50was -3.49℃ of the provenance of Jiande, -2.4℃ of Suichang, -2.23℃ of Cangnan.
Adina pilulifera; cold hardiness; low temperature stress; physiological and biochemical index
S718.43
B
1001-3776(2015)02-0032-05
2014-10-15;
2015-02-14
浙江省科技计划项目(2011C22015)
郭玮龙(1988-),男,浙江杭州人,硕士生,从事植物分类与开发应用研究;*通讯作者。
2.23℃;3种源地水团花的抗寒顺序依次为:建德 > 遂昌 > 苍南。

