不同真菌发酵对油菜秸秆养分含量、酶活性及体外发酵有机物降解率的影响
龚剑明 赵向辉周 珊 傅传鞭 刘婵娟 瞿明仁(江西农业大学动物科技学院,江西省动物营养重点实验室/营养饲料开发工程研究中心,南昌330045)
不同真菌发酵对油菜秸秆养分含量、酶活性及体外发酵有机物降解率的影响
龚剑明 赵向辉∗周 珊 傅传鞭 刘婵娟 瞿明仁∗∗
(江西农业大学动物科技学院,江西省动物营养重点实验室/营养饲料开发工程研究中心,南昌330045)
摘 要:为提高油菜秸秆的利用率,筛选出油菜秸秆发酵适宜菌种,本试验利用黄孢原毛平革菌(P.chrysosporium)、香菇菌(L.edodes)、虫拟蜡菌(C.subvermispora)、槭射脉革菌(P.acerina)4种真菌接种油菜秸秆,以不加真菌的油菜秸秆为对照,进行50 d固态发酵。测定养分含量、养分降解率、锰过氧化物酶和羧甲基纤维素酶活性、体外发酵有机物降解率(IVOMD)和有机物酶解率。结果显示:1)不同真菌发酵油菜秸秆,显著改变了常规养分含量(P<0.05),L.edodes、C.subvermispora、P.chrysosporium发酵显著提高了粗蛋白质含量(P<0.05);2)所有真菌发酵的油菜秸秆中有益成分几丁质含量得到显著提高(P<0.05);3)发酵油菜秸秆干物质、有机物、中性洗涤纤维、酸性洗涤纤维、酸性洗涤木质素降解率表现为L.edodes组>P.chrysosporium组>P.acerina组和C.subvermispora组,差异显著(P<0.05);4)发酵油菜秸秆锰过氧化物酶活性表现为L.edodes组>P.chrysosporium组>P.acerina组和C.subvermispora组,差异显著(P<0.05),P.acerina组羧甲基纤维素酶的活性显著低于其他试验组(P<0.05);5)与对照组相比,L.edodes和P.chrysosporium发酵使IVOMD显著增加(P<0.05),P.acerina发酵使IVOMD和有机物酶解率显著降低(P<0.05)。结果提示,L.edodes和P.chrysosporium发酵油菜秸秆能够降解纤维物质,改善IVOMD,但同时导致了有机物的浪费。
关键词:油菜秸秆;白腐真菌;降解率;体外发酵;几丁质;酶活性
∗同等贡献作者
∗∗通信作者:瞿明仁,教授,博士生导师,E⁃mail:qumingren@sina.com
我国油菜种植面积大,油菜秸秆资源丰富。油菜秸秆中含有大量的纤维素(茎部达53%)、半纤维素(18.34%)等碳水化合物,是反刍动物的重要饲料来源[1]。但生产中,油菜秸秆并没有被广泛地用于畜牧养殖业,大部分被直接焚烧[2]或腐解还田,不仅浪费了资源,还严重污染环境。究其原因在于,油菜秸秆木质化程度高、秸秆粗硬、适口性差;油菜秸秆中木质素与纤维素形成坚固的酯键结构,瘤胃微生物对其难以降解。若不加工处理,会影响动物采食量,降低生产性能[3]。以往多采用酸化、碱化等方式处理油菜秸秆,但其残留的酸碱,会对动物本身造成伤害,而且污染环境[4]。与上述化学方法相比,利用微生物发酵技术处理秸秆,则绿色、安全、无污染,且可提高饲料的适口性和利用率[5-6]。Sharma等[7]和Arora等[8]研究发现,裂褶菌科部分菌种(Phlebiaspp)、香菇菌(L.edodes)及虫拟蜡菌(C.subvermispora)处理麦秸、稻草、玉米秸时,能在损耗少量的纤维素和半纤维素情况下,发挥较强的木质素降解能力。但这些菌种发酵油菜秸秆的效果如何,目前尚未见到报道。因此,本试验通过研究黄孢原毛平革菌(P.chrysosporium)、L.edodes、C.subvermis⁃pora、槭射脉革菌(P.acerina)发酵对油菜秸秆养分含量、酶活性及体外发酵有机物降解率(IVO⁃MD)的影响,探讨其降解油菜秸秆纤维物质的能力,旨在为油菜秸秆的开发利用提供理论依据和技术支撑。
1 材料与方法
1.1 试验材料及菌种
本试验所使用的P.chrysosporium、L.edodes、C.subvermispora购自中国农业微生物菌种保藏中心。P.acerina购自中国普通微生物菌种保藏管理中心。
油菜秸秆取自国家肉牛体系高安试验站。去除样品根部10 cm严重木质化部分,切碎至1~2 cm长,65℃烘干。
1.2 培养基的配制
1.2.1 马铃薯葡萄糖琼脂(PDA)培养基
称取200 g去皮、去芽眼的马铃薯,切成小块,加1 000 mL水煮沸30 min,6层纱布过滤去除马铃薯渣,继续加热,加入20 g琼脂,待琼脂溶解完全后,加20 g葡萄糖,3 g KH2PO4,1.5 g MgSO4·7H2O,10 mg硫胺素,稍冷却后将滤液补足至1 000 mL,pH调至6.0。0.12 MPa灭菌20 min,倒入培养皿,检查灭菌效果。
1.2.2 麦粒培养基
取1 kg小麦,沸水煮40 min,自来水冲洗后沥干,加入2 g CaCO3和8 g CaSO4,混合均匀。将120 g处理过的小麦放入250 mL锥形瓶中,密封,0.12 MPa高压蒸汽灭菌30 min,检查灭菌效果。
1.3 试验设计
试验设5组,对照组油菜秸秆不加真菌,4个试验组油菜秸秆分别接种P.acerina、L.edodes、C.subvermispora、P.chrysosporium,每组设3个重复,对油菜秸秆进行50 d固态发酵。
1.4 不同真菌对油菜秸秆发酵
各组发酵条件及具体步骤如下。
将4℃保存的4种菌种取出,25℃培养活化,分别接种于PDA培养基上,直至菌丝铺满培养皿(一般1周左右)。然后从PDA培养基取3个含有菌丝的琼脂块(约6 mm×6 mm×6 mm)接种于麦粒培养基中,25℃避光培养,定期摇匀,直至培养基长满菌丝(一般2周左右)。准确称取50 g油菜秸秆加入到1 L锥形瓶中,然后加入蒸馏水,使水分含量达到60%,0.12 MPa高压蒸汽灭菌15 min,无菌间室温下冷却24 h。然后向装有油菜秸秆的锥形瓶中接种3.75 g含菌种麦粒(约占3%,m/m),同时向对照组锥形瓶中加入未接种菌种的麦粒,摇匀。25℃避光培养50 d。
1.4.1 样品的采集
在第50天时,向秸秆固态发酵的锥形瓶中加入720 mL 20 mmol/L的乙酸-乙酸钠缓冲液(pH=5.0),39℃恒温振荡水浴锅振荡(200 r/min)20 min。然后用400目尼龙网过滤液体,滤液在4℃离心(8 000 r/min)15 min,取上清液,用于酶活性测定。剩余滤渣65℃烘干至恒重,粉碎(FZ102粉碎机,北京中兴伟业仪器有限公司,1 mm孔径),用于测定养分含量。
1.4.2 养分含量和降解率测定方法
将5组培养了50 d的油菜秸秆,经65℃烘干至恒重,用凯氏定氮法测定粗蛋白质(CP)含量。参照Van Soest[9]的方法测定中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、酸性洗涤木质素(ADL)含量。通过计算NDF与ADF的差值以及ADF与ADL的差值分别得到半纤维素(hemicellu⁃lose)和纤维素(cellulose)含量,计算发酵后养分降解率。几丁质含量的测定参考Chen等[10]的方法。
1.4.3 酶活性测定
取5组发酵50 d的培养液进行有关酶活性测定。漆酶活性测定参考Shrivastava等[11]的方法并进行适当修改。测定2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)的氧化反应,用分光光度计(U⁃3900,Hitachi,日本)测定其在420 nm吸光度的变化。反应在1.5 mL离心管中于25℃下进行,反应体系为1 mL[0.5 mL 0.3 mmol/L ABTS和0.5 mL 50 mmol/L醋酸钠缓冲液(pH 5.0)]。定义每分钟氧化1 μmol ABTS所需的酶量为1个酶活力单位(U)。
锰过氧化物酶活性测定参考Wariishi等[12]的方法并进行适当修改。反应体系含有50 mmol/L琥珀酸-琥珀酸钠缓冲液(pH 4.5),1 mmol/L MnSO4,0.1 mmol/L H2O2,30℃水浴,于270 nm处测吸光度的变化。定义每分钟使1 μmol Mn2+转化为Mn3+所需的酶量为1个酶活力单位(U)。
1.5 IVOMD和有机物酶解率(enzymatic OMD)测定
将65℃烘干至恒重的发酵油菜秸秆样品用于体外瘤胃养分降解率测定。瘤胃液于晨饲前采自饲喂稻草∶精料(7∶3)的3头瘘管锦江黄牛,瘤胃液经过4层纱布过滤后按1∶2比例与缓冲液[13]混匀,持续通入CO2至饱和。向250 mL的发酵瓶中加入500 mg的发酵油菜秸秆和60 mL的混合瘤胃液,使用三通阀将瓶子与玻璃注射器相连,用于排气维持气压,39℃恒温振荡发酵48 h。所有样品做3个重复,空白组(不添加样品)用于校正瘤胃液中残留的有机物造成的影响。48 h后将发酵瓶放入4℃终止发酵,用已称重的玻璃坩埚过滤残渣,抽滤,65℃烘干,用于计算IVOMD。
将65℃烘干至恒重的发酵油菜秸秆样品进行有机物酶解率测定,测定参考Rahman等[14]的方法。
1.6 数据处理与统计分析
试验数据采用Excel 2003整理后,采用SPSS 17.0中的one⁃way ANOVA程序进行单因素方差分析,用Duncan氏法进行多重比较检验,用Pear⁃ son氏法进行相关性分析。
2 结果与分析
2.1 不同真菌发酵对油菜秸秆养分含量影响
由表1可知,不同真菌发酵对油菜秸秆常规养分含量均有显著影响(P<0.05)。与对照组相比,P.chrysosporium组、L.edodes组油菜秸秆的CP含量分别提高了83%和104%,而P.acerina组CP含量降低了33%,C.subvermispora组CP含量无显著变化(P>0.05)。L.edodes组和P.chrysosporium组较对照组显著降低了油菜秸秆NDF、ADF、纤维素、ADL的含量(P<0.05),P.acerina组和C.sub⁃vermispora组在这些指标上与对照组差异不显著(P>0.05)。与对照组相比,试验组显著提高了油菜秸秆的几丁质含量(P<0.05),其中以L.edodes组和P.chrysosporium组较高,P.acerina组最少,但也较对照组高出206%。

表1 不同真菌发酵对油菜秸秆养分含量的影响(干物质基础)Table 1 Effects of different fungi fermentations on nutrient contents of rape straw(DM basis) %
2.2 不同真菌发酵后油菜秸秆的养分降解率
由表2可知,不同真菌发酵对油菜秸秆体外瘤胃养分降解率有显著影响(P<0.05)。油菜秸秆DM、OM、NDF、ADF、ADL的降解率表现为L.edodes组>P.chrysosporium组>P.acerina组和C. subvermispora组,差异显著(P<0.05);半纤维素降解率L.edodes组显著高于P.acerina组和C.sub⁃vermispora组(P<0.05),与次之的P.chrysospori⁃um组差异不显著(P<0.05);纤维素降解率表现为L.edodes组和P.chrysosporium组>P.acerina组和C.subvermispora组,差异显著(P<0.05)。

表2 不同真菌发酵后油菜秸秆的养分降解率(干物质基础)Table 2 Nutrient degradation rates of rape straw fermented by different fungus(DM basis) %
2.3 不同真菌发酵后油菜秸秆的酶活性
由表3可知,在油菜秸秆真菌发酵液中,锰过氧化物酶活性表现为L.edodes组>P.chrysosporium组>P.acerina组和C.subvermispora组,差异显著(P<0.05)。对于羧甲基纤维素酶的活性,P.aceri⁃na组显著低于其他试验组(P<0.05),其余试验组间无显著差异(P>0.05)。

表3 不同真菌发酵后油菜秸秆的酶活性Table 3 Enzyme activities of rape straw fermented by different fungus U/L
2.4 不同真菌发酵对发酵油菜秸秆IVOMD及有机物酶解率的影响
由表4可知,不同真菌发酵显著影响油菜秸秆IVOMD和有机物酶解率(P<0.05)。与对照组相比,L.edodes和P.chrysosporium发酵使IVOMD 由0.28分别增加到0.42和0.39,有机物酶解率由0.27分别增加到0.38和0.33,差异均显著(P<0.05);然而,P.acerina发酵后则使IVOMD和有机物酶解率分别由0.28和0.27降到了0.14和0.20,差异显著(P<0.05);C.subvermispora发酵不影响IVOMD,但显著降低了有机物酶解率(P<0.05)。
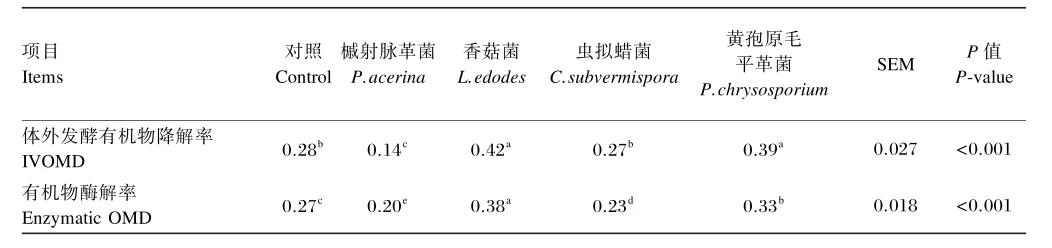
表4 不同真菌发酵对发酵油菜秸秆IVOMD及有机物酶解率的影响(干物质基础)Table 4 Effects of different fungi fermentations on IVOMD and enzymatic OMD of fermented rape straws(DM basis) %
3 讨 论
3.1 不同真菌发酵对油菜秸秆养分含量影响
本研究结果显示,不同真菌固态发酵50 d后,各试验组OM含量均降低,其中L.edodes组和P.chrysosporium组降解率最高,达到65.23%和52.97%。L.edodes和P.chrysosporium发酵后的油菜秸秆中CP含量显著升高,这可能由于一部分糖类被降解,导致了OM的损失。这与Tuyen等[15]的研究结果一致。此外,油菜秸秆中CP含量的增加还可能是由于有氧发酵吸收空气中的氮产生菌体蛋白导致的[16]。然而,在本研究中同对照组相比,P.acerina组的CP含量降低了,这同在其他的农副产品上的研究不一致[15,17]。这可能是由于P.acerina组的残余秸秆中分泌的水溶性蛋白质或胞外蛋白酶导致的。Eriksson等[18]指出,如果真菌需要分泌大量的胞外蛋白酶去降解纤维物质,那么胞内蛋白质含量会偏低。此作者还指出由Spo⁃rotrichum pulverulentum产生的胞外蛋白酶可能占整个菌体蛋白的近30%。
在本研究中,L.edodes组和P.chrysosporium组油菜秸秆的IVOMD和有机物酶解率显著提高。然而,P.acerina组和C.subvermispora组的IVOMD和有机物酶解率较对照组反而有所降低。可能由于P.acerina在早期的生长过程中利用了油菜秸秆中的可直接利用的营养物质,同时后期又不能够很好的将木质素降解产生更多的可利用物质(比如多糖),从而导致降解率下降[19]。
3.2 不同真菌发酵对油菜秸秆酶活性和体外发酵有机物降解的影响
木质素是由3种苯丙烷结构[对羟苯基(H)、紫丁香基(S)、愈创木基(G)]聚合而成的复合物,并通过共价键与植物的半纤维素连接[19]。木质素的结构在不同植物种类中是不同的。例如,在麦秸的木质素中,H、G、S结构的比例分别为5%、49%和46%,但在玉米秸的木质素中,H、G、S结构的比例则分别为4%、35%和61%[20]。因此,油菜秸秆和其他大量的生物原料中不同结构的木质素可能导致了即使用相同菌发酵而木质素的降解率不同,Okano等[21]研究证实了此观点。
有研究表明,L.edodes和P.chrysosporium,有很强的木质纤维素降解能力[7,22],与本研究结果一致。Tripathi等[23]利用真菌将芥末杆转化成瘤胃可利用物质能量物质,发现P.chrysosporium降解ADL是最有效的,经过35 d发酵,降解大约40%的有机物。本试验中,L.edodes组和P.chrysospo⁃rium组的ADL降解率显著高于C.subvermispora组和P.acerina组。L.edodes组和P.chrysosporium组锰过氧化物酶活性显著大于P.acerina组和C.subvermispora组,这同试验中这2种菌产生更高的ADL降解率相符。真菌通过木质素酶分解木质素以及改变木质纤维素结构。很多研究报道,L.edodes和P.chrysosporium在很多木质素材料上能够产生较强的木质素降解酶活性。Orth等[24]研究发现,在橡树木屑中L.edodes较P.chrysosporium显示出更高的锰过氧化物酶活性,这与本研究结果一致。De Souza⁃Cruz等[25]用C.subvermispora分解木头时发现锰过氧化物酶是其最主要的木质素降解酶,而本试验中C.subvermispora组锰过氧化物酶含量很低,这与本试验不符,这种差异可能是由于培养条件不同造成的,包括培养基、温度、pH、农业原料等[26]。关于P.acerina的酶活特性研究非常少。Gill等[27]比较性的研究了P.chry⁃sosporium和Phlebia属(P.fascicularia、P.floriden⁃sis、P.radiate)的木质素降解酶活性,发现所有的Phlebia属都能产生锰过氧化物酶。而本研究中,经过50 d的培养P.acerina中的锰过氧化物酶活性较低。
3.3 不同真菌发酵对油菜秸秆几丁质含量影响
几丁质是真菌细胞壁的基本成分,难被微生物降解,还可能影响其他细胞壁成分的降解[28]。同时,有研究表明几丁质具有提高机体免疫能力[29],抑制肿瘤的作用[30-31]。真菌菌丝生长及渗透进入秸秆基质致使几丁质含量增多[32]。本研究中,真菌发酵的油菜秸秆的几丁质含量都提高。P.acerina组的几丁质含量为1.90 mg/g,显著高于对照组。它们覆盖在油菜秸秆表面,在一定程度上可能阻碍了油菜秸秆的进一步降解,可能导致了油菜秸秆降解率降低。本试验中还发现,对照组的油菜秸秆中也检测到几丁质,这可能是由于油菜秸秆本身包含有少量的葡萄糖胺。
4 结 论
L.edodes和P.chrysosporium发酵油菜秸秆能够降解纤维物质,改善IVOMD,但同时导致了有机物的浪费。
参考文献:
[1] 赵蒙蒙,姜曼,周祚万.几种农作物秸秆的成分分析[J].材料导报B:研究篇,2011,25(8):122-125.
[2] 曹国良,张小曳,王亚强,等.中国区域农田秸秆露天焚烧排放量的估算[J].科学通报,2007,52(15):1826-1831.
[3] RAMIREZ⁃BRIBIESCA J E,WANG Y,JIN L,et al.Chemical characterization and in vitro fermentation of Brassica straw treated with the aerobic fungus,Trametes versicolor[J].Canadian Journal of Animal Science,2011,91(4):695-702.
[4] 张文杰,李琦华,柴艳.秸秆处理方法的研究进展[J].中国畜牧兽医,2011,38(7):30-33.
[5] SHARMA R K,ARORA D S.Production of lignocel⁃lulolytic enzymes and enhancement of in vitro digesti⁃bility during solid state fermentation of wheat straw by Phlebia floridensis[J].Bioresource Technology,2010,101(23):9248-9253.
[6] ARORA D S,GILL P K.Production of ligninolytic en⁃zymes by Phlebia floridensis[J].World Journal of Microbiology and Biotechnology,2005,21(6/7):1021-1028.
[7] SHARMA R K,ARORA D S.Changes in biochemical constituents of paddy straw during degradation by white rot fungi and its impact on in vitro digestibility [J].Journal of Applied Microbiology,2010,109(2):679-686.
[8] ARORA D S,SHARMA R K.Comparative ligninolyt⁃ic potential of Phlebia species and their role in im⁃provement of in vitro digestibility of wheat straw[J].Journal of Animal and Feed Sciences,2009,18(1):151-161.
[9] VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutri⁃tion[J].Journal of Dairy Science,1991,74(10):3583-3597.
[10] CHEN G C,JOHNSON B R.Improved colorimetric determination of cell wall chitin in wood decay fungi [J].Applied and Environmental Microbiology,1983,46(1):13-16.
[11] SHRIVASTAVA B,THAKUR S,KHASA Y P,et al.White⁃rot fungal conversion of wheat straw to energy rich cattle feed[J].Biodegradation,2011,22(4):823-831.
[12] WARIISHI H,VALLI K,GOLD M H.Manganese(Ⅱ)oxidation by manganese peroxidase from the ba⁃sidiomycete Phanerochaete chrysosporium.Kinetic mechanisms and role of chelators[J].The Journal of Biological Chemistry,1992,267(33):23688-23695.
[13] CONE J W,VAN GELDER A H,VISSCHER G J W,et al.Influence of rumen fluid and substrate con⁃centration on fermentation kinetics measured with a fully automated time related gas production apparatus [J].Animal Feed Science and Technology,1996,61 (1/2/3/4):113-128.
[14] RAHMAN M M,LOURENÇO M,HASSIM H A,et al.Improving ruminal degradability of oil palm fronds using white rot fungi[J].Animal Feed Science and Technology,2011,169(3/4):157-166.
[15] TUYEN D V,PHUONG H N,CONE J W,et al.Effect of fungal treatments of fibrous agricultural byproducts on chemical composition and in vitro rumen fermentation and methane production[J].Bioresource Technology,2013,129:256-263.
[16] ABO⁃DONIA F M,ABDEL⁃AZIM S N,ELGHAN⁃DOUR M M Y,et al.Feed intake,nutrient digestibility and ruminal fermentation activities in sheep⁃fed peanut hulls treated with Trichoderma viride or urea[J].Tropical Animal Health and Production,2014,46(1):221-228.
[17] TUYEN V D,CONE J W,BAARS J J P,et al.Fungal strain and incubation period affect chemical composi⁃tion and nutrient availability of wheat straw for rumen fermentation[J].Bioresource Technology,2012,111:336-342.
[18] ERIKSSON K⁃E,LARSSON K.Fermentation of waste mechanical fibers from a newsprint mill by the rot fun⁃gus Sporotrichum pulverulentum[J].Biotechnology and Bioengineering,1975,17(3):327-348.
[19] ZHAO X H,GONG J M,ZHOU S,et al.Effect of fungal treatments of rape straw on chemical composi⁃tion and in vitro rumen fermentation characteristics [J].BioResources,2015,10(1),622-637.
[20] GHAFFAR S H,FAN M Z.Structural analysis for lig⁃nin characteristics in biomass straw[J].Biomass and Bioenergy,2013,57:264-279.
[21] GHAFFAR S H,FAN M Z.Lignin in straw and its ap⁃plications as an adhesive[J].International Journal of Adhesion and Adhesives,2014,48:92-101.
[22] OKANO K,IIDA Y,SAMSURI M,et al.Comparison of in vitro digestibility and chemical composition a⁃mong sugarcane bagasses treated by four white⁃rotfungi[J].Animal Science Journal,2006,77(3):308-313.
[23] 王宏勋,杜甫佑,张晓昱.白腐菌选择性降解秸秆木质纤维素研究[J].华中科技大学学报:自然科学版,2006,34(3):97-100.
[24] TRIPATHI M K,MISHRA A S,MISRA A K,et al.Selection of white⁃rot basidiomycetes for bioconver⁃sion of mustard(Brassica compestris)straw under solid⁃state fermentation into energy substrate for ru⁃men micro⁃organism[J].Letters in Applied Microbiol⁃ogy,2008,46(3):364-370.
[25] DE SOUZA⁃CRUZ P B,FREER J,SIIKA⁃AHO M,et al.Extraction and determination of enzymes produced by Ceriporiopsis subvermispora during biopulping of Pinus taeda wood chips[J].Enzyme and Microbial Technology,2004,34(3/4):228-234.
[26] ORTH A B,ROYSE D J,TIEN M.Ubiquity of lignin⁃degrading peroxidases among various wood⁃degrading fungi[J].Applied and Environmental Microbiology,1993,59(12):4017-4023.
[27] GILL P,ARORA D.Effect of culture conditions on manganese peroxidase production and activity by some white rot fungi[J].Journal of Industrial Microbiology and Biotechnology,2003,30(1):28-33.
[28] ARORA D S,CHANDER M,GILL P K.Involvement of lignin peroxidase,manganese peroxidase and lacca⁃se in degradation and selective ligninolysis of wheat straw[J].International Biodeterioration&Biodegrada⁃tion,2002,50(2):115-120.
[29] ORPIN C G.The occurrence of chitin in the cell walls of the rumen organisms Neocallimastix frontalis,Pi⁃romonas communis and Sphaeromonas communis[J].Journal of General Microbiology,1977,99(1):215-218.
[30] 周锐丽,陈轶.甲壳素、壳聚糖的保健功能及应用展望[J].中国食物与营养,2013,19(11):65-69.
[31] TOKORO A,SUZUKI K,MATSUMOTO T,et al.Chemotactic response of human neutrophils to N⁃ace⁃tyl chitohexaose in vitro[J].Microbiology and Immu⁃nology,1988,32(4):387-395.
[32] 文镜,吕菁菁,戎卫华,等.低聚壳聚糖抑制肿瘤作用的实验观察[J].食品科学,2002,23(8):249-251.
[33] AGOSIN E,MONTIES B,ODIER E.Structural chan⁃ges in wheat straw components during decay by lignin⁃degrading white⁃rot fungi in relation to improvement of digestibility for uminants[J].Journal of the Science of Food and Agriculture,1985,36(10):925-935.
Effects of Different Fungi Fermentations on Nutrient Contents,Enzyme Activities and in Vitro Fermentation Organic Matter Degradation Rate of Rape Straw
GONG Jianming ZHAO Xianghui
∗
ZHOU Shan FU Chuanbian LIU Chanjuan QU Mingren
∗∗
(责任编辑 王智航)
(Jiangxi Province Key Laboratory of Animal Nutrition/Engineering Research Center of Feed Development,College of Animal Science and Technology,Jiangxi Agricultural University,Nanchang 330045,China)
∗Contributed equally
∗∗Corresponding author,professor,E⁃mail:qumingren@sina.com
Abstract:To improve the utilization of rape straw and screen appropriate strains for fermentation of rape straw,solid state fermentation by four fungus(P.chrysosporium,L.edodes,C.subvermispora and P.acerina)and single fermentation without fungus(control)of rape straw were carried out for 50 days.Nutrient contents,nutrient degradation rates,manganese peroxidase and carboxymethyl cellulase activities,in vitro fermentation organic matter degradation rate(IVOMD)and enzymatic organic matter degradation rate were determined.The results showed as follows:1)different fungi fermentations significantly changed nutrient contents of rape straw (P<0.05),the fermentation of L.edodes、C.subvermispora、P.chrysosporium significantly increased crude pro⁃tein content(P<0.05);2)the content of chitin,a beneficial ingredient,was improved in rape straw incubated with four strains of fungus;3)the degradation rates of dry matter,organic matter,neutral detergent fiber,acid detergent fiber,acid detergent lignin showed L.edodes group>P.chrysosporium group>P.acerina group and C.subvermispora group,and the differences were significant(P<0.05);4)manganese peroxidase activity showed L.edodes group>P.chrysosporium group>P.acerina group and C.subvermispora group,and the differ⁃ences were significant(P<0.05);carboxymethyl cellulase activity in P.acerina group was significantly lower than the other experimental groups(P<0.05);5)compared with control group,the fermentation of L.edodes and P.chrysosporium significantly increased IVOMD(P<0.05),and that of P.acerina significantly decreased enzymatic organic matter degradation rate(P<0.05).In summary,the fermentation of rape straw by L.edodes and P.chrysosporium can degrade fibrous matter,and improve IVOMD,however,meanwhile,results in waste of organic matter.[Chinese Journal of Animal Nutrition,2015,27(7):2309⁃2316]
Key words:rape straw;white rot fungi;degradation rate;in vitro fermentation;chitin;enzyme activity
作者简介:龚剑明(1989—),男,江西抚州人,硕士研究生,从事反刍动物营养研究。E⁃mail:919838792@qq.com
基金项目:公益性行业(农业)科研专项(201303143,20150133);国家肉牛牦牛产业技术体系(CARS⁃38);赣鄱555领军人才培养计划
收稿日期:2015-01-28
doi:10.3969/j.issn.1006⁃267x.2015.07.039
文章编号:1006⁃267X(2015)07⁃2309⁃08
文献标识码:A
中图分类号:S816.6

