NLRP3炎症小体在早期动脉粥样硬化ZDF大鼠中的表达及阿托伐他汀的干预
研究报告
NLRP3炎症小体在早期动脉粥样硬化ZDF大鼠中的表达及阿托伐他汀的干预
马全鑫1,杨钦钦1,陆晔枫2,陈小真1,陈诚1,寿旗扬1,蔡月琴1,陈民利1
(1.浙江中医药大学动物实验研究中心/比较医学研究中心,杭州310053;2.扬州大学兽医学院,扬州225009)
【摘要】目的观察NLRP3炎症小体及其介导的炎症因子在早期动脉粥样硬化(AS)Zucker糖尿病肥胖(ZDF)大鼠主动脉组织中的表达,以及阿托伐他汀(ATV)的干预作用。方法高脂饲喂联合小剂量多次注射VD3建立ZDF大鼠早期AS模型,并给予ATV干预;检测血糖血脂、胰岛素、ox-LDL和hsCRP,并进行主动脉组织病理学检查和NLRP3、caspase 1、IL-1β和TNF-α基因表达的检测。结果高脂饲喂后ZDF大鼠血糖、血脂、胰岛素和ox-LDL水平均显著上升(P<0.05)。注射VD3后,hsCRP水平均显著上升(P<0.05),主动脉组织出现明显的早期AS病变,且NLRP3、caspase 1、IL-1β和TNF-α基因表达显著上调(P<0.05),而ATV组ZDF大鼠血脂、ox-LDL和hsCRP水平均明显下降(P<0.05),AS病变程度减轻,且主动脉组织中NLRP3、Caspase 1、IL-1β和TNF-α基因表达显著下调(P<0.05)。结论 NLPR3炎症小体及其介导的炎症因子参与了ZDF大鼠早期AS的炎症反应,而ATV可抑制NLRP3炎症小体的表达,抑制AS的炎症反应。
【关键词】动脉粥样硬化;NLRP3炎症小体;2型糖尿病;ZDF大鼠
[基金项目]浙江省自然科学基金(LY12C04002)。
[作者简介]马全鑫(1988-),男,在读硕士研究生,研究方向:中药药理与比较医学,E-mail: mqx1025@hotmail.com。
[通讯作者]陈民利(1963-),女,教授、硕士,研究方向:实验动物与比较医学,E-mail: cmli991@126.com。
【中图分类号】R33【文献标识码】 A
doi:10.3969.j.issn.1671.7856. 2015.002.001
Expression of NLRP3 inflammasome in early atherosclerosis ZDF
rats and intervention effect of atorvastatin
MA Quan-xin1, YANG Qin-qin1, LU Ye-feng2, CHEN Xiao-zhen1, CHEN Cheng1,
SHOU Qi-yang1, CAI Yue-qin1, CHEN Min-li1
(1.Laboratory Animal Research Center, Zhejiang Chinese Medical University, Hangzhou 310053, China;
2.College of Veterinary Medicine, Yangzhou University, Jiangsu,Yangzhou225009 )
Abstract【】ObjectiveTo observe the expression of NLRP3 inflammasome and its mediated inflammatory factors in the aorta of Zuker diabetic fatty (ZDF) rats with early atherosclerosis(AS), and observe the intervention effect of atorvastatin. MethodsZDF rats models of type 2 diabetes mellitus(T2DM) and AS were established by feeding high-fat diet accompanied with multiple injections of vitamin D3(VD3). Meanwhile, half of these rats were also given atorvastatin(ATV). Changes of serum glucose, lipids, insulin, ox-LDL and hsCRP were tested. Morphological changes of aorta tissues were examined by histopathology. The gene expressions of NLRP3 and some other inflammatory mediators were also quantified. Results After feeding high-fat diet, the glucose, lipids, insulin and ox-LDL levels of ZDF rats in the model group were significantly increased(P<0.05).After VD3 injecting, pathological changes also occurred in the early stage AS. Moreover, the hsCRP level was increased along with elevated gene expressions of NLRP3, caspase 1, IL-1β and TNF-α in the aorta tissues (P<0.05). Nevertheless, the serum glucose, lipids, insulin, ox-LDL and hsCRP levels in ZDF rats of the ATV group were significantly decreased (P<0.05). The pathological changes were attenuated and gene expressions of NLRP3, caspase-1, IL-1β and TNF-α in the aorta tissues also significantly reduced (P<0.05). ConclusionsNLPR3 inflammasome and its mediated inflammatory mediators participate in the inflammatory responses during the early AS development. ATV can inhibit the gene expression of NLRP3 inflammasome, and alleviate the inflammatory responses during atherosclerosis.
【Key words】Atherosclerosis;NLRP3 inflammasome;Type 2 diabetes mellitus; Zuker diabetic fatty rats
动脉粥样硬化(AS)不仅是2型糖尿病(T2DM)中最常见的大血管并发症,也是T2DM患者致残致死的重要原因[1]。近来,越来越多的研究者认为炎症是AS和糖尿病共同的病理基础,NOD样受体蛋白3(NLRP3)炎症小体是其中重要的调控因子[2]。NLRP3炎症小体是一种蛋白质复合体,作为固有免疫的重要组分不仅在炎症反应中发挥了关键作用,而且是连接炎症与代谢性疾病的桥梁:由NLRP3介导产生的白介素(IL)-1β和IL-18会干扰胰岛素的信号传导而导致胰岛素抵抗,同时IL-1β使得动脉粥样硬化斑块易于破裂[3]。因此,作为炎症反应的核心,NLRP3炎症小体可能为防治T2DM并发AS提供新的靶点。阿托伐他汀(ATV)是临床常用的抗AS药物,具有一定的抗炎作用。目前尚无关于ATV对NLRP3炎症小体干预作用的报道,且NLRP3炎症小体在T2DM并发AS动物模型中的研究较少。Zucker糖尿病肥胖(ZDF)大鼠是由Zucker肥胖(ZF)大鼠近交后得到的高血糖品系,为常用的T2DM疾病模型[4],且伴有血管病变与炎症反应[5]。本文采用高脂饮食联合维生素D3(VD3)建立ZDF大鼠T2DM并发早期AS模型,研究NLRP3炎症小体及其介导的相关炎症因子在主动脉组织中的表达特点以及ATV的干预作用。
1材料和方法
1.1实验动物及实验环境
SPF级7~8周龄雄性ZDF大鼠12只及同周龄的雄性Zucker瘦型(ZL)大鼠6只,由北京维通利华实验动物技术有限公司提供【SCXK(京)2012-0001】;饲养于浙江中医药大学动物实验研究中心屏障实验室【SYXK(浙)2013-184】,环境温度:(22±2)℃,相对湿度:50%~60%,光照: 12h/12h明暗交替,噪声<50 db;每笼IVC笼内饲养2只大鼠,自由饮食,并在试验过程中按实验动物使用的“3R”原则给以人道主义关怀,并在适应性饲养1周后进行正式实验。
高脂饲料配方:胆固醇1%、起酥油10%、蛋黄粉10%、3号胆盐0.5%、基础饲料78.5%。
1.2试剂与仪器
VD3注射液,购自上海通用药业股份有限公司;ATV钙片,辉瑞制药有限公司生产;RNA提取试剂盒和荧光定量试剂盒均购自宝生物工程(大连)有限公司;大鼠超敏C反应蛋白(hsCRP) ELISA试剂盒,购自杭州诚维生物科技有限公司;大鼠胰岛素检测试剂盒,购自ALPCO公司。诊断检测试剂购自上海申能-德赛诊断技术有限公司;CD68+抗体(ab31630)购自abcam公司。7020型全自动生化分析仪(日本日立公司),实时荧光定量PCR仪(美国Bio-Rad公司);Thermo光谱扫描多功能酶标仪(美国Thermo公司),ST5010染色机(德国Leica公司),80I相差显微镜(日本Nikon公司)。
1.3动物实验
取ZDF大鼠12只,连续高脂饲喂4周后,进行眼眶静脉丛取血,测定血清胆固醇(CHOL)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、血糖(GLU)、高密度脂蛋白胆固醇(HDL-C)。根据血脂血糖及体重,分为模型组(model group)和ATV组(ATV group),每组6只;另取6只ZL大鼠饲喂基础饲料,作为正常对照组(control group)。ATV组ZDF大鼠每天经口灌服5 mg/kg ATV,模型组和正常对照组每天给予10 mL/kg蒸馏水。模型组与ATV组大鼠继续饲喂高脂饲料,并经腹腔注射60万IU/kg VD3(分3次,每隔3 d注射1次)。
1.4指标测定
1.4.1血液生化指标测定:在首次注射VD3后2,4,6周时,将所有大鼠禁食12 h后经眼眶静脉取血1 mL,分离血清,使用全自动生化仪检测GLU、CHOL、TG、LDL-C、HDL-C水平,并计算动脉粥样硬化指数(AI),AI=(CHOL-HDL-C)/HDL-C。利用ELISA试剂盒,检测hsCRP、胰岛素和ox-LDL的含量。
1.4.2主动脉病理组织学观察[6]:首次注射VD36周后麻醉并处死动物,经左心室预冷PBS冲洗,紧贴升主动脉根部断离心脏,立即放入4%中性甲醛中固定48 h后,从心耳下冠状面剖切心脏。将心脏升主动脉根部切面向下包埋,用石蜡切片机将主动脉窦部切成4 μm薄片,苏木素-伊红(HE)染色,光学显微镜下观察病理变化并拍照。
采用免疫组化染色方法检测主动脉组织中巨噬细胞的浸润。石蜡切片置于60℃培养箱烘烤1 h,脱蜡至水,3%过氧化氢溶液15 min阻断内源性过氧化物酶,与anti-CD68+一抗孵育,置于4℃冰箱过夜。冲洗后与二抗结合15 min,DAB显色,苏木素复染,脱水封片。巨噬细胞被标记为棕黄色。
1.4.3主动脉组织NLRP3及相关炎症因子mRNA的表达测定:取冻存主动脉组织40 mg~60 mg,提取总RNA并逆转录成cDNA。基因引物由上海生工生物公司设计并合成,引物序列见表1。将cDNA用RT-PCR仪进行二步法扩增,所有反应信息资料由Bio-Rad iQ5 PCR仪收集。反应体系为20 μL,包括2 μLcDNA溶液,10 μL SYBR®,每种引物1 μL(10 μmol/L)以及6 μL水。扩增条件:①95℃预变性10 min,② 95℃变性15 s,③ 60℃退火1 min,②③循环40次。GADPH管家基因作为内参对照,目的基因转录水平通过公式2-△△CT计算。
1.5统计学方法
2结果
2.1空腹血糖、糖化血红蛋白及胰岛素的变化
注射VD3前及首次注射后2、4、6周时,模型组与ATV干预组ZDF大鼠空腹血糖均显著升高(P<0.05),而模型组与ATV组之间差异无显著性 (P>0.05)。在0,6周时,模型组HbA1c及血清胰岛素均显著高于正常组(P<0.05),但ATV组与模型组之间差异无显著性 (P>0.05)(图1)。

表1 RT-PCR引物序列

注:与正常组相比, *P<0.05。与模型组相比, #P<0.05。 图1 大鼠血糖、糖化血红蛋白和血清胰岛素的变化 Note. Compared with the control group, *P<0.05. Compared with the model group, *P<0.05. Fig.1 Changes of GLU, HbA1c and insulin in the rats
2.2血脂与AS指数的变化
注射VD3前及首次注射后2、4、6周时,模型组ZDF大鼠血清总CHOL、LDL-C、TG和AI均高于正常组(P<0.05),而ATV组ZDF大鼠在首次注射VD3后第4、6周时CHOL和LDL-C水平均显著低于模型组(P<0.05),并在第4周时AI显著低于模型组(P<0.05(图2)。
2.3血清hsCRP和ox-LDL的改变
注射VD3前模型组、ATV组和正常组血清hsCRP差异无显著性 (P>0.05)。首次注射VD3后2,4,6周时,模型组大鼠血清hsCRP水平显著高于正常组(P<0.05)而ATV干预组血清hsCRP则显著低于模型组(P<0.05)。首次注射VD3后第6周模型组ZDF大鼠血清ox-LDL含量高于正常组(P<0.05),而ATV干预组ox-LDL显著低于模型组(P<0.05)(图3)。
2.4主动脉组织病理学观察
观察ZDF大鼠主动脉瓣部位AS形成情况。HE染色显示,正常组ZL大鼠内皮平滑,无明显增厚和炎性细胞浸润,平滑肌排列整齐;模型组ZDF大鼠主动脉瓣根部有泡沫细胞、胆固醇晶体聚集,平滑肌细胞排列紊乱,部分有钙化形成;而ATV干预组有少量泡沫细胞和胆固醇晶体形成。免疫组化结果显示,正常组大鼠主动脉组织中未见巨噬细胞浸润,模型组ZDF大鼠主动脉组织中有较多巨噬细胞浸润,而ATV组相比于模型组主动脉组织中巨噬细胞减少(图4,见封二)。
2.5主动脉组织NLRP3及相关炎症因子mRNA的表达
与正常组比,模型组大鼠主动脉组织中NLRP3、caspase 1、IL-1β和TNF-α的mRNA表达显著上调(P<0.05);而ATV干预组则显著下调上述基因的表达(P<0.05)。见图5。

注:与正常组相比, *P<0.05。与模型组相比, #P<0.05。 图2 大鼠血脂、LDL-C和AI指数的变化 Note. Compared with the control group, *P<0.05. Compared with the model group, #P<0.05. Fig.2 Changes of blood CHOL, LDL-C and AI index in the rats
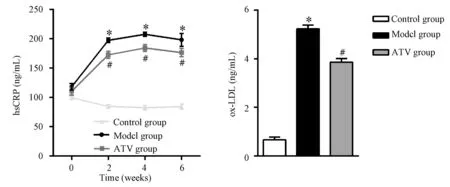
注:与正常组相比, *P<0.05。与模型组相比, #P<0.05。 图3 大鼠血清hsCRP与ox-LDL的变化 Note. Compared with the control group, *P<0.05. Compared with the model group, *P<0.05. Fig.3 Changes of serum hsCRP and ox-LDL in the rats
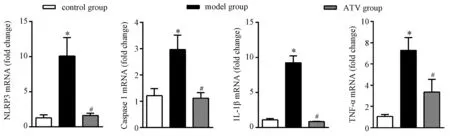
注:与正常组相比, *P<0.05。与模型组相比, #P<0.05。 图5 大鼠主动脉组织NLRP3与相关炎症介质mRNA的表达 Note. Compared with the control group, *P<0.05. Compared with the model group, *P<0.05. Fig.5 Expression of NLRP3 and related inflammatory mediators mRNA in the aorta tissue of rats
3讨论
AS是T2DM中常见的大血管并发症,发病率高达70%,是导致T2DM患者死亡的主要原因[7]。目前国内外多用ZDF大鼠作为研究T2DM及相关并发症的动物模型。ZDF大鼠因胰岛β细胞基因转录功能缺陷而导致胰岛素抵抗,在16~24周龄时,会出现冠状动脉和主动脉内皮细胞功能障碍[8]。啮齿类动物不易形成AS[9],但用大剂量注射VD3可形成钙超载,高钙协同高血脂破坏动脉管壁内皮的完整性,从而有利于血浆脂质对管壁的损伤、侵入和沉积,形成AS斑块[10],且VD3还能够激活机体相关炎症信号通路[11]。因此,高脂饲喂联合VD3注射是目前建立大鼠AS模型常用的方法[12]。本实验通过饲喂高脂饲料加速ZDF大鼠T2DM的发病进程,并在4周后阶段性注射VD3以促进AS的形成,建立早期AS模型。实验结果显示,ZDF大鼠高脂饲喂4周后体重、尿量、血脂、血糖、胰岛素水平均显著上升,表明出现典型的T2DM症状。此时,进行VD3注射并持续高脂饲喂,6周后模型组ZDF大鼠主动脉瓣根部内膜增厚,有泡沫细胞和巨噬细胞侵入和少量胆固醇晶体形成,部分动物出现钙化斑块,说明已形成早期的AS。
T2DM的特征症状为向心性肥胖,其脂肪组织被巨噬细胞浸润,产生大量的炎症介质。IL-1β、TNF-α等炎症因子对胰岛β细胞有毒害作用,加剧了糖尿病病症的恶化;同时,这些炎症因子释放进入血液,对主动脉内皮细胞造成损伤,诱发动脉粥样硬化斑块的产生[13,14]。实验显示,模型组在注射VD3前糖尿病症状明显,但血清hsCRP含量不高,炎症反应不严重。自注射VD3后2周起,随着hsCRP水平的上升、炎症反应的加剧,动脉粥样硬化指数也逐渐上升,呈一定的正相关性,提示T2PM中的炎症反应是诱发动脉粥样硬化的重要因素。给予ATV后,hsCRP水平显著降低,AS程度有一定的减轻,说明ATV有抗炎症反应及早期AS形成的作用。
T2DM与AS中的炎症反应受NLRP3炎症小体调控。NLRP3炎症小体复合物是由成核受体蛋白、凋亡相关斑点样蛋白包含半胱天冬酶募集域(ASC)和caspase 1组成,可被多种因子激活。NLRP3的激活包括2步:首先,氧化修饰的LDL被巨噬细胞的Toll样受体和清道夫受体识别,激活NF-κB通路,释放TNF-α和IL-1β前体等炎症因子。随后,AS病变产生的胆固醇晶体和T2DM中产生的胰岛淀粉样多肽(IAPP)寡聚物被巨噬细胞吞噬,引起溶酶体破裂,释放组织蛋白酶,组织蛋白酶可调节NLRP3的激活形成多聚体,产生成熟的IL-1β并释放到胞外,从而使免疫细胞的聚集,引起炎症反应和AS斑块的形成[15]。Duewell等[16]在ApoE缺陷小鼠中发现,ox-LDL与CHOL能激活NLRP3炎症小体,释放IL-1β,促进AS的形成;Jourdan等[17]利用ZDF大鼠阐述了胆固醇晶体激活NLRP3炎症小体,从而产生一系列的炎症反应导致胰岛细胞的死亡。本实验观察到,模型组ZDF大鼠血清中ox-LDL与CHOL含量显著上升,主动脉组织中NLRP3与caspase 1基因表达上调,而NLRP3炎症小体介导的炎症因子IL-1β和TNF-α表达同样上调。提示ZDF大鼠经高脂诱导后血清ox-LDL水平上升,刺激了IL-1β前体与TNF-α的产生;而TNF-α与主动脉组织中的CHOL晶体可激活NLRP3炎症小体,上调caspase 1的表达,促进IL-1β前体成熟并释放,加剧炎症反应,使AS病变程度进一步加深。而ATV干预后能明显降低ox-LDL水平并下调NLRP3及其相关炎症基因的表达,因此,ATV可能通过降低LDL的氧化修饰反应和抑制TNF-α的产生,并减少了主动脉组织中CHOL晶体的形成,抑制NLRP3炎症小体的激活,进而降低机体炎症反应,减轻AS的病变程度。
综上所述,高脂饮食联合VD3可诱导ZDF大鼠建立T2DM并发早期AS模型;该模型中NLRP3炎症小体及其调控的相关炎症介质基因表达显著上调,参与了T2DM与AS中的炎症反应;同时ATV能抗ZDF大鼠AS的形成并降低机体的炎症反应,可能与下调NLRP3及相关炎症介质有关;因此,该模型可用于T2DM与AS的发病机制研究,或作为NLRP3炎症小体靶向药物筛选的理想动物模型。
参考文献:
[1]润琳, 王芳, 王懿. 2型糖尿病患者颈动脉粥样硬化斑块形成的危险因素分析[J]. 陕西医学杂志, 2013, 42(10): 1358-1359.
[2]Masters SL, Latz E, O’Neill LAJ. The inflammasome in atherosclerosis and type 2 diabetes [J]. SciTransl Med, 2011, 3(81): 81ps17.
[3]毛开睿, 孙兵. NLRP3 炎症小体研究进展 [J]. 现代免疫学, 2011, 31(1): 1-4.
[4]奚赛飞, 斯徐伟, 朱科燕, 等. ZDF(fa/fa)大鼠的糖脂代谢特点与胰岛素抵抗特性 [J]. 实验动物与比较医学, 2014, 34(2): 102-106.
[5]Oltman CL, Davidson EP, Coppey LJ, et al. Vascular and neural dysfunction in Zucker diabetic fatty rats: a difficult condition to reverse [J]. Diabetes Obes Metab, 2008, 10(1): 64-74.
[6]晏沐阳, 翟永志, 刘博, 等. 高脂饮食ApoE基因敲除小鼠不同部位动脉粥样硬化斑块的分析比较 [J]. 中国比较医学杂志, 2008, 18(7): 9-12.
[7]戴尧, 陈明卫, 张超学, 等. 持续 6 年胰岛素强化治疗对2型糖尿病患者血清炎症因子及颈动脉内-中膜厚度影响的观察[J]. 中国糖尿病杂志, 2014,22 (5):417-419.
[8]Chinen I, Shimabukuro M, Yamakawa K, et al. Vascular lipotoxicity: endothelial dysfunction via fatty-acid-induced reactive oxygen species over production in obese Zucker diabetic fatty rats [J]. Endocrinology, 2007, 148(1): 160-165.
[9]马毅超, 潘永明, 陈亮, 等. 胰岛素抵抗动脉粥样硬化小型猪模型的研究 [J]. 中国比较医学杂志, 2014, 24(1): 12-17.
[10]Zittermann A, F Gummert J, Borgermann J. The role of vitamin D in dyslipidemia and cardiovascular disease [J]. Curr Pharm Design, 2011, 17(9): 933-942.
[11]Gohil P, Solanki P. Role of vitamin D in human diseases and disorders-An overview [J]. Int J Pharmacol Res, 2014, 4(2): 34-42.
[12]李迎新,黄霖. 动脉粥样硬化动物模型制作方法的介绍[J]. 中国比较医学杂志, 2008, 18(5): 70-73.
[13]Donath MY, Shoelson SE. Type 2 diabetes as an inflammatory disease[J]. Nat Rev Immunol, 2011, 11(2): 98-107.
[14]DeFronzo RA. Insulin resistance, lipotoxicity, type 2 diabetes and atherosclerosis: the missing links. The Claude Bernard Lecture 2009[J]. Diabetologia, 2010, 53(7):1270-1287.
[15]De Nardo D, Latz E. NLRP3 inflammasomes link inflammation and metabolic disease [J]. Trends Immunol, 2011, 32(8): 373-379.
[16]Duewell P, Kono H, Rayner K J, et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals[J]. Nature, 2010, 464(7293): 1357-1361.
[17]Jourdan T, Godlewski G, Cinar R, et al. Activation of the Nlrp3 inflammasome in infiltrating macrophages by endocannabinoids mediates beta cell loss in type 2 diabetes[J].Nat Med, 2013, 19(9): 1132-1140.
〔修回日期〕2014-11-28
更正
《中国比较医学杂志》2014年12月第24卷第12期《LP小鼠突变基因的定位及鉴定》, 第四作者李怡单位(中文)由原来的“扬州大学比较医学中心”变更为“南京师范大学”,特此更正。

