p38信号通路对急性重症胰腺炎大鼠大脑皮层COX-2表达的影响
蒙国光,李广洲,张宇新(唐山市丰润区人民医院,河北唐山063000;河北联合大学解剖学教研室)
p38信号通路对急性重症胰腺炎大鼠大脑皮层COX-2表达的影响
蒙国光1,李广洲1,张宇新2
(1唐山市丰润区人民医院,河北唐山063000;2河北联合大学解剖学教研室)
摘要:目的观察p38信号通路对急性重症胰腺炎(SAP)大鼠大脑皮层环氧合酶2(COX-2)表达的影响。方法将45只大鼠随机分为模型组、抑制剂组、假手术组各15只。抑制剂组、模型组分别将5%牛磺胆酸钠经胰胆管逆行注入胰腺制备SAP大鼠模型,造模后5min于大鼠尾静脉分别注射p38信号通路抑制剂SB203580及等量生理盐水;假手术组开腹后翻动胰腺数次立即缝合腹壁,尾静脉注射等量生理盐水。各组于造模后24 h断头取脑,采用Western blot法检测大脑皮层COX-2和磷酸化p38(p-p38),计算其平均光密度(IOD)值。结果抑制剂组pp38、COX-2蛋白表达的IOD值分别为7.5±0.9、7.5±1.1,模型组分别为18.3±1.3、13.3±3.0,假手术组分别为2.1±0.3、5.3±1.0;三组间两两比较,P均<0.05。相关分析显示,p-p38与COX-2蛋白表达呈正相关(r =0.661,P<0.05)。结论p38信号通路具有调控SAP大鼠皮层COX-2表达的作用,抑制该通路可下调COX-2表达。
关键词:胰腺炎;脑损伤; p38信号通路;环氧化酶2
脑损伤是急性重症胰腺炎(SAP)的一种致死性并发症,其发病机制尚不明确[1]。研究发现,炎症参与了脑损伤后神经元的凋亡过程[2,3]。炎症反应受p38信号通路调控,参与SAP的病理生理过程[4]。环氧合酶2(COX-2)作为炎症因子前列腺素合成的限速酶,在SAP脑损伤中可能起重要作用。2010年9月~2011年10月,我们给予SAP模型大鼠尾静脉注射p38信号通路抑制剂,观察其对大脑皮层COX-2表达的影响。现报告如下。
1 材料与方法
1.1材料健康雄性SD大鼠45只,体质量270~310 g,购于北京维通利华实验动物技术有限公司;自由进食、饮水,室温(25±2)℃,单笼喂养,自然光照。5%牛磺胆酸钠、p38信号通路抑制剂射SB203580(Sigma公司),兔抗人COX-2多克隆抗体(Cayman公司),兔抗鼠磷酸化p38(p-p38)多克隆抗体(北京博奥森),浓缩型免疫组化试剂盒(福州迈新)。
1.2动物分组与模型制备将大鼠随机分为模型组、抑制剂组和假手术组各15只。模型组和抑制剂组参照文献[5]方法,将5%牛磺胆酸钠(2mg/kg)经胰胆管内逆行注入胰腺制备SAP大鼠模型,造模后5min分别于大鼠尾静脉注射SB203580(10mg/kg)及等量生理盐水;假手术组开腹后翻动胰腺数次立即缝合腹壁,尾静脉注射等量生理盐水。
1.3大脑皮层组织p-p38、COX-2蛋白检测采用Western blot法。三组分别于造模后24 h腹腔注射10%水合氯醛麻醉,断头取脑。每组分别取30 μg皮层脑组织,匀浆,电泳,电转膜,加入封闭液,室温振荡2 h;依次加入一抗、生物素标记的二抗,室温孵育,加入辣根过氧化物酶复合物,DAB显色。以βactin作为内参,扫描条带,于38 kD和72 kD处观察p-p38和COX-2特异性蛋白条带;应用图像分析系统测定条带平均光密度(IOD)值,以此表示目的蛋白表达量。
1.4统计学方法采用SPSS13.0统计软件。计量资料以珋x±s表示,组间比较采用单因素方差分析;两变量间关系分析采用简单线性相关分析。P<0.05为差异有统计学意义。
2 结果
2.1各组p-p38、COX-2蛋白表达情况比较见图1及表1。
2.2 p-p38与COX-2蛋白表达的关系相关性分析显示,p-p38与COX-2蛋白表达呈正相关(r = 0.661,P<0.05)。
3 讨论
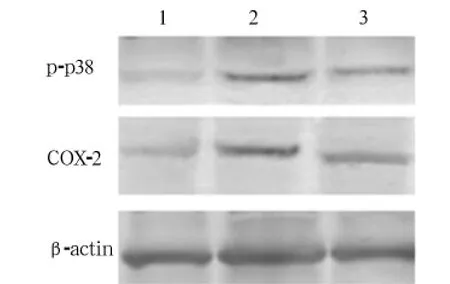
图1 各组p-p图38、COX-图2蛋白表达情况
表1 各组p-p38、COX-2蛋白IOD值比较()

表1 各组p-p38、COX-2蛋白IOD值比较()
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
组别p-p38 COX-2抑制剂组 7.5±0.9* # 7.5±1.1*#模型组 18.3±1.3* 13.3±3.0*假手术组2.1±0.3 5.3±1.0
SAP可引起脑损伤,表现为脑炎样的神经精神症状,其发病机制复杂,治疗效果差。研究发现,炎症因子前列腺素在SAP脑损伤过程中具有重要作用,能够导致血脑屏障通透性增高,破坏血脑屏障,引起脑组织损伤[6]。COX-2是前列腺素合成的关键酶。COX-2、前列腺素是炎症反应的重要生物学指标,在炎症过程中发挥重要作用[7,8]。脑内炎症反应如果持续过度存在,可引起神经元变性死亡。研究发现,抑制COX-2表达可改善脑损伤后的认知功能及运动功能障碍。本研究显示,模型组皮层区COX-2蛋白表达较假手术组明显增高,说明SAP可导致大鼠大脑皮层COX-2表达增加,炎性反应明显。但是,导致其高表达的原因尚不清楚。
p38信号通路是MAPK家族主要成员,主要参与应激反应、炎症中细胞信号的传递,在介导细胞增殖、生长、存活和凋亡过程中发挥重要作用[9~11]。文献报道,p38信号通路参与脑损伤后的炎症反应,并且对COX-2表达具有调控作用,抑制p38mAPK活化可减轻COX-2介导的炎症反应,有助于大脑神经元的存活[12]。相关性分析显示,p-p38与COX-2蛋白表达呈正相关;抑制组给予p38信号通路抑制剂后,p-p38蛋白水平明显下降,COX-2蛋白水平也显著降低。由此可见,p38信号通路通过调控COX-2表达来介导SAP大脑神经元的炎症反应,对神经元起毒性作用,抑制p38信号通路下调COX-2表达对大脑神经元具有一定的保护作用。
参考文献:
[1]Sharma V,Sharma R,Rana SS,et al.Pancreatic encephalopathy: an unusual cause of asterixis[J].JOP,2014,15(4): 383-384.
[2]Dal-Pizzol F,Tomasi CD,Ritter C.Septic encephalopathy:does inflammationdrive the brain crazy[J].Rev Bras Psiquiatr,2014,36(3): 251-258.
[3]Young GB.Encephalopathy of infection and systemic inflammation [J].J Clin Neurophysiol,2013,30(5): 454-461.
[4]Liu SH,Lu TH,Su CC,et al.Lotus leaf(Nelumbo nucifera)and its active constituents prevent inflammatory responses inmacrophages via JNK/NF-κB signaling pathway[J].Am J Chinmed,2014,42(4): 869-889.
[5]Lankisch PG,Ihse I.Bile-induced acute experimental pancreatitis [J].Scand J Gastroenterol,1987,22(3): 257-260.
[6]Montecucco F,Mach F,Lenglet S,et al.Treatment with Evasin-3 abrogates neutrophil-mediated inflammation inmouse acute pancreatitis[J].Eur J Clin Invest,2014,44(10): 940-950.
[7]Minghetti L.Cyclooxygenase-2(COX-2)in inflammatory anddegenerative braindisease[J].Neuropathol Exp Neurol,2004,63(9): 901-910.
[8]Cernak I,O'Connor C,Vink R.Activation of cyclo-oxygenase-2 contributes tomotor and cognitivedysfunction followingdiffuse traumatic brain injury in rats[J].Clin Exp Pharmacol Physiol,2001,28(11): 922-925.
[9]Wei L,Zhang Y,Yang C,et al.Neuroprotective effects of ebselen in traumatic brain injurymodel: involvement of nitric oxide and p38mitogen-activated protein kinase signalling pathway[J].Clin Exp Pharmacol Physiol,2014,41(2): 134-138.
[10]Evans J,Ko Y,Mata W,et al.Arachidonic acid induces brain endothelial cell apoptosis via p38-MAPK and intracellular calcium signaling[J].Microvasc Res,2014,89(5): 712-718.
[11]Yang C,Yu L,Kong L,et al.Pyrroloquinoline quinone(PQQ)inhibits lipopolysa-ccharide induced inflammation in part viadownregulated NF-κB and p38/JNK activation inmicroglial and attenuatesmicroglia activation in lipopolysaccharide treatmentmice[J].PLoS One,2014,9(10): 109502.
[12]Moon YJ,Lee JY,OhmS,et al.Inhibition of inflammation and oxidative stress by Angelicadahuricae radix extractdecreases apoptotic celldeath and improves functional recovery after spinal cord injury[J].J Neurosci Res,2012,90(1): 243-256.
收稿日期:( 2014-12-11)
基金项目:河北省唐山市科学技术研究与发展计划项目(111302069a)。
文章编号:1002-266X(2015)34-0026-02
文献标志码:A
中图分类号:R576
doi:10.3969/j.issn.1002-266X.2015.34.010

