自由基介导键环化合成吲哚酮的研究进展
周 栋1,李玉花1,邓佑林1,李志豪1,唐 石1,2
(1.吉首大学化学化工学院,湖南 吉首 416000;
2.中南大学化学化工学院,湖南 长沙 410083)
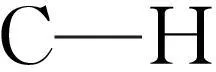

周栋1,李玉花1,邓佑林1,李志豪1,唐石1,2
(1.吉首大学化学化工学院,湖南 吉首 416000;
2.中南大学化学化工学院,湖南 长沙 410083)
摘要:吲哚酮及其衍生物广泛分布在自然界中,其合成方法研究是当前合成化学领域中的热点之一.按照偶联的方式及其相关的机理,对近几年来自由基介导键环化合成吲哚酮研究进行了归纳,从催化剂、氧化剂和溶剂等反应条件对反应体系的影响出发,讨论了键的切断方法.
关键词:自由基;键氧化反应;串联反应;氧化反应
吲哚酮及其衍生物是杂环化合物重要构筑骨架,在自然界中广泛存在,具有潜在重要生理活性,在材料科学、农业化学、医药学等领域中有广泛的应用[1-2].其合成方法研究是当前合成化学领域中的热点之一,近年来许多金属催化合成吲哚酮方法被发展出来,例如钯、铑等贵重过渡金属催化的吲哚酮.但是贵重过渡金属催化的合成方法存在明显缺点:(1)首先,贵金属催化剂价格昂贵,反应工业化受到限制;(2)从环境友好性方面看,传统的过渡金属催化对环境有一定的污染,这将直接对环境以及研究人员的健康造成危害,与绿色化学理念明显违背.因此,利用价格低廉,反应条件温和,对水和空气稳定的非贵重金属催化的自由基反应合成吲哚酮及其衍生物引起类众多化学家的浓厚研究兴趣,近几年来此研究领域得到了飞速发展,一系列具有重要实践价值的吲哚酮合成方法相续被报道[3-4].在这些报道的文献中,最主要包括2类方法:(1)自由基介导烷烃碳-氢键芳基化环化合成3-3-二取代吲哚酮;(2)自由基介导烯烃各种双官能团化环化合成3,3-二取代吲哚酮.
1脱氢偶联环化合成吲哚酮

1.1 碱催化分子内芳构化关环反应
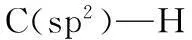

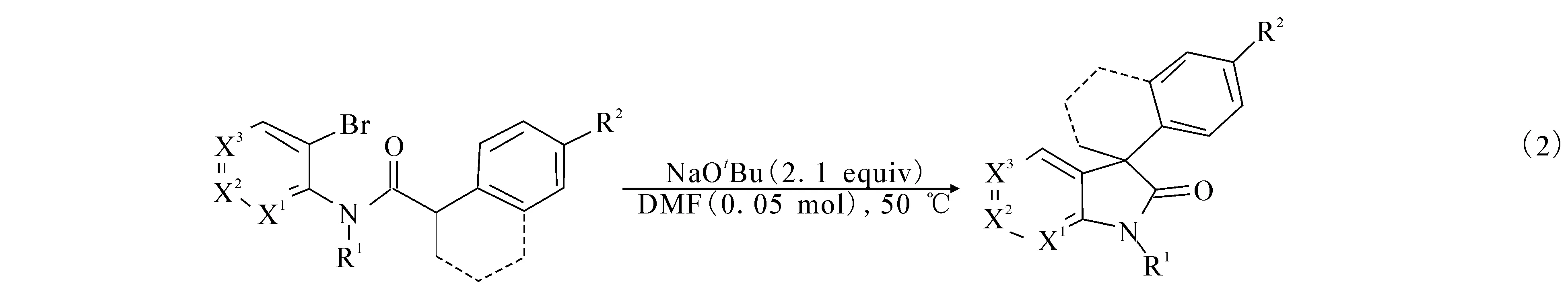
1.2 铜催化脱氢偶联环化反应
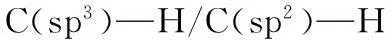


1.3.无金属催化脱氢偶联环化反应
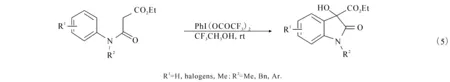

近3年来,数以万计的烯烃双管能团化合成吲哚酮的反应被报道出来,带各种活性官能基团的新型吲哚酮骨架被合成出来.这些研究结果大大丰富了吲哚酮类产物,为药物及材料科学提供许多新的先导化合物;同时有力推动了自由介导烯烃双能团化反应的发展,为杂环化化合物合成化学提供新的实践和理论基础.
2.1 烯烃卤芳基化(haloarylation)环化
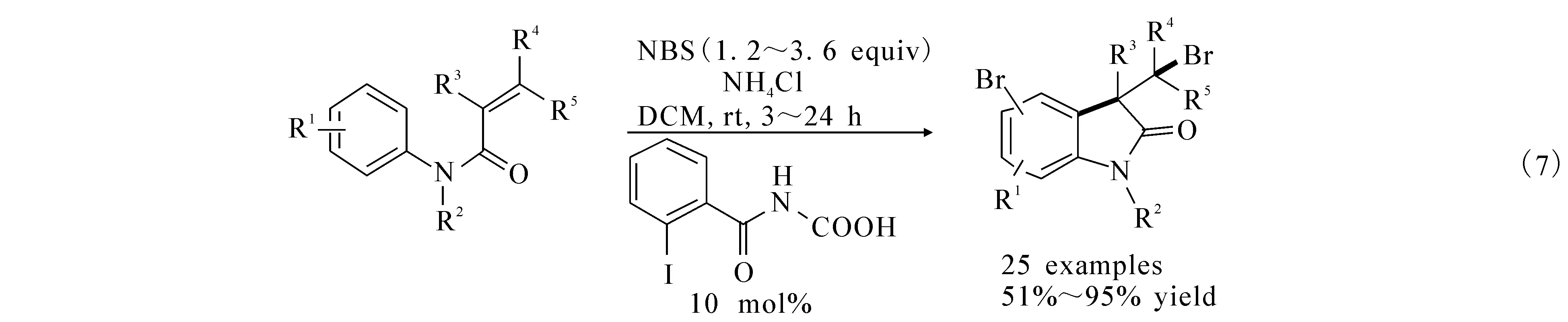
2009年,祝介平及Neuville等利用PhI(OAc)2/I2氧化催化体系,卤素碘作为催化剂,通过卤素环化合成出了3,3-吲哚酮((6)式).文献 [10]报道利用醋酸碘苯为催化剂,乙腈作为溶剂,室温的条件下,N-芳基酰胺可以和碘单质高效地合成吲哚酮产物.文献[11]报道在二氯甲烷为溶剂,室温的条件下,同样也可以高效地合成3,3-吲哚酮((7)式).
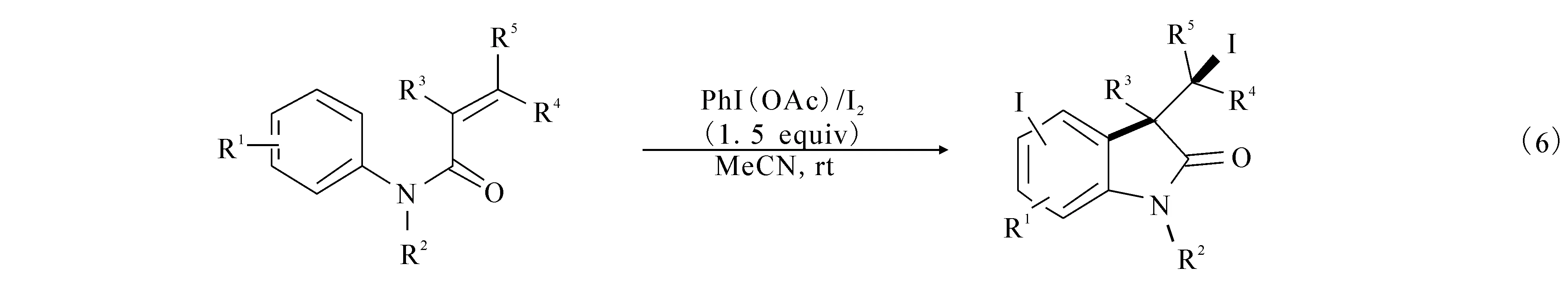
2.2.烯烃烷基芳基化(carboalkylation)环化

在此基础上提出了可能的反应机理(图1):首先是丁基过氧化氢(TBHP)在高温下分解为叔丁氧自由基I,然后异丙醇会产生一个羟基的碳自由基II,紧接着II加成到N-丙烯酰胺双键1a上,生成中间体III,其次III会环化生成IV,最后IV脱去一个氢生成最终的目标产物.

图1 无金属催化合成吲哚酮的反应机理
水作为最廉价的溶剂,廉价易得,对环境友好.在2013年文献[14]报道利用过硫酸钾作为氧化剂,硝酸银作为催化剂,反应条件比较温和,最重要的是反应溶剂为水相,对环境无污染,在反应温度为50 ℃的条件下,高效的催化N-芳基酰胺和β-二酮偶联环化得到3,3-吲哚酮((9)式).
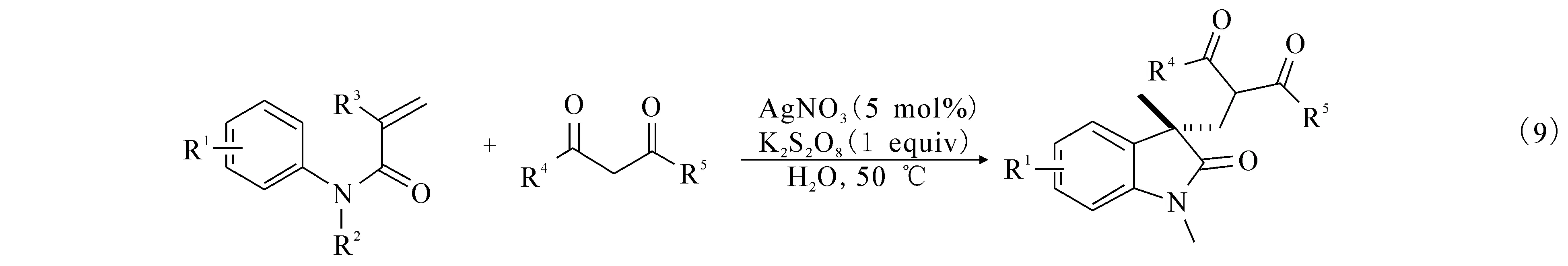
2013年,文献[15]报道在铁盐的催化下,在配体L和丁基过氧化氢(TBHP)作用下,苯为溶剂,利用N-芳基酰胺顺利地环化生成3,3-吲哚酮((10)式),并详细地探讨了各种配体对反应的影响.在铁盐的催化体系中,考察了不同的配体对反应的影响(表1,图2).
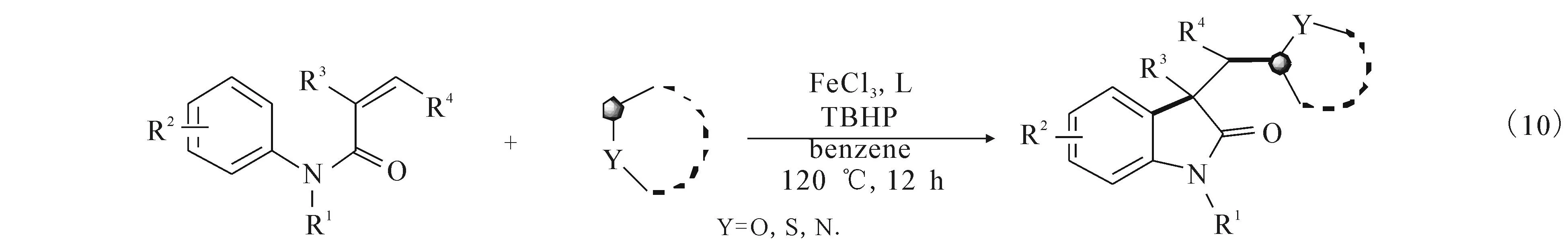
表1 不同配体参与的反应

序号[M]/mol%L/mol%产率/%1FeCl3(5)—152FeCl3(5)—233FeCl3(5)L1(10)704FeCl3(5)L2(10)595FeCl3(5)L3(10)32序号[M]/mol%L/mol%产率/%6FeCl3(5)L4(10)367FeCl3(5)L5(10)858FeCl3(5)L5(200)819FeCl3(5)L5(5)5810FeCl3(5)L5(10)80
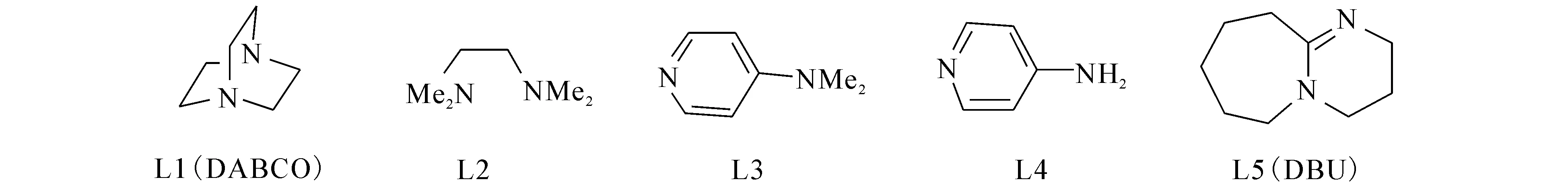
图2 参与反应的配体
在此基础上提出了可能的机理(图3):首先丁基过氧化氢(TBHP)被Fe2+氧化产生叔丁氧基自由基a,在叔丁氧基自由基的存在下,原料b顺利地转化成自由基c,然后c加成到N-丙烯酰胺上,从而可以顺利产生自由基d,紧接着会产生过渡态e,最后e会环化成最终产物.

图3 自由基介导环化合成吲哚酮的反应机理
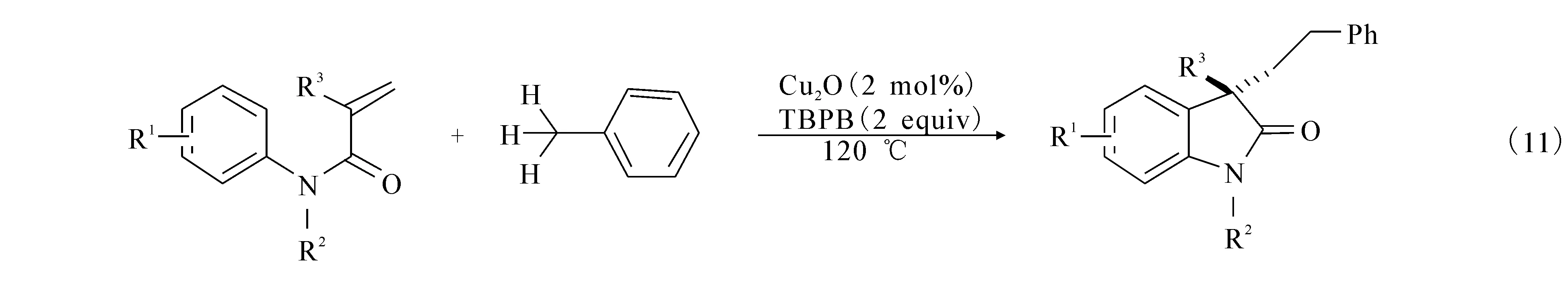
2013年,文献[16]报道利用苄基可以在催化剂的作用下产生自由基的特点,设想了烯烃的苄基化,利用过氧化苯甲酸叔丁酯作为氧化剂,铜盐作为催化剂,120 ℃的条件下,苄基可以顺利加成到N-芳基酰胺的不饱和烯烃生成3,3-吲哚酮((11)式).
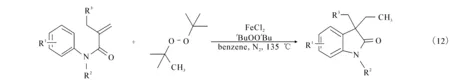
2014年,文献[17]报道利用二叔丁基过氧化合物(DTBP)作为氧化剂,FeCl2为催化剂,氮气环境下,可以得到很高产率的3-甲基-3-芳基吲哚酮,同时此反应体系具有很好耐官能团的特性((12)式).
2014年,文献[18]报道利用了铁盐催化N-芳基酰胺的烯烃烷基芳基化反应.二芳基碘盐作为在这个体系里的一种有效的氧化剂,同样可以高效地合成出3,3-吲哚酮产物.这个反应体系具有较好的耐官能团性,因此有良好的应用前景((13)式).
螺环吲哚酮是许多天然产物和药物中间体的重要组成部分[19].近几十年里科学家对其合成研究也做了许多研究[20].植物中具有很多生物活性的含吲哚酮螺环结构,但是由于含量太低,提取出的有效成分有限,因此采用化学合成制备是很有必要的.2013年,文献[21]报道在前期的基础上,利用N-芳基丙烯酰胺和1,3-二羰基脱水环化生成螺环吲哚酮((14)式).


2.3 烯烃双重芳基化(diarylation)环化
芳基碘鎓盐是一种重要的芳基高价碘(III)化合物,在有机合成中,它们可以作为许多有机和无机亲核试剂的芳化试剂.有机高价碘化合物迄今已有百年历史,由于许多有机高价化合物具有较好的稳定性,并且有一些芳基碘鎓盐具有生物活性和光学特性,因此在有机合成中受到化学家的普遍重视并且得到了广泛的应用[22-23].
2014年,文献[24]报道以二氯甲烷为溶剂,氯化亚铜作为氧化剂,在80 ℃的条件下芳基酰胺和高价碘可以高效地合成吲哚酮产物,产率高达93%((15)式).同年文献[25]报道通过相似的途径,利用碘化亚铜作为氧化剂同时在氮气的保护下同样可以高效地合成3-芳基类吲哚酮((16)式).
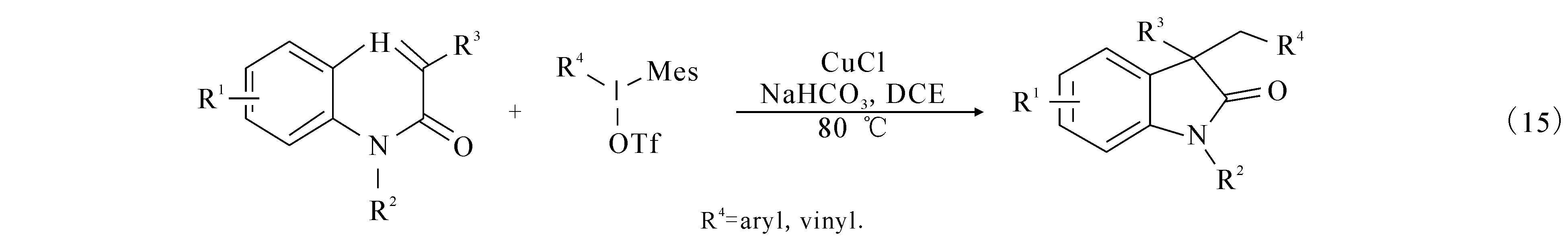

最近,文献[26]报道了N-丙烯酰胺和对硝基苯胺能够高效地生成3,3-吲哚酮.以乙腈为溶剂,亚硝酸叔丁酯和催化剂下,可以高效地合成3,3-吲哚酮((17)式).同时提出了可能的机理(图4):首先苯胺在亚硝酸叔丁酯的条件下,反应生成重氮盐A,然后在过氧化苯甲酰的作用下,生成自由基苯B,加成到原料烯烃上生成中间态C,接着进行分子的环化和分子内脱氢,最终生成3,3-芳基吲哚酮产物.

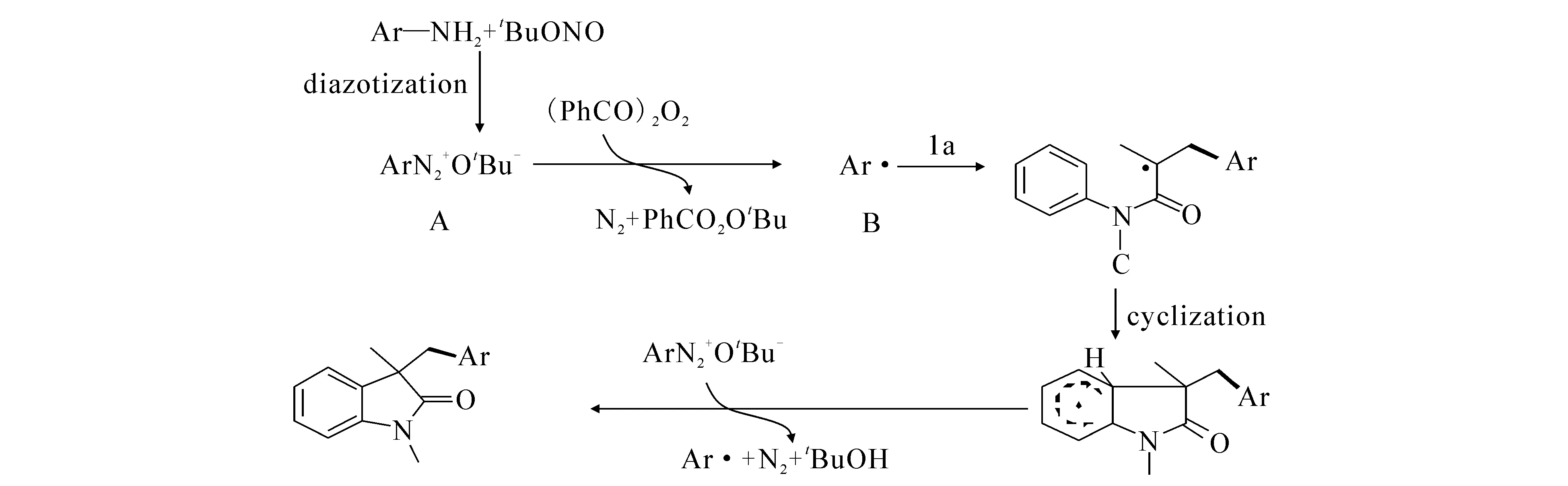
图4 无金属催化合成吲哚酮的反应机理
2.4 烯烃三氟甲基芳基化(trifluoromethylarylation)环化
光是一种环境友好、绿色无污染的天然催化剂.光催化现在涉及的领域非常广,包括化学、材料、能源和生命起源等.目前光催化在有机合成领域同样取得了一些研究成果[27].
含氟的有机分子可以改变很多性能例如代谢稳定性以及渗透性,同时通过氟原子很容易引入其他的基团[28],因此CF+或者CF-的引用对医学和有机合成领域有很重要影响[29].2013年文献[30]报道利用廉价的铜盐,在过氧化叔丁醇60 ℃条件下,以乙酸乙酯和二氯甲烷的混合溶剂体系,可以高效环化合成3,3-吲哚酮((18)式).同年Bruce H.文献[31]报道在文献[30]研究的基础上进一步进行研究,利用不同的铜盐,值得一提的是在水相中,在四甲基乙二胺和过氧化叔丁醇的条件下,在室温下同样可以高效地合成吲哚酮产物((19)式).
2013年,文献[32]报道利用Togni’s试剂,在乙腈为溶剂、四丁基碘化铵为催化剂的条件下,同样可以高效率得到高收率的3,3-吲哚酮目标产物((20)式).2014年,文献[33]报道在合成氮杂环的产物中,利用TMSCF3作为氟源,醋酸碘苯作为催化剂,乙酸乙酯作为溶剂,50 ℃的条件下就可以完成环化反应((21)式).



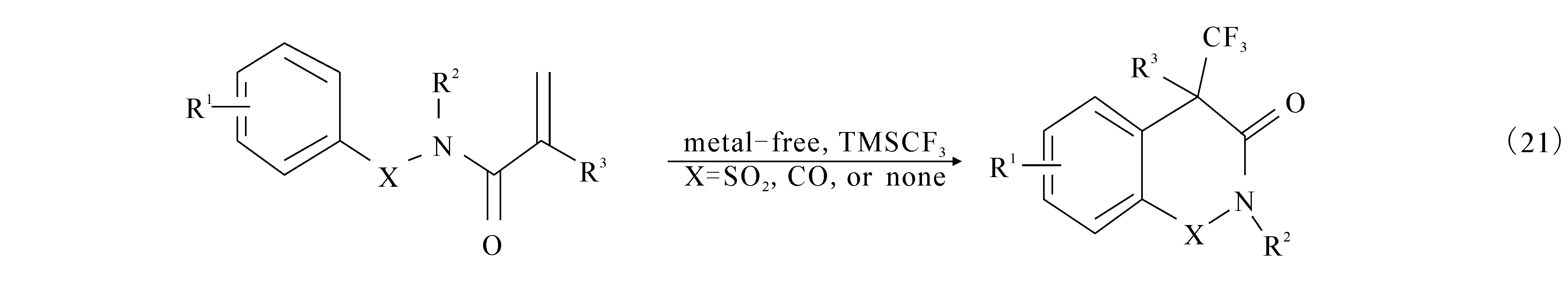
2014年,文献[34]报道以AgSCF3作为催化剂,K2S2O8作为氧化剂,在乙腈溶剂的情况下,同样可以顺利地合成3,3-吲哚酮产物((22)式).

2.5 烯烃芳基羰基化(arylcarbonylation)环化
2013年,文献[35]报道无金属催化的新体系,利用叔丁基过氧化氢,105 ℃的条件下,此反应的最大的特色就是溶剂为乙酸乙酯,价格廉价,材料丰富,最终顺利催化N-芳基烷酰胺类化合脱氢偶联环化得到了3,3 -酯基吲哚酮((23)式).
2013年,文献[36]报道以硝酸银/过硫酸钾 (AgNO3/K2S2O8)作为催化体系,温和、高效地催化不饱和烯烃和α-酮酸进行串联脱羧自由基环化反应((24)式),反应条件温和,同时具有优异的耐官能团性.同时还进行了理论方面的研究和探索,提出了可能的反应机理(图5):首先α-酮酸在AgNO3/K2S2O8的体系作用下,转化成亲核的自由基A,攻击原料N-丙烯酰胺得到中间体B,其次中间体不稳定发生分子内环化生成中间体C,最后脱去一个H偶联生成最终的产物吲哚酮.
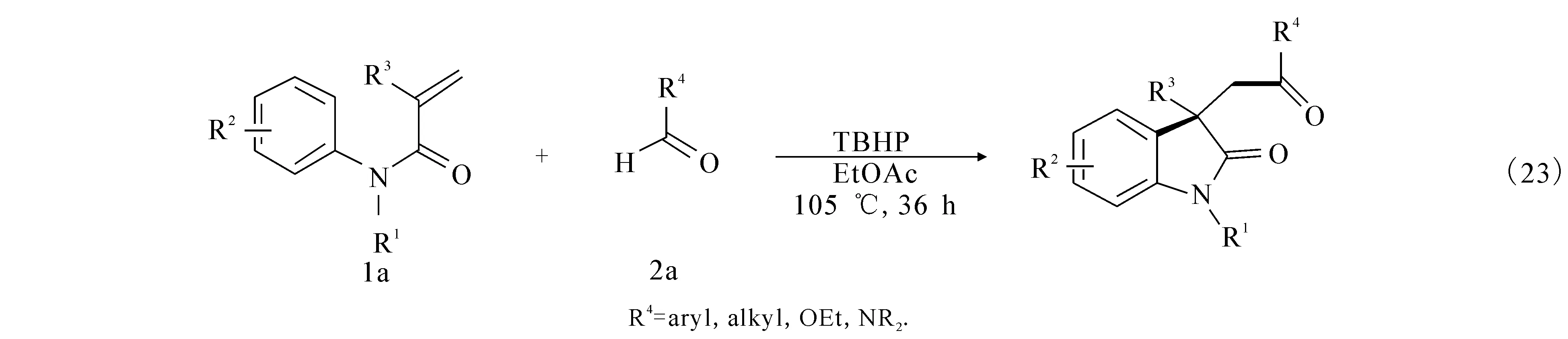
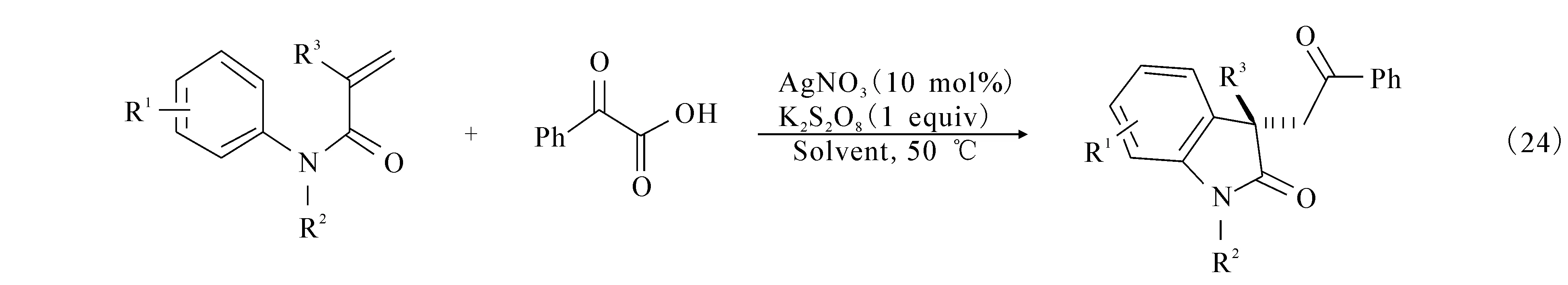
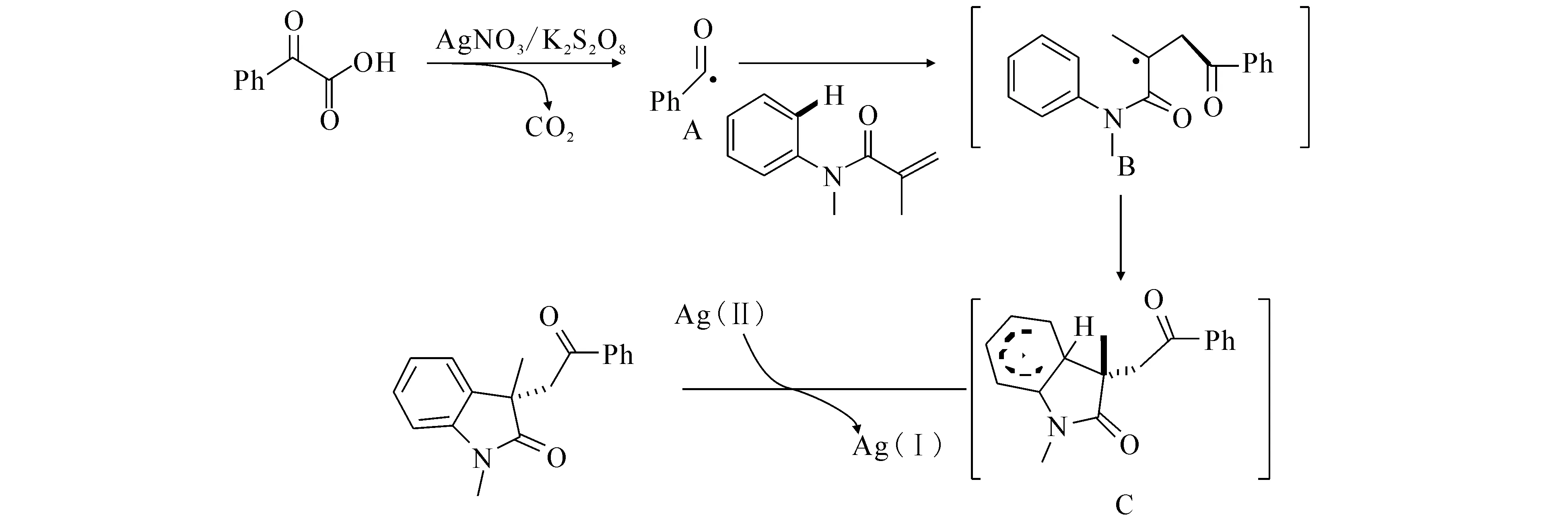
图5 H-丙烯酰胺环化合成吲哚酮的反应机理
肼在催化剂的作用下可以很容易产生自由基,在一定的条件下作为亲核基团很容易进攻靶目标[37-38].2013年文献[39]报道以乙腈作为溶剂,过氧化叔丁醇作为氧化剂,80 ℃的条件下,主要考察了FeCl2·4H2O,发现铁盐对反应体系影响比较大.在此基础上利用所给的N-芳基酰胺和肼可以顺利地偶联((25)式).铁盐FeCl2·4H2O廉价且无污染,因此该反应具有环境友好的特点,此反应体系的实际应用得到大大的提高(表2).

表2 反应条件的筛选
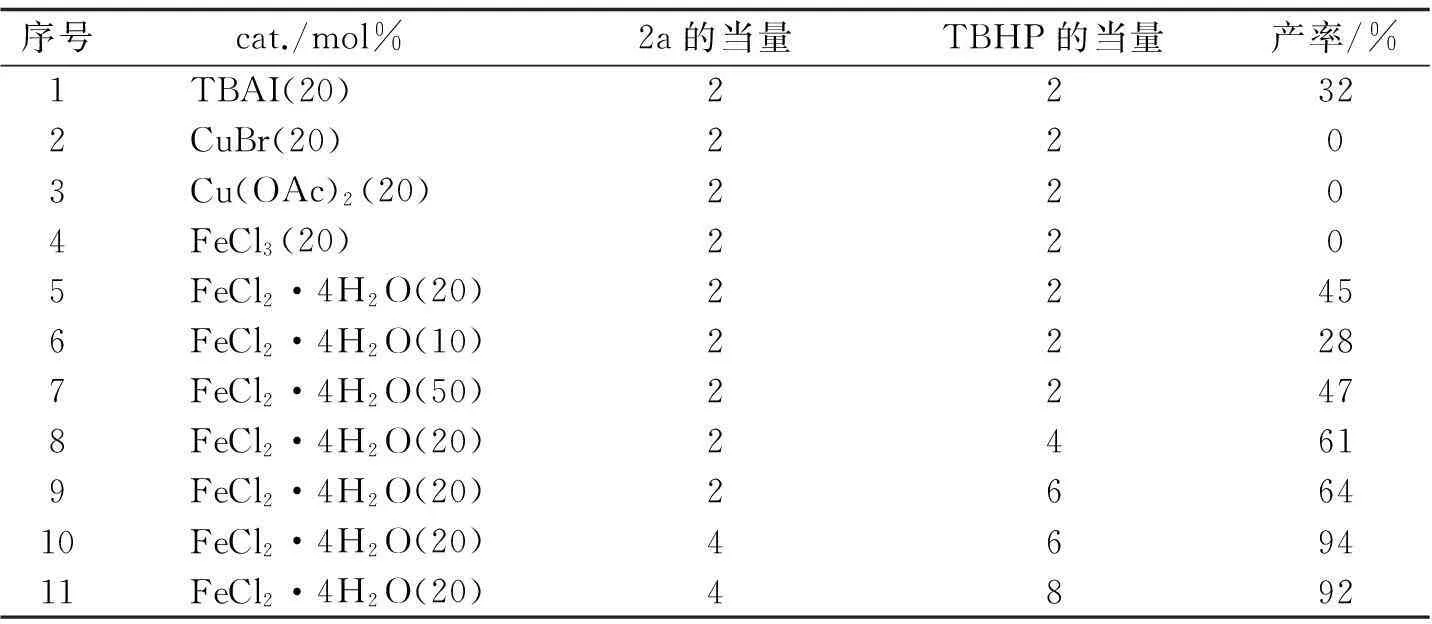
序号cat./mol% 2a的当量TBHP的当量产率/%1TBAI(20)22322CuBr(20)2203Cu(OAc)2(20)2204FeCl3(20)2205FeCl2·4H2O(20)22456FeCl2·4H2O(10)22287FeCl2·4H2O(50)22478FeCl2·4H2O(20)24619FeCl2·4H2O(20)266410FeCl2·4H2O(20)469411FeCl2·4H2O(20)4892
注反应条件:1a(0.25 mol),2a(0.5 mol),催化剂和过氧化叔丁醇(70%水溶液),乙腈(2 mL),温度80 ℃,反应6 h.
2.6 烯烃叠氮芳基化(azoarylation)环化
含氮类化合物是许多潜在的药物分子、天然产物和无机材料的重要骨架,在材料科学、农业化学、药剂学等领域有广泛的应用,其合成方法也一直是合成化学领域中的热点之一.2013年,文献[40]报道利用二(三氟乙酸)碘苯(PIFA),在一定溶剂及温和的条件下(室温),利用丙烯酰胺和三甲基硅叠氮反应1 h即可高效地生成吲哚酮目标产物((26)式).同年北京大学的焦宁教授和杨尚东研究组都利用硝酸银作为催化剂,合成3,3-吲哚酮.文献[41]报道利用硝酸锆作为氧化剂,乙腈作为溶剂,110 ℃的条件下高效地合成3,3-吲哚酮产物((27)式).文献[42]报道利用硝酸银为催化剂,乙腈为溶剂,80 ℃的条件下,丙烯酰胺和三甲基硅叠氮高效地反应生成3,3-吲哚酮((28)式).同时提出了可能的机理(图6):首先三甲基硅叠氮会被Ce(SO4)2氧化生成叠氮自由基,然后加成到烯烃1a上生成过渡态A,紧接着会被银离子还原环化生成过渡态C,最后脱氢生成吲哚酮产物.
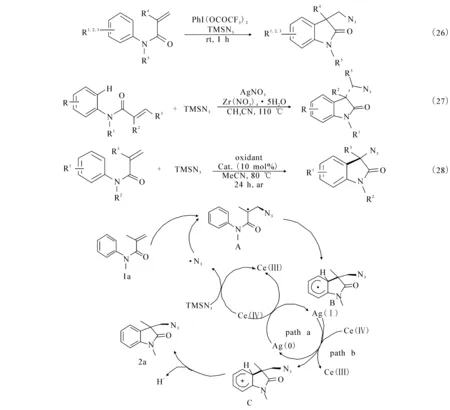
图6 自由基介导合成吲哚酮的反应机理
2.7 烯烃硝基芳基化(nitroarylation)环化


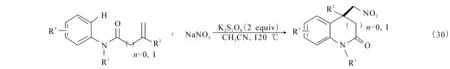
2.8 烯烃磺酸基芳基化(tosylarylation)环化

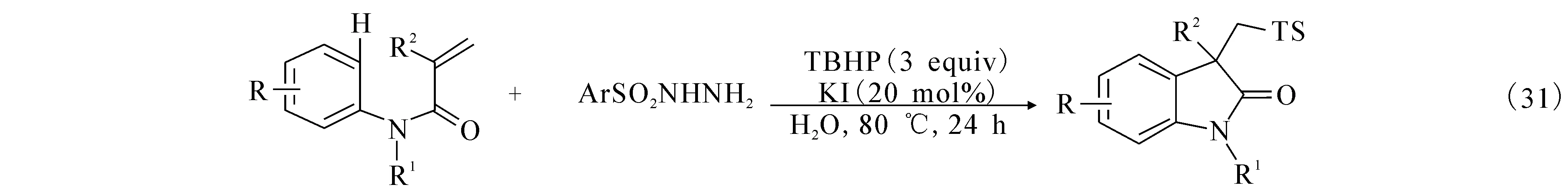



2.9 烯烃膦酰基芳基化(phoshorarylation)环化


3结论与展望

参考文献:
[1] CHRISTIANE MARTI,ERICK M CARREIRA.Construction of Spiro[Pyrrolidine-3,3′-Oxindoles]-Recent Applications to the Synthesis of Oxindole Alkaloids[J].Eur. J. Org. Chem.,2003(12):2 209-2 219.
[2] GIRIJA S SINGH,ZELALEM Y DESTA.Isatins as Privileged Molecules in Design and Synthesis of Spiro-Fused Cyclic Frameworks[J].Chem. Rev.,2012,112(11):6 104-6 155.
[3] JOHN P WOLFE.Palladium-Catalyzed Carboetherification and Carboamination Reaction of Hydroxyl an Aminoalkenes for the Synthesis of Tetrahydrofurans and Pyrrolidines[J].Eur. J. Org. Chem.,2007(4):571-582.
[4] STÉPHANIE JAEGLI,JEREMY DUFOUR,WEI Hailong,et al.Synthesis of Oxindoles and Spiooxindoles[J].Org. Lett.,2010,12(20):4 498-4 501.
[5] ASTRID BEYER,JULIEN BUENDIA,CARSTEN BOLM.Transition-Metal-Free Synthesis of Oindoles by Potassium Tert-Butoxide-Promoted Intramolecular Arylation[J].Org. Lett.,2012,14(15):3 948-3 951.
[6] DEY C,KATAYEV D,KAI E O YLIJOKI,et al.Aza-Oxindole Synthesis via Base Promoted Truce-Smiles Rearrangement[J].Chem. Commun.,2012,48:10 957-10 959.
[8] DEY C,KUNDING E P.Aza-Oxindole Synthesis by Oxidative Coupling[J].Chem. Commun.,2012,48:3 064-3 066.

[10] WEI Hailong,TIFFANY PIOU,JEREMY DUFOUR,et al.Iodo-Carbocyclization of Electron-Deficient Alkenes:Synthesis of Oxindoles an Spiooxindoles[J].Org. Lett.,2011,13(9):2 244-2 246.
[11] DAVID C FABRY,MACIEJ STODULSKI,DIPL-CHEM STEFANIE HOERNER,et al.Metal-Free Synthesis of 3,3-Disubstituted Oxioindoles by Iodine-Catalyzed Bromocarbocyclizations[J].Chem. Eur. J.,2012,18(35):10 834-10 838.
[12] ZHOU Zhaozhao,HUA Huiliang,LUO Jianyi,et al.Metal-Free Synthesis of 3,3-Disubstituted Oxindoles via 1,2-Alkylarylation of Activated Alkenes with Alcohols[J].Tetrahedron,2013,69(47):10 030-10 035.
[13] MENG Yuan,GUO Lina,WANG Hua,et al.Metal-Free Oxidative Hyddroxyalkylarylation of Activated Alkenes[J].Chem. Commum.,2013,49:7 540-7 542.
[14] WANG Hua,GUO Lina,DUAN Xinhua.Silver-Catalyzed Oxidative Coupling Cyclization of Acrylamides with 1,3-Dicarbonyl Compounds[J].Chem. Commum.,2013,49:10 370-10 372.


[17] DAI Qiang,YU Jintao,JIANG Yan,et al.The Carbomethylation of Arylacrylamides Leading to 3-Ehyl-3-Substituted Indolin-2-One by Cascade Radical Addition Cyclizaton[J].Chem. Commum.,2014,50:3 865-3 867.
[18] LU Mingzhu,TECK-PENG LOH.Iron-Catalyzed Cascade Carbochloromethylation of Activated Alkenes:Highly Efficient Access to Chloro-Containing Oxindoles[J].Org. Lett.,2014,16(18):4 698-4 701.
[19] CGRUSTIANE MARTI,ERICK M CARREIRA.Construction of Spiro[Pyrrolidine-3,3′-Oxindoles]-Recent Applications to the Synthesis of Oxindole Alkaloids[J].Eur. J. Org. Chem.,2003(12):2 209-2 219.
[20] JOHANNES E M N KLEIN,RICHARD J K TAYLOR.Transition-Metal-Mediated Routes to 3,3-Disubstituted Oxindoles Through Anilide Cyclisation[J].Eur. J. Org. Chem.,2011(33):6 821-6 841.
[21] WANG Hua,GUO Lina,DUAN Xinhua.Metal-Free Oxidative Spirocyclization of Hydroxymethylacrylamide with 1,3-Dicarbonyl Compounds:A New Route to Spirooxindoles[J].Org. Lett.,2013,15(20):5 254-5 257.
[22] KRYKA A,SKULSKI L.One-Pot Preparations of Diaryliodonium Bromides from Iodoarenes and Arenes,with Sodium Perborate as the Oxidant[J].Molecules,2001,14(6):875-880.
[23] SKULSKI L.Novel Easy Preparations of Some Aromatic Iodine (I,III and V) Reagents,Widely Applied in Modern Organic Synthesis[J].Molecules,2003,18(8):45-52.
[24] ZHOU Bing,HOU Wei,YANG Yaxi,et al.Copper-Catalyzed Aryl or Vinyl Addition to Electron-Deficient Alkenes Cascaded by Cationic Cyclization[J].Org. Lett.,2014,16(5):1 322-1 325.
[25] SHI Liangliang,WANG Yuyuan,YANG Haijun,et al.Copper-Catalyzed Bis-Arylations of Alkenes Leading to Oxindole Derivatives[J].Org. Biomol. Chem.,2014,12:4 070-4 073.

[27] XIAO Jun′an,ZHANG Honggang,LIANG Shan,et al.Synthesis of Pyrrolo(Spiro-[2,3′]-Oxindole)-Spiro-[4,3″]-Oxindole via 1,3-Dipolar Cycloaddition of Azomethine Ylides with 3-Acetonylideneoxindole[J].J. Org. Chem.,2013,78(22):11 577-11 583.
[28] MASAKI SHIMIZU,TAMEJIRO HIYAMA.Moderne Synthesemethoden Für Fluorierte Verbindungen[J].Angew. Chem.,2005,117(2):218-234.
[29] R FREDERICK LUDLOW,SIJBREN OTTO.Systems Chemistry[J].Chem. Soc. Rev.,2008,37:108-111.
[30] LU Qingquan,LIU Chao,PENG Pan,et al.Copper-Catalyzed Trifluoromethylation-Initiated Radical Oxidative Annulations Toward Oxindoles[J].Asian,JOC,2014,3(3):273-276.
[31] YANG Fang,PIYATIDA KLUMPHU,LIANG Yongmin,et al.Copper-Catalyzed Trifluoromethylation of N-Arylacrylamides on Water at Room Temperature[J].Chem. Commum.,2014,50:936-938.
[32] KONG Wangqing,MARIA CASIMIRO,NOELIA FUENTES,et al.Metal-Free Aryltrifluoromethylation of Activated Alkenes[J].Angew. Chem. Int. Ed.,2013,52(49):13 086-13 090.
[33] LI Lei,DENG Min,ZHENG Shengcai,et al.Metal-Free Direct Intramolecular Carbotrifluoromethylation of Alkenes to Functionalized Trifluoromethyl Azaheterocycles[J].Org. Lett.,2014,16(2):504-507.
[34] YIN Feng,WANG Xisheng.Silver-Mediated Radical Aryltrifuoromethylthiolaton of Activated Alkenes[J].Org. Lett.,2014,16(4):1 128-1 131.

[36] WANG Hua,GUO Lina,DUAN Xinhua.Silver-Catalyzed Decarboxylative Acylarylation of Acrylamides with Oxocarboxylic Acids in Aqueous Media[J].Adv. Synth. Catal.,2013,355(3):2 222-2 226.
[37] LI Xiaoqing,XU Xiangsheng,TANG Yucai.Tetrabutylammonium Iodide Catalyzed Allylic Sulfonylation of Baylis-Hillman Acetates with Sulfonylhydrazides in Water[J].Org. Biomol. Chem.,2013,11:1 739-1 742.
[38] TSUYOSHI TANIGUCHI,YUKI SUGIURA,HISAAKI ZAIMOKU.Iron-Catalyzed Oxidative Addition of Alkoxycarbonyl Radicals to Alkenes with Carbazates and Air[J].Angew. Chem. Int. Ed.,2010,49(52):10 154-10 157.
[39] XU Xiangsheng,TANG Yucai,LI Xiaoqing,et al.Iron-Catalyzed Arylalkoxycarbonylation of N-Aryl Acrylamides with Carbazates[J].J. Org. Chem.,2014,79(1):446-451.
[41] WEI Xiaohong,LI Yamin,ZHOU Anxi,et al.Silver-Catalyzed Carboazidation of Arylacrylamides[J].Org. Lett.,2013,15(16):4 158-4 161.

[43] LI Yamin,WEI Xiaohong,LI Xi′an,et al.Metal-Free Carbonitration of Alkenes Using K2S2O8[J].Chem. Commun.,2013,49:11 701-11 703.
[44] LI Xiaoqing,XU Xiangsheng,HU Peizhu,et al.Synthesis of Sulfonated Oxindoles by Potassium Iodide Catalyzed Arylsulfonylation of Activated Alkenes with Sulfonylhydrazides in Water[J].J. Org. Chem.,2013,78(15):7 343-7 348.
[45] TIAN Qingshan,HE Ping,KUANG Chunxiang.Copper Catalyzed Arylsulfonylation of N-Arylsulfonyl-Acrylamides with Arysulfonohydrazides Synthesis of Sulfonated Oxindoles[J].Org. Biomol. Chem.,2014,12:6 349-6 353.
[46] WEI Wei,WEN Jiangwei,YANG Daoshan,et al.Catalyst-Free Direct Arylsulfonylation of N-Arylacrylamides with Sulfinic Acids:A Convenient and Efficient Route to Sulfonated Oxindoles[J].Green Chem.,2014,16:2 988-2 991.
[47] LI Yamin,SUN Meng,WANG Hongli,et al.Direct Annulations Toward Phosphorylated Oxindoles:Silver-Catalyzed Carbon-Phosphorus Functionalization of Alkenes[J].Angew. Chem. Int. Ed.,2013,52(14):3 972-3 976.
(责任编辑向阳洁)

ZHOU Dong1,LI Yuhua1,DENG Youlin1,LI Zhihao1,TANG Shi1,2
(1.College of Chemistry and Chemical Engineering,Jishou University,Jishou 416000,Hunan China;
2.College of Chemistry and Chemical Engineering,Central South University,Changsha 410083,China)
Abstract:Oxindole and its derivatives are widely distributed in nature,and the synthetic method has been one of the hot topics of synthetic chemistry.According to the coupling mechanism,the researches on oxindole synthesis through free radical mediatedcyclization in recent years are summarized.In view of the effects of catalyst,oxidizing agent,and solvent on the reaction system,this paper discusses the method of cleavingbond.
Key words:freeoxidation;tandem reaction;oxidant
作者简介:周栋(1988—),男,江苏宿迁人,吉首大学化学化工学院硕士研究生,主要从事有机合成研究;唐石(1979—),男,湖南衡阳人,吉首大学化学化工学院教授,博士,主要从事有机合成、天然产物研究.
基金项目:湖南省教育厅优秀青年基金项目(13B094);吉首大学大学生研究性学习和创新性实验计划项目(JSU-CX-2013-03);吉首大学研究生科研创新项目(JGY201418)
收稿日期:2014-11-03
中图分类号:O621.3
文献标志码:A
DOI:10.3969/j.issn.1007-2985.2015.02.013
文章编号:1007-2985(2015)02-0060-11

