沙利度胺对子宫内膜异位症患者内膜间质细胞的影响及其机制▲
李 宁 彭 兴 黎丹戎 尧良清 黄玉葵 范余娟
(1 广西南宁市妇幼保健院妇科,南宁市 530001,E-mail:lining0771@163.com;2 广西医科大学药学院,南宁市 530021;3 广西医科大学附属肿瘤医院肿瘤实验研究中心,南宁市 530021;4 复旦大学附属妇产科医院妇科,上海市 200011;5 广西医科大学第一附属医院妇科,南宁市 530021)
论著·基础研究
沙利度胺对子宫内膜异位症患者内膜间质细胞的影响及其机制▲
李 宁1彭 兴2黎丹戎3尧良清4黄玉葵1范余娟5
(1 广西南宁市妇幼保健院妇科,南宁市 530001,E-mail:lining0771@163.com;2 广西医科大学药学院,南宁市 530021;3 广西医科大学附属肿瘤医院肿瘤实验研究中心,南宁市 530021;4 复旦大学附属妇产科医院妇科,上海市 200011;5 广西医科大学第一附属医院妇科,南宁市 530021)
目的 探讨沙利度胺对子宫内膜异位症(EMT)患者内膜间质细胞(ESC)的增殖、迁移运动、修复及体外侵袭能力的影响及其作用机制。方法 体外原代培养EMT患者的ESC,加入不同浓度沙利度胺(500.00、250.00、125.00、62.50、31.25 μg/ml)分别作用24 h、48 h后,应用噻唑蓝法测定ESC的抑制率。另取ESC分为空白组(沙利度胺0 μg/ml)、15 μg/ml沙利度胺组、30 μg/ml沙利度胺组,分别应用划痕实验、Transwell小室实验测定沙利度胺对ESC迁移运动及修复能力、体外侵袭能力的影响,流式细胞仪检测在沙利度胺作用24 h后ESC的凋亡率,酶联免疫吸附试验实验检测沙利度胺对ESC血管内皮生长因子(VEGF)蛋白表达的影响。结果 15、30 μg/ml沙利度胺组细胞的迁移及修复能力、穿膜细胞数较空白组下降,细胞凋亡率较空白组升高(P<0.05);细胞抑制率随沙利度胺作用的浓度升高而升高(P<0.05);15、30 μg/ml沙利度胺组细胞VEGF蛋白表达量明显低于空白对照组(P<0.05)。结论 沙利度胺可抑制人EMT患者ESC的增殖、迁移运动和体外侵袭能力,并可以诱导细胞凋亡,其机制可能是下调细胞VEGF蛋白分泌。
子宫内膜异位症;沙利度胺;内膜间质细胞;血管内皮生长因子;细胞增殖;迁移;侵袭
子宫内膜异位症(endometrionsis,EMT)的发病率为10%~15%。异位内膜极具浸润性及种植能力,可侵犯全身任何部位,患者可出现痛经、盆腔痛、性交痛,甚至不孕等,严重影响患者的身心健康和生活质量[1-2]。药物治疗是EMT的主要治疗方法,临床上多采用激素类药物进行治疗,但存在疗效不理想、副作用大的弊端,因此,寻找非激素类的治疗药物意义重大[3]。大量文献报告EMT虽为妇科良性疾病,却与恶性肿瘤具有相似的黏附、侵袭、远处转移及新生血管生成等生物学特性[4-5]。因此,抗血管生成有可能成为治疗EMT的新趋势。沙利度胺具有抑制肿瘤细胞增殖的作用,其机制可能是抑制新生血管的形成[6]。为探讨沙利度胺对子宫内膜异位症内膜间质细胞(endometrionsis-endometrial stromal cell,EMT-ESC)的影响,本课题对EMT患者的内膜间质细胞(endometrial stromal cell,ESC)进行体外培养,将沙利度胺作为主要干预因子,观察其对细胞的影响。
1 资料与方法
1.1 细胞来源 选择2013年1月至2015年1月在南宁市妇幼保健院妇科就诊的EMT患者31例为研究对象,患者年龄29~40(32.0±1.7)岁,术前无激素用药史,术后经病理检查明确诊断。术中留取患者卵巢巧克力囊肿的囊壁进行原代EMT-ESC培养。
1.2 方法
1.2.1 主要药品及仪器:沙利度胺购自常州制药厂有限公司(批号020126)。称取沙利度胺药物粉末25 mg,加入5 ml无血清RPMI-1640培养基使其充分溶解,经0.22 μm无菌滤膜过滤即得5 mg/ml药物原液,分装,于4℃保存,使用时采用无血清RPMI-1640培养基稀释药物原液至所需浓度。鼠抗人波形蛋白抗体购自武汉博士德公司(批号:130106025A);倒置显微镜为日本Nikon公司生产;噻唑蓝(methyl thiazol tetrazolium,MTT)、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-荧光标记二抗、二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma公司(批号:13031311M、12112618M、12120928M);血管内皮生长因子(vascular endothelial growth factor,VEGF)酶联免疫吸附试验试剂盒购自美国Abcam公司(批号:130520631H);Transwell小室购自美国Chemi-Con公司(批号:1300165);DMEM细胞培养基和胎牛血清购自美国Gibco公司(批号:130412P、130325X);流式细胞仪为美国BD公司生产。
1.2.2 原代细胞培养:术中取少量新鲜EMT组织(巧克力囊肿的囊壁),临时储存于完全培养基中,并及时转移到实验室,处理步骤如下:将部分人EMT组织经磷酸缓冲盐溶液(phosphate buffer saline,PBS)漂洗后,用眼科手术剪刀小心地反复剪切组织至1 mm3左右的小块,再用PBS溶液清洗至清洗液清亮,静置数分钟,弃去上清。视组织块量加入5~6倍的0.25%胰酶液,37℃消化30 min,每隔5 min振荡一次。静置,吸去上清,加2 ml细胞培养液,用吸管反复吹打组织块,使细胞呈单个游离状,将细胞悬液接种至T 25培养瓶中,置于37℃、二氧化碳培养箱中培养。倒置显微镜下观察原代培养细胞的形态及生长情况。用鼠抗人波形蛋白抗体对分离获得细胞进行免疫组化染色鉴定[3],鉴定后的细胞用于后续实验。
1.2.3 MTT实验:取对数生长期的ESC,以1×105/ml密度接种于96孔板中,每孔100 μl,37℃培养24 h后,加入100 μl不同浓度沙利度胺(500.00、250.00、125.00、62.50、31.25 μg/ml),空白孔加100 μl细胞培养液,每组设4个复孔。37℃分别培养24、48 h后每孔加20 μl MTT,37℃继续孵育4 h,小心吸弃孔板中的所有试剂,加入200 μl DMSO,10 min后在酶标仪上测定波长570 nm吸光度值(A),按公式计算抑制率及半数抑制浓度IC50。抑制率=(1-实验组A值/空白对照组A值)×100%[7]。选择抑制率小于10%的浓度,观察沙利度胺对细胞增殖活力的影响。
1.2.4 细胞划痕实验:取对数生长期的ESC,将细胞浓度调整至1×106/ml,于6孔板中每孔加细胞悬液500 μl,37℃、5% CO2孵育24 h,使之形成单层细胞。10 μl无菌移液枪枪头划痕,PBS溶液轻柔洗细胞3次。加入不同浓度的沙利度胺(0、15、30 μg/ml),37℃、5% CO2孵育,按0 h、24 h、48 h、72 h取样,显微镜观察、拍照。
1.2.5 Transwell小室实验:取对数生长期的ESC,将细胞浓度调整至5×104/ml,取细胞悬液200 μl接种于上层小室内,小室下室加入含有20%胎牛血清的RPMI-1640完全培养基。各组Transwell小室加入不同浓度的沙利度胺(0、15、30 μg/ml),37℃、5% CO2孵育24 h后取出滤膜,擦去Matrigel胶,甲醇固定20 min,行Giemsa染色。200倍光镜下随机计数上、下、左、右、中5个不同视野的穿膜细胞数,取均值。实验重复3次。
1.2.6 检测细胞凋亡率:用Sigma公司的细胞染色缓冲液洗涤细胞两次,然后悬浮细胞在膜联蛋白V结合缓冲液中,细胞浓度为0.8×107/ml。移取100μl细胞悬液放于5 ml的试管中,给药组分别加入不同浓度的沙利度胺(0、15、30 μg/ml),以不加药物的细胞为对照组。24 h后收集细胞,调整细胞浓度为1×106/ml,每根试管中加入490 μl工作浓度的膜联蛋白V结合缓冲液,振荡混匀细胞,同时加入5 μl膜联蛋白V-FITC和1 μl 7-氨基放线菌素D,室温下避光染色10 min,用流式细胞仪进行双参数分析,测定坏死、凋亡和正常细胞的百分率。
1.2.7 VEGF蛋白表达的测定:取对数生长期的ESC,调整细胞浓度为5×105/ml,将ESC置培养瓶中培养,细胞贴壁后加入不同浓度的沙利度胺(0、15、30 μg/ml)处理24 h,更换成无血清及细胞因子的基础培养基培养24 h,收集细胞培养上清液。采用酶联免疫吸附试验法对细胞培养上清中VEGF含量进行测定。设置空白孔,将上述收集到的细胞培养上清液按100 μl/孔加入相应预包被板孔中,用封板胶纸封住反应孔,室温孵育120 min。加入生物素化抗体工作液(100 μl/孔)。用封板胶纸封住反应孔,室温孵育60 min。加入酶结合物工作液(100 μl/孔)。用封板胶纸封住反应孔,避光室温孵育20 min。上述每个步骤之间均洗板5次,且最后一次置厚吸水纸上拍干。加入显色剂3,3′,5,5′-四甲基联苯胺100 μl/孔,避光室温孵育20 min。加入终止液50 μl/孔,混匀后即刻通过酶标仪测量A450值。VEGF浓度与A450值之间呈正比。
1.3 统计学分析 采用SPSS 16.0软件进行统计分析,计量资料以(x±s)表示,多组均数比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 原代培养EMT患者ESC形态及鉴定结果 成功从EMT患者巧克力囊肿标本分离培养子宫ESC,细胞容易贴壁生长。倒置显微镜下观察原代人EMT-ESC呈蝌蚪形或多角形,细胞多呈旋涡状成团生长,见图1。免疫组化鉴定结果显示,原代细胞具有成纤维细胞形态,鼠抗人波形蛋白染色细胞胞质呈棕黄色,证实获得人EMT-ESC,见图2。
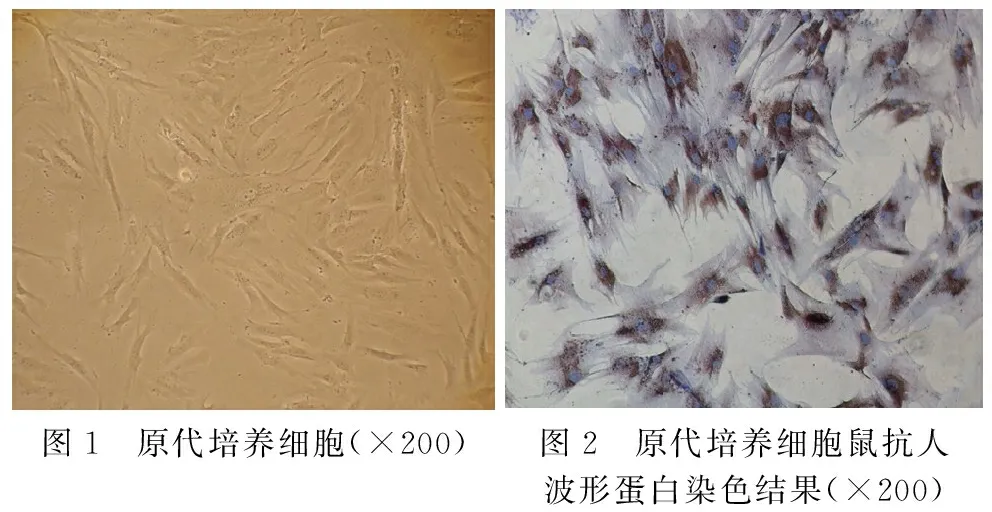
图1 原代培养细胞(×200)图2 原代培养细胞鼠抗人波形蛋白染色结果(×200)
2.2 沙利度胺对EMT患者ESC增殖能力的影响 不同浓度沙利度胺对人EMT-ESC的抑制率分别比较,差异均有统计学意义(P<0.05),不同浓度的沙利度胺均能显著抑制细胞的生长,且呈明显的剂量-时间依赖性(P<0.05)。24 h、48 h沙利度胺对人EMT-ESC的抑制率IC50分别为245.44 μg/ml和185.36 μg/ml,当沙利度胺浓度低于30 μg/ml时,对细胞的生长抑制率低于10%。见表1。
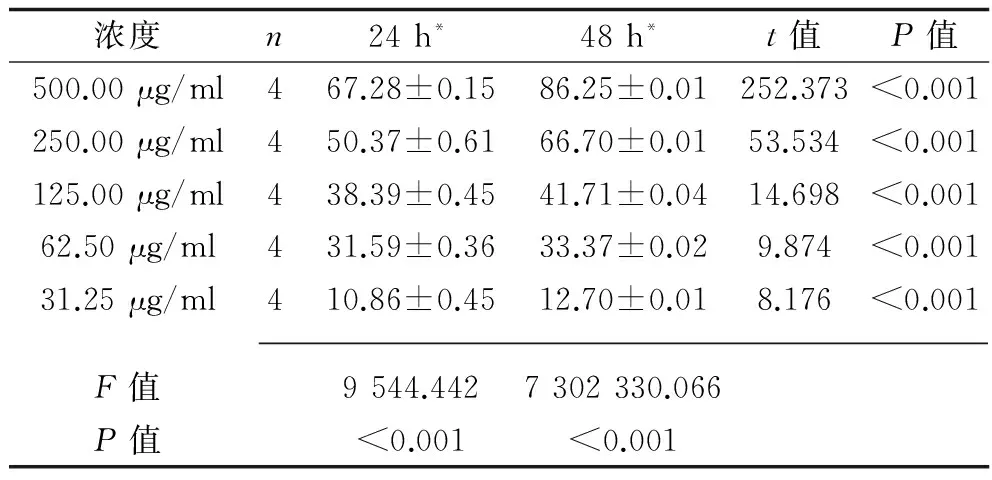
表1 不同浓度的沙利度胺作用24 h、48 h人EMT-ESC的抑制率(%)
注:*组内不同浓度间两两比较,P<0.05。
2.3 沙利度胺对EMT患者ESC迁移能力的影响 不同浓度的沙利度胺(0、15、30 μg/ml)处理细胞0 h、24 h、48 h、72 h后,细胞划痕实验结果显示沙利度胺能明显抑制细胞的迁移运动及修复能力,且呈明显的剂量-时间依赖性。见图3。
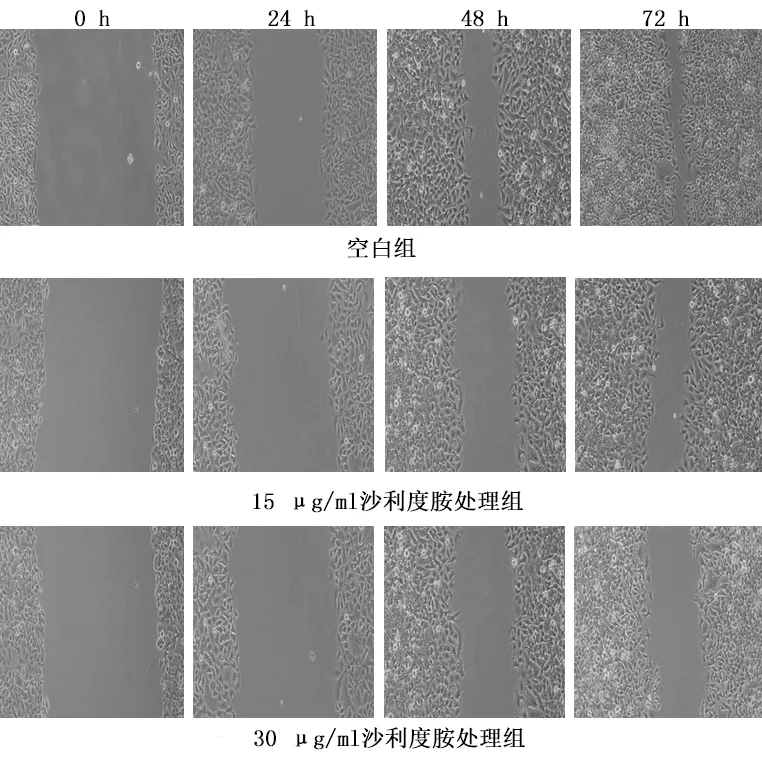
图3 不同浓度沙利度胺作用不同时间ESC迁移运动、修复能力的变化(×100)
2.4 沙利度胺对EMT患者ESC侵袭能力的影响 空白组和15、30 μg/ml沙利度胺组的穿膜细胞数目分别为(79.3±6.5)个、(11.5±3.6)个和(6.5±2.4)个,沙利度胺处理24 h后的人EMT-ESC体外侵袭能力显著降低(F=2 268.127,P<0.001),见图4。
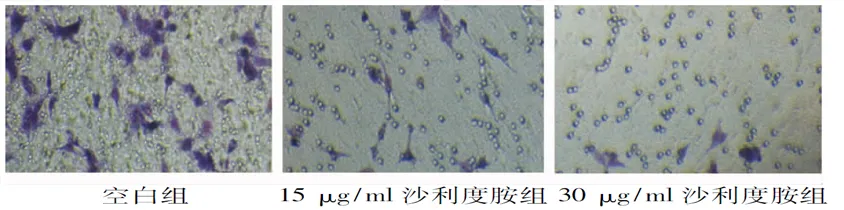
图4 不同浓度沙利度胺作用24 h对细胞体外侵袭能力的影响 (Giemsa染色,×200)
2.5 沙利度胺对EMT患者ESC凋亡的影响 经15 μg/ml和30 μg/ml沙利度胺作用24 h后的细胞凋亡率分别为14%和29%,显著高于空白组的0.3%,见图5。
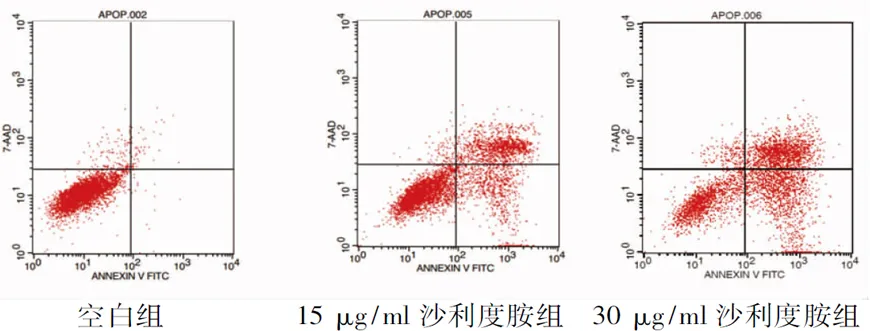
图5 不同浓度沙利度胺作用24 h后细胞的凋亡情况
2.6 沙利度胺对VEGF蛋白表达的影响 作用24 h后,15、30 μg/ml沙利度胺组细胞VEGF蛋白表达量分别为(42.34±4.50)ng/L、(28.70±3.23)ng/L,明显低于空白对照组的(61.56±7.32)ng/L(F=243.635,P<0.001)。
3 讨 论
有学者研究发现,与子宫内膜接触的腹膜部分,其表面间质细胞会出现缺失现象,这与子宫内膜发生侵袭的现象相符合[7],由此可见子宫ESC是一种具侵袭能力的细胞,可以引起腹膜间质细胞的损伤和凋亡。子宫ESC生长和转移离不开血管生成,新生血管形成是子宫ESC增长所必需的先决条件之一。血管增生在EMT的发病机制中起着较为关键的作用。大多数EMT患者存在子宫内膜增厚、毛细血管丰富的典型病理学特征,组织病理学检查也可见到迂曲、扩张的毛细血管。有文献报告病变的子宫ESC VEGF分泌量明显增高,并通过旁分泌作用促进微血管增生[8]。目前治疗EMT的常用药物有芳香酶抑制剂、促性腺激素释放激素拮抗剂、选择性孕激素受体调节剂[9-10]。而针对血管形成的抑制药物鲜有报告。因此,筛选可抑制VEGF的表达及异位病灶的微血管生成,促进异位内膜细胞萎缩坏死,从而抑制EMT发展的血管生成抑制剂,将为EMT的治疗提供新的途径。
早在20世纪90年代就有学者发现沙利度胺具有抑制血管生成的作用[11]。有学者者认为,沙利度胺抗血管生成的作用取决于其对VEGF及碱性成纤维细胞生长因子的影响。有学者在多发性骨髓瘤治疗方法的探索性研究中发现,沙利度胺能够减少骨髓瘤间质细胞VEGF的分泌[12]。此外,还有研究表明,沙利度胺不仅能够降低细胞分泌VEGF水平,而且可以通过抑制VEGF的蛋白表达,进一步抑制细胞的迁移、毛细血管的生成及血管的形成[13]。本研究结果显示,不同浓度沙利度胺组细胞的凋亡率升高,迁移及修复能力、穿膜细胞数、细胞VEGF表达量较空白组下降(P<0.05),且随着沙利度胺浓度升高,细胞抑制率升高(P<0.05),提示人EMT患者ESC经沙利度胺处理后,细胞的增殖、迁移运动、修复及体外侵袭能力均明显下降,特别是细胞分泌的VEGF水平明显减少,与上述研究结果相符。笔者推测沙利度胺对EMT患者ESC的生长抑制作用,有可能是通过抑制血管生成的作用而实现的。
[1] 郑婷萍,孙爱军,郎景和,等.北京协和医院住院患者不孕症与子宫内膜异位症30年变化趋势[J].中华妇产科杂志,2015,50(8):591-595.
[2] 冷金花,戴 毅.子宫内膜异位症诊治热点问题[J].中国实用妇科与产科杂志,2014,30(1):17-20.
[3] 郭 永,赵爱华,苏 晨,等.米非司酮抑制人子宫内膜基质细胞增殖[J].生殖医学杂志,2014,23(6):475-479.
[4] Laschke MW,Giebels C,Menger MD.Vasculogenesis:a new piece of the endometriosis puzzle[J].Hum Reprod Update,2011,17(5):628-636.
[5] Wu J,Ng J,Christos PJ,et al.Chronic thalidomide and chemoembolization for hepatocellular carcinoma[J].Oncologist,2014,19(12):1 229-1 230.
[6] Sundqvist J,Andersson KL,Scarselli G,et al.Expression of adhesion,attachment and invasion markers in eutopic and ectopic endometrium:a link to the aetiology of endometriosis[J].Hum Reprod,2012,27(9):2 737-2 746.
[7] Huang F,Cao J,Liu Q,et al.MAPK/ERK signal pathway involved expression of COX-2 and VEGF by IL-1β induced in human endometriosis stromal cells in vitro[J].Int J Clin Exp Pathol,2013,6(10):2 129-2 136.
[8] Xu H,Zhang T,Man GC,et al.Vascular endothelial growth factor C is increased in endometrium and promotes endothelial functions,vascular permeability and angiogenesis and growth of endometriosis[J].Angiogenesis,2013,16(3):541-551.
[9] Xiong W,Zhang L,Yu L,et al.Estradiol promotes cells invasion by activating β-catenin signaling pathway in endometriosis[J].Reproduction,2015,150(6):507-516.
[10]姜 涛.子宫内膜异位症患者腹腔镜术后应用GnRH-与孕三烯酮的临床效果比较[J].山东医药,2014,54(26):36-38.
[11]Kruse FE,Joussen AM,Rohrschneider K,et al.Thalidomide inhibits corneal angiogenesis induced by vascular endothelial growth factor[J].Graefes Arch Clin Exp Ophthalmol,1998,236(6):461-466.
[12]Li X,Liu X,Wang J,et al.Thalidomide down-regulates the expression of VEGF and bFGF in cisplatin-resistant human lung carcinoma cells[J].Anticancer Res,2003,23(3B):2 481-2 487.
[13]王达安,林逸心,王 峥,等.沙利度胺抑制TGF-β1诱导的HELF细胞中结缔组织生长因子基因启动子的激活[J].中国病理生理杂志,2014,3(4):693-697.
Effects of thalidomide on endometrial stromal cells in patients with endometriosis and its mechanism
LINing1,PENGXing2,LIDan-rong3,YAOLiang-qing4,HUANGYu-kui1,FANYu-juan5
(1DepartmentofGynaecology,theMaternalandChildHealthHospitalofNanning,Nanning530001,China;2SchoolofPharmacy,GuangxiMedicalUniversity,Nanning530021,China;3ExperimentalCenterforTumorResearch,theAffiliatedTumorHospitalofGuangxiMedicalUniversity,Nanning530021,China;4DepartmentofGynaecology,GynaecologyandObstetricsHospitalAffiliatedtoFudanUniversity,Shanghai200011,China;5DepartmentofGynaecology,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To explore the effects of thalidomide on the proliferation,migration motion,repair and invasive ability in vitro of endometrial stromal cells(ESCs) in patients with endometriosis(EMT) and its mechanism.Methods The ESCs of patients with EMT primarily cultured in vitro,and were treated with various concentrations(500.00,250.00,125.00,62.50 and 31.25 μg/ml) of thalidomide for 24 and 48 hours respectively.Methyl thiazolyl tetrazolium method was used to detect the inhibition rate of ESCs.Another ESCs were divided into blank group(0 μg/ml thalidomide),15 μg/ml thalidomide group and 30 μg/ml thalidomide group.Scratch-wound assay and Transwell assay were used to determine the effects of thalidomide on the abilities of migration motion and repair,and invasive ability in vitro of ESCs respectively.The apoptosis rates of ESCs were analyzed by flow cytometry after 24 hours of intervention with thalidomide.The effect of thalidomide on the expression of vascular endothelial growth factor(VEGF) protein of ESCs was detected by enzyme-linked immunosorbent assay.Results Compared to the blank group,the abilities of migration and repair,transmembrane cells decreased and cell apoptosis rate increased in the 15 and 30 μg/ml thalidomide groups(P<0.05).The cell inhibition rate was elevated with the increase of the intervention concentration of thalidomide(P<0.05).The expression of VEGF protein in the 15 or 30 μg/ml thalidomide groups was significantly lower than that in the blank control group(P<0.05).Conclusion Thalidomide can inhibit the abilities of proliferation and migration motion,and invasive ability in vitro of ESCs in patients with EMT,and can induce the cell apoptosis.And the mechanism may be related to down-regulation of the secretion of VEGF protein in cells.
Endometriosis,Thalidomide,Endometrial Leydig′s cell,Vascular endothelial growth factor,Cell proliferation,Migration,Invasion
广西科学研究与技术开发计划(桂科攻12300016);广西南宁市科技局项目(20133174)
李宁(1978~),女,硕士,副主任医师,研究方向:子宫内膜异位症的基础及临床。
彭兴(1979~),女,硕士,讲师,研究方向:药物化学,E-mail:625025109@qq.com。
R 711.71
A
0253-4304(2016)08-1062-04
10.11675/j.issn.0253-4304.2016.08.03
2016-03-23
2016-06-12)

