阿尔茨海默病后扣带回3.0T磁共振质子波谱成像的研究
梁茗+李中春

[摘要] 目的 探讨阿尔茨海默病(AD)患者后扣带回磁共振波谱的特点。 方法 选取临床确诊AD患者20例及相匹配的正常对照患者20例,均行头颅常规后扣带回的单体素磁共振波谱检测,应用SPSS12.0软件对AD组与对照组进行统计学分析。 结果 与正常对照组相比,AD患者组后扣带回NAA/Cr、NAA/mI、Cho/Cr分别为(1.72±0.13)、(1.62±0.47)、(1.58±0.25),对照组分别为(2.51±0.21)、(2.84±0.28)、(1.04±0.31),两组比较差异有统计学意义(P<0.05);AD 患者组后扣带回mI/Cr为(1.31±0.12),较对照组(0.68±0.17)升高,差异有统计学意义(P<0.05)。 结论 3.0T磁共振单体素成像能早期检测到AD患者后扣带波谱变化,可为早期AD患者提供客观的诊断依据。
[关键词] 阿尔茨海默病;磁共振波谱;后扣带回
[中图分类号] R445.2;R749.16 [文献标识码] B [文章编号] 1673-9701(2015)26-0082-04
Study on posterior cingulate cortex(PCC) in patients of alzheimers disease (AD) by 3.0T single-voxel proton-magnetic resonance spectroscopy
LIANG Ming1 LI Zhongchun2
1.Department of Psychiatry, the Third People's Hospital of Xiangshan County in Zhejiang Province, Xiangshan 315711, China; 2.Department of Neurology, Tongde Hospital in Zhejiang Province, Hangzhou 310012, China
[Abstract] Objective To evaluate the characteristics of single-voxel proton-magnetic resonance spectroscopy of posterior cingulate cortex (PCC) in patients of Alzheimers disease (AD). Methods Twenty AD and twenty matched healthy controls were studied with single-voxel 1H-MRS in PCC using the Siemens 3.0 T Trio MR scanner. Statistical analysis was applied using SPSS12.0 between AD and twenty matched healthy control groups. Results The ratio of NAA/Cr, NAA/mI, Cho/Cr and mI/Cr of PCC in AD group were(1.72±0.13), (1.62±0.47), (1.58±0.25), (1.31±0.12) respectively, while the above ratio were (2.51±0.21), (2.84±0.28), (1.04±0.31), (0.68±0.17) in normal group. Compared with normal group, the ratio of NAA/Cr, NAA/mI and Cho/Cr of PCC in AD group were significantly decreased and the ratio of mI/Cr was significantly increased in AD group(P<0.05). Conclusion 3.0T single-voxel proton-magnetic resonance spectroscopy can detect the change of posterior cingulate cortex in AD patients and provide an objective clinical diagnosis for AD.
[Key words] Alzheimers disease; Proton-magnetic resonance spectroscopy; Posterior cingulate cortex
阿尔茨海默病(Alzheimers disease,AD)是一种临床上最常见的老年性痴呆症,占老年痴呆患者的50%~60%[1]。它是一种以神经退行性改变为特征的进行性认知功能障碍和记忆损害的疾病[2]。AD的病理特征主要包括神经斑、神经元纤维缠结沉积和脑胆碱神经元细胞的凋亡。其中的神经元变性导致神经斑的形成和神经纤维的退行性改变导致的神经纤维缠结是最具其特征性的变化[3]。扣带回是边缘系统的重要组成部分之一,与人类认知、情绪及心理等功能活动密切相关,后扣带回(posterior cingulate cortex,PCC)是与记忆、情感等功能密切相关的神经结构。有报道阐明,PCC是AD患者最早受累的脑功能区之一[4,5],在脑内的形态学未发生变化(主要为萎缩)的情况下,PCC的肌醇(myo-inositol,mI)已经发生显著地升高,但是研究数量和深度有限。本研究旨在探讨阿尔茨海默病患者后扣带回磁共振波谱变化特点,为早期诊断AD提供客观依据。现报道如下。
1 资料与方法
1.1 临床资料
选取来自我院与合作医院浙江省立同德医院2013年3月~2015年1月期间老年科就诊的Alzheimer病患者20例,男13例,女7例,年龄71~92岁,平均(74.2±5.8)岁,受教育程度为高中以下15例,高中及以上5例。入组标准:符合美国国立神经疾病及交流障碍与卒中研究所-阿尔茨海默病及相关疾病学会(NINCDS-ADRDA)制定的AD标准[6]。另选取正常健康志愿者20例,男12例,女8例,年龄75~91岁,平均(73.2±4.7)岁,受教育程度为高中以下16例,高中及以上4例。AD组与健康对照组均为右利手。AD组与对照组性别与教育程度比较(χ2=0.142、0.173,P>0.05),差异无统计学意义。两组受试者年龄比较差异无统计学意义,简易智能状态检查表(mini-mental state examination,MMSE)评分及临床痴呆量表(clinical dementia rating,CDR)评分比较差异有统计学意义(P<0.05)。见表1。
表1 两组年龄、MMSE 评分及CDR 评分比较(x±s)
1.2 检查方法
应用西门子3.0T磁共振进行颅脑扫描。首先进行颅脑常规MRI横断扫描:T1加权像(T1WI)TR 2000 ms,TE 9 ms;T2加权像(T2WI)TR 5000 ms,TE 94 ms;T2黑水像(T2-dark-fluid)TR 8500 ms,94 ms,层厚5 mm,层间隔5 mm。之后行矢状位、横断位和冠状位3D-T1WI覆盖全脑的结构像扫描,进行三平面MPR 重建,将三平面MPR重建感兴趣区定位于后扣带回进行波谱成像扫描。采用单体素波谱扫描序列[7,8]。扫描参数:TR 1850 ms,TE 2.0 ms,视野240 mm×240 mm,反转角90°,层厚1 mm,层间距 0,矩阵 1024×1024,体素大小1 mm×1 mm×1 mm水激发BW35MHz,采集BW 1000 MHz。感兴趣区外的预饱和和人工手动匀场结束后,在水脂抑制的情况下进行波谱采集,然后在偏转角90°的无水抑制再行扫描。扫描中注意每个谱线与无水抑制扫描谱线进行有效地结合,尽量消除涡流的影响,最后对谱线基线校正及相位调节,测量出各代谢产物波峰的峰高波谱,总采集时间范围在8~10 min。
1.3 数据后处理
利用西门子后处理Syngo波谱分析软件[9]。各代谢物的化学频移位置为:肌酸(creatine,Cr)3.02 ppm,N-乙酰天门冬氨酸(N-acetylaspartate,NAA)2.02 ppm,肌醇(myo-inositol,mI)3.56 ppm,胆碱(choline,Cho)3.22 ppm。以Cr为内参照计算各代谢物的相对浓度。Syngo波谱软件可以完成波谱曲线的各项自动调整功能[10]。
1.4 统计学分析
应用SPSS 12.0统计学软件进行数据处理。计数资料以相对数构成比(%)表示,采用χ2检验,计量资料以均数±标准差(x±s)表示,两组比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
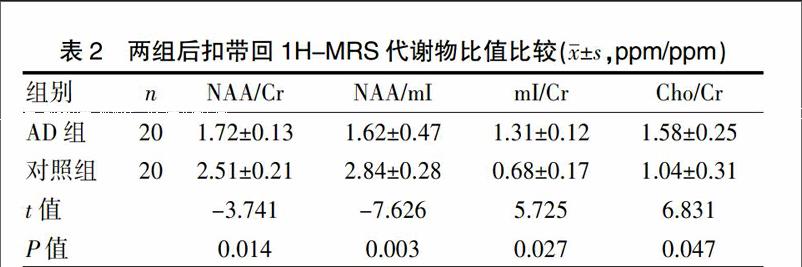
AD组和对照组后扣带回1H-MRS各代谢物比值比较中,AD组NAA峰较对照组减低,mI峰较对照组升高,NAA/Cr与NAA/mI比值较对照组均降低,差异有统计学意义(t=-3.741、-7.626,P<0.05);AD组Cho/Cr 较正常对照组升高,差异有统计学意义(t=6.831,P=0.047)。AD组mI/Cr比值(1.31±0.12)较对照组比值(0.68±0.17)明显升高,差异有统计学意义(P=0.027)。见表2。
表2 两组后扣带回1H-MRS代谢物比值比较(x±s,ppm/ppm)
3 讨论
阿尔茨海默病(AD)是以渐进性遗忘为主要症状的一种神经退行性疾病,其最具特征性的病理表现是老年斑的形成和神经纤维缠结。而且经常累及小动脉导致血管淀粉样变性[11,12]。其中淀粉样斑块的核心成分是以β淀粉样多肽(Aβ)为主要成分,内含病理性斑块,其主要成分为变性的轴突、神经纤维以及胶质细胞。Aβ经常会引起神经细胞毒性反应,使神经细胞变性,促进炎症反应的发生,最终导致细胞的凋亡,神经胶质反应性增生[13,14],进而导致神经元功能进行性破坏[15]。此外,在引起AD患者的病情进展过程中,Tau蛋白也是重要的促进物质,Tau蛋白进行性地过度酸化,从而影响神经元的生理性代谢,最终导致神经元的变性和凋亡[16]。AD患者的颅内生化改变的病理特征是Aβ和Tau蛋白协同作用结果。中晚期AD患者所累及区域结构变化(主要为颅脑特定区域结构的萎缩)在低场强的磁共振成像中有大量报道,但是其无法观察到AD早期在生化的变化,这是不争的事实[17]。随着磁共振的场强不断提高,磁共振的软件技术的进一步发展,使得功能与分子医学影像学得到进一步飞速发展。MRS在AD的研究方法和领域开辟了新的思路。不仅在形态学上,高场磁共振的薄层扫描及二维、三维重建技术为AD脑组织特异性的脑萎缩区域及面积、体积的测量得到完善和发展,而且MRS 能无创性测定活体内代谢物浓度,分析和评估脑细胞变性疾病AD的活体组织内物质代谢变化的异常,对无创性分析活体AD患者脑组织生化代谢和病理生理的改变,也对AD 的早期诊断和鉴别诊断具有重要价值[18]。
以往的磁共振波谱成像对AD的研究常常关注于颞叶内侧,主要包括杏仁核、海马、海马旁回、内嗅皮层等结构,特别对海马的研究已经有了大量的文献报道[19]。但周围结构复杂的海马无疑给研究增加了对数据准确性质疑,因为海马靠近蝶鞍区,颅底骨质、鞍上池和海绵窦大血管都对其磁共振波谱产生影响,要准确地显示短TE代谢物的波谱,存在较大困难,且容易出错。另外最近有研究发现PCC是大脑结构中学习和记忆的神经回路,特别是后扣带回皮层在记忆、遗忘等学习的神经心理功能作用过程中发挥着一定的作用,在AD早期即可受累。该脑区代谢和功能的损害会进一步影响大脑的学习和记忆功能[20]。但是对PCC的研究目前文献报道仍比较少。因此AD患者PCC区的早期颅内生化病理代谢变化成为本研究的重点。此外,研究PCC有其自身的优势,因为PCC区周围结构易于辨别,并无颅骨及气体伪影的干扰,可以较容易获得稳定波谱数据,得到数据比较可靠,故本研究把波谱成像放在PCC区,以其获得良好效果。
磁共振单体素1H-MRS可以检测出的脑内代谢物有NAA、Cho及Cr和mI等微量元素[21]。Cr与脑内能量代谢有关,在生理及病理状况下在体内相对稳定,常常作为分数的分子来评价其他各代谢物的变化。存在于神经元和轴突的NAA是神经元完整性的标志,NAA减少提示神经元数目减少及活性减低。Cho参与细胞膜和髓鞘的形成,并与脑内胆碱能神经递质的合成有关,在细胞膜损害时往往会增高,反映细胞的损害。mI只存在于神经胶质细胞中,往往细胞损伤后进一步的胶质增生修复时增高,所以被认为是反映细胞毒性水肿神经胶质增生[22]。在磁共振波谱分析软件中,我们常计算分析NAA/Cr、mI/Cr、NAA/mI 和Cho/Cr 之间的相对比值,进行颅脑内分子水平的分析。
近来的文献报道是AD最突出的波谱改变为PCC的NAA明显降低,与以往文献报道AD在最先海马出现mI/Cr增高,仍存在较大的争议。但是达到共识的是在脑内NAA在不同区域的降低可见于不同类型的痴呆[23]。本组研究结果显示, PCC的NAA/Cr、NAA/mI与对照组比较,均明显降低,差异有统计学意义(P<0.05),说明AD患者PCC区域的细胞膜得到一定的损害;AD组患者PCC区域的mI/Cr比值增高,与对照组比较差异有统计学意义,表明PCC区域的神经胶质细胞增生活跃,神经元的破坏、神经胶质的增生互相因果,往往是病情进展的标志,这两点与以往的报道基本一致。以往的研究中AD患者的PCC区域的Cho/Cr变化尚存在较大争议,Cho/Cr的比值目前也存在较大的争议,本组研究资料显示,与正常对照组相比,AD组Cho/Cr比值升高,差异有统计学意义(P<0.05),分析原因不排除进行纳入处理时患者有个体出现服药情况或样本数量较小以及抽样误差的出现。
目前对于AD患者的PCC区的研究仍存在一些问题,值得在以后的研究中注意。对于AD患者PCC区的研究,以往的文献多集中在1.5T磁共振的研究中,得到了一些数据。但是是否3.0T磁共振会对PCC区的研究得到更精准的数据仍存在一些争议。因为3.0T磁共振对于场强的均匀度有更高的要求。所以我们采用手动匀场,保证在感兴趣区内的FWHM<20 Hz,从而保证了波谱基线的稳定、图像质量及结果的准确性。另外,本实验采用单体素波谱成像,区别以往多体素波谱成像,为减轻干扰因素采用三维T1的全脑薄层大范围扫描。
本研究仍存在一些不足,值得以后的工作中进一步改进。首先研究的样本量过小,以后应该加大研究的样本数量,以期得到更精确的数据。再者受技术设备及检查时间的限制,无法对研究样本进行检查时间的限制,无法得知是否AD患者和对照组是否在不同检查时间的脑内波谱比值改变存在差异。
综上所述,磁共振波谱单体素成像是无创性检查技术,可检测活体细胞水平化合物的代谢情况,其对于AD的PCC区域波谱检测可为早期AD患者提供客观的诊断资料。
[参考文献]
[1] Modrego PJ,Fayed NPina MA. Conversion from mild cognitive impairment to probable Alzheimers disease predicted by brain magnetic resonance spectroscopy[J]. Neurology,2014,31(4):1032-1035.
[2] Kantarci K. 1H magnetic resonance spectroscopy in dementia[J]. Medical Clinics of North America,2014,24(6):1021-1023.
[3] Kumar A,Thomas A,Lavretsky H,et al. Frontal white matter biochemical abnormalities in late-life major depression detected with proton magnetic resonance spectroscopy[J]. Neurology,2014,37(12):1551-1558.
[4] Krishnan KRR,Charles HC,Doraiswamy PM,et al. Randomized,placebo-controlled trial of the effects of donepezil on neuronal markers and hippocampal volumes in Alzheimers disease[J]. Medical Clinics of North America,2014,15(2):845-848.
[5] Westman E,Aguilar C,Muehlboeck J-S,et al. Regional magnetic resonance imaging measures for multivariate analysis in Alzheimers disease and mild cognitive impairment[J]. Brain Topography,2013,26(5):19-23.
[6] Graff-Radford JKantarci K. Magnetic resonance spectroscopy in Alzheimers disease[J]. Neuropsychiatric Disease and Treatment,2013,9(3):687-689.
[7] Teipel SJ,Grothe M,Lista S,et al. Relevance of magnetic resonance imaging for early detection and diagnosis of Alzheimer disease[J]. Medical Clinics of North America,2013,97(3):399-424.
[8] O'brien J. Role of imaging techniques in the diagnosis of dementia[J]. Brain,2012,26(10):1161-1164.
[9] Tumati S,Martens SAleman A. Magnetic resonance spectroscopy in mild cognitive impairment:Systematic review and meta-analysis[J]. Neuroscience & Biobehavioral Reviews, 2013,37(8):2571-2586.
[10] Ryan NS,Keihaninejad S,Shakespeare TJ,et al. Magnetic resonance imaging evidence for presymptomatic change in thalamus and caudate in familial Alzheimers disease[J].Brain,2013,136(16):1399-1414.
[11] Leung KK,Bartlett JW,Barnes J,et al. Cerebral atrophy in mild cognitive impairment and Alzheimer disease Rates and acceleration[J]. Neurology,2013,80(18):648-654.
[12] Haris M,Nath K,Cai K,et al. Imaging of glutamate neurotransmitter alterations in Alzheimer's disease[J]. NMR in Biomedicine,2013,26(8):386-391.
[13] Kantarci K. Magnetic resonance spectroscopy in common dementias[J]. Neuroimaging Clinics of North America,2013,23(12):393-406.
[14] Forster D,Davies K,Williams S. Magnetic resonance spectroscopy in vivo of neurochemicals in a transgenic model of Alzheimer's disease: A longitudinal study of metabolites,relaxation time,and behavioral analysis in TASTPM and wild-type mice[J]. Magnetic Resonance in Medicine,2013,69(21):944-955.
[15] Zahr NM,Mayer D,Rohlfing T,et al. In vivo glutamate measured with magnetic resonance spectroscopy:Behavioral correlates in aging[J]. Neurobiology of Aging,2013, 34(15):1265-1276.
[16] Trushina EMielke MM. Recent advances in the application of metabolomics to Alzheimer's Disease[J]. Biochimicaet Biophysica Acta(BBA)-Molecular Basis of Disease,2014,18(6):1232-1239.
[17] Fayed N,Del Hoyo YL,Andres E,et al. Brain changes in long-term zen meditators using proton magnetic resonance spectroscopy and diffusion tensor imaging:A controlled study[J]. PloS One,2013,8(3):584-588.
[18] Haris M,Singh A,Cai K,et al. MICEST:A potential tool for non-invasive detection of molecular changes in Alzheimer's disease[J]. Journal of Neuroscience Methods,2013,212(23):87-93.
[19] Menezes TL,Andrade-Valen?觭a LPAValen?觭a MM. Magnetic resonance imaging study cannot individually distinguish individuals with mild cognitive impairment,mild Alzheimer's disease,and normal aging[J]. Arquivos de neuro-psiquiatria,2013,71(21):207-212.
[20] Kantarci K. Proton MRS in mild cognitive impairment[J].Journal of Magnetic Resonance Imaging,2013,37(14):770-777.
[21] Van Duijn S,Nabuurs RJ,Van Duinen SG,et al. Longitudinal monitoring of sex-related in vivo metabolic changes in the brain of Alzheimer's disease transgenic mouse using magnetic resonance spectroscopy[J]. Journal of Alzheimer's Disease,2013,34(6):1051-1059.
[22] Henry MS,Passmore AP,Todd S,et al. The development of effective biomarkers for Alzheimer's disease:A review[J].International Journal of Geriatric Psychiatry,2013,28(7):331-340.
[23] Risacher SL,Saykin AJ. Neuroimaging and other biomarkers for Alzheimer's disease:The changing landscape of early detection[J]. Annual Review of Clinical Psychology,2013,9(2):621-624.
(收稿日期:2015-05-15)

