翻白草黄酮对2型糖尿病大鼠胰岛细胞的保护作用及机制研究
宿世震 项东宇 孟繁伟 张钦德
264199 烟台,山东中医药高等专科学校西医教学部[宿世震(硕士研究生)、孟繁伟],中药系(项东宇、张钦德)
·论著·
翻白草黄酮对2型糖尿病大鼠胰岛细胞的保护作用及机制研究
宿世震项东宇孟繁伟张钦德
264199烟台,山东中医药高等专科学校西医教学部[宿世震(硕士研究生)、孟繁伟],中药系(项东宇、张钦德)
【摘要】目的研究翻白草黄酮对2型糖尿病大鼠胰岛细胞的保护作用及机制。方法采用高脂高糖饲料喂养大鼠6周后,腹腔注射链脲佐菌素复制2型糖尿病大鼠模型。成模大鼠随机分为模型组、阳性药物对照组(罗格列酮,4 mg/kg)、翻白草黄酮低剂量组(3 g/kg)、翻白草黄酮高剂量组(6 g/kg),同批次健康大鼠作为实验的正常对照组,每组10只。药物干预4周后,微量血糖仪检测空腹血糖(fasting blood glucose,FBG)、放免法测定空腹胰岛素(fasting insulin,FINS)并计算胰岛素敏感性指数(insulin sensitivity index,ISI)、ELISA法测定肿瘤坏死因子(tumor necrosis factor-α,TNF-α)及白细胞介素-6(interleukin-6,IL-6)水平;部分胰腺组织匀浆后黄嘌呤氧化酶法测定超氧化物歧化酶(superoxide dismutase,SOD)水平、硫代巴比妥酸法测定丙二醛(malondialdehyde,MDA)含量;取部分胰腺制作病理切片,光镜下观察胰腺组织形态变化。结果翻白草黄酮可降低大鼠的FBG、FINS、TNF-α、IL-6水平及改善胰岛素抵抗,明显提高大鼠胰腺组织中的SOD水平、降低MDA含量。病理切片显示胰岛细胞损伤明显减轻,翻白草黄酮高剂量组(6.0 g/kg)作用明显。结论翻白草黄酮对2型糖尿病大鼠胰岛细胞具有保护作用,其保护作用可能是通过减轻胰腺组织内的氧化应激水平及降低全身炎症反应而实现的。
【关键词】翻白草;黄酮;2型糖尿病;大鼠;保护作用
糖尿病是以慢性血糖升高为特征的代谢紊乱性疾病,发病率逐年上升,目前认为,氧化应激、炎症因子与糖尿病的关系密切,二者均可导致胰岛β细胞损伤[1-2]。翻白草PotentilladiscolorBung.属蔷薇科委陵菜属,又名鸡腿根、天青地白等,其味甘、微苦,性平,无毒,全草及根入药,主要含有萜类、黄酮类、多酚类等成分,具有抗菌、利尿、降糖、调脂等作用[3]。研究显示,翻白草具有改善糖尿病大鼠胰岛素抵抗的作用[4],而黄酮类是翻白草的主要活性部位,故通过动物实验的方法,探讨翻白草黄酮对大鼠胰岛细胞的保护作用及机制。
1材料和方法
1.1动物
健康Wister大鼠,SPF级,雄性,由山东大学实验动物中心提供,医学实验动物合格证号:SCXK(鲁)20090001,体质量195~206 g,饮水及摄食自由。
1.2实验药物
翻白草黄酮:翻白草,经山东中医药高等专科学校鉴定教研室张钦德教授鉴定为中药翻白草PotentilladiscolorBung.的全草,烘干粉碎,90%乙醇,料液比1∶8,提取3次,合并提取液,减压浓缩、萃取,减压回收后真空干燥、粉碎过筛,冷藏备用。提取物中黄酮含量为70.5%,1 g提取物相当于生药83 g,使用前,现配溶液浓度为72 mg/mL(相当于生药6 g/mL)、复温至25~30℃后进行灌胃治疗。罗格列酮片(成都恒瑞制药有限公司,批号:201400319)。
1.3试剂与仪器
链脲佐菌素(streptozocin,STZ)(美国Sigma公司,批号:S0130)。血清胰岛素(fasting insulin,FINS),批号:20140326;白细胞介素-6(interleukins,IL-6),批号:20140314;肿瘤坏死因子-α(tumor necrosis factor,TNF-α),批号:20140306;超氧化物歧化酶(superoxide dismutase,SOD),批号20140319;考马斯亮兰蛋白,批号:20140318;丙二醛(malondialdehyde,MDA)试剂盒,批号:20140318;以上试剂盒均购于南京建成生物工程研究所。
微量血糖仪及配套试纸(德国罗氏诊断公司);680酶标仪(美国Bio-rad公司);SN-695 B型智能放免r测量仪(上海原子核研究所日环仪器一厂);CX21BIM-SET6光学显微镜(日本奥林巴斯有限公司)。
1.4模型制备、分组及给药
60只大鼠,适应性喂养1周后,按体质量分层随机数字表法取10只作为正常对照组,普通饲料喂养;余50只高脂高糖饲料(饲料配方:猪油18%、蔗糖20%、蛋黄3%、基础饲料59%)喂养,4周后,禁食12小时,1% STZ按40 mg/kg腹腔注射,1周后测糖负荷2小时血糖值,≥11.1 mmol/L为初选指标,稳定1周后分组[5],最终成模42只。成模大鼠随机数字表法分为四组,每组10只,即模型组、阳性药物对照组(罗格列酮,4 mg/kg)、翻白草黄酮低、高剂量组(以生药计,6 g/kg,12 g/kg)。正常对照组及模型组每次等体积的蒸馏水。灌胃给药,每天1次,连续28天。
1.5指标检测
实验结束后(禁食8小时),剪尾取血,微量血糖仪检测空腹血糖(fasting blood glucose,FBG)。3%戊巴比妥麻醉后,腹主动脉取血,分离血清,-20℃保存待测。放射免疫法测定空腹胰岛素(fasting insulin,FINS),酶联免疫法测定血清TNF-α、IL-6。计算胰岛素敏感性指数(insulin sensitivity index,ISI),ISI= 1/FBG×FINS。取血后立即取胰腺组织,部分用冷生理盐水漂洗,拭干称重、放入盛有预冷匀浆介质的烧杯中,剪碎组织,倒入匀浆器中研磨成组织匀浆,30000 rmp离心10分钟,吸取上清液待测,黄嘌呤氧化酶法测定SOD水平、硫代巴比妥酸法测定MDA水平。部分胰腺组织常规固定、包埋制备石蜡切片后HE染色。
1.6统计学处理


表1 翻白草黄酮对糖尿病大鼠FBG、FINS、ISI 的影响±s,n=10)
注: 与正常对照组比较,aP<0.01;与模型组比较,bP<0.01;与罗格列酮组比较,cP<0.01。
2结果
2.1翻白草黄酮对糖尿病大鼠一般状态的影响
实验过程中,正常对照组大鼠活泼、毛发整齐光滑、反应灵敏;造模大鼠在高脂高糖饲料喂养结束时形体肥胖、体质量增加明显,注射STZ后逐渐呈现精神萎靡、懒动、多食、多尿,垫料潮湿臊臭,每日需更换垫料2次,同时模型大鼠体质量较造模前降低明显。给予药物干预4周后,与模型组比较,翻白草黄酮低、高剂量组大鼠的状态明显好转,进食量、饮水量改善,体质量有所增加,毛发较整齐、光滑,且活动增加。
2.2翻白草黄酮对糖尿病大鼠FBG、FINS、ISI的影响
模型组大鼠的FBG、FINS水平升高、ISI降低,与正常对照组比较差异显著(P<0.01),符合2型糖尿病的特点,提示模型复制成功。干预28天后,翻白草黄酮低、高剂量组的FBG、FINS水平下降,ISI升高,与模型组比较差异具有统计学意义(P<0.01),呈剂量依懒性,但作用不及罗格列酮,见表1。
2.3翻白草黄酮对糖尿病大鼠胰腺组织中SOD、MDA的影响
模型组大鼠胰腺组织中SOD水平下降、MDA含量升高,与正常对照组比较,差异具有统计学意义(P<0.01)。干预28天后,翻白草黄酮低、高剂量组胰腺组织中的SOD水平升高、MDA水平下降,与模型组比较,差异具有统计学意义(P<0.01),作用优于罗格列酮组(P<0.01),翻白草黄酮高剂量组作用明显,见表2。
2.4翻白草黄酮对糖尿病大鼠血清炎症因子的影响
模型组大鼠TNF-α、IL-6水平呈现升高,与正常对照组比较,差异具有统计学意义(P<0.01);干预28天后,翻白草低、高剂量组大鼠的TNF-α、IL-6水平均不同程度降低,与模型组比较,差异具有统计学意义(P<0.01)。高剂量组作用明显,见表3。

表2 翻白草黄酮对糖尿病大鼠胰腺组织中SOD、
注: 与正常对照组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05;与罗格列酮组比较,dP<0.01。

表3 翻白草黄酮对糖尿病大鼠血清
注: 与正常对照组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05;与罗格列酮组比较,dP<0.01。
2.5翻白草黄酮对糖尿病大鼠胰腺形态的影响
每张切片观察5个视野(×200),计算细胞总数后取各张平均值进行比较。正常对照组大鼠胰岛β细胞数较多,细胞核清楚,细胞界限清晰。模型组大鼠胰岛体积缩小,β细胞数减少。与模型组比较,罗格列酮组及翻白草黄酮给药组胰岛体积增加,β细胞数增多。表明翻白草黄酮对糖尿病大鼠的胰岛具有保护作用,见图1。
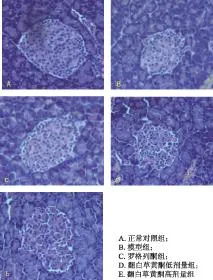
图1 翻白草黄酮对糖尿病大鼠胰腺形态的影响
3讨论
高脂高糖饲料喂养联合链脲佐菌素腹腔注射是近年来复制2型糖尿病大鼠模型较为常用的方法,本实验中也采用了此方法,模型组大鼠出现了多尿、多饮、体重下降等表现,同时FBG、FINS升高及ISI下降,提示大鼠出现高糖、胰岛素抵抗表现,符合2型糖尿病模型特征。翻白草黄酮治疗后,FBG及FINS水平下降、ISI提高,与文献报道一致[4],翻白草具有改善2型糖尿病大鼠糖代谢紊乱及胰岛素抵抗的作用。同时在实验中观察到,翻白草黄酮可缓解糖尿病模型大鼠的“三多一少”症状及精神状态。
“共同土壤”[6]学说的提出,让人们注意到了氧化应激在糖尿病发生、发展中的作用。正常情况下,体内在代谢过程中生成的活性氧簇(reactive oxygen species,ROS)或活性氮簇,可被机体的抗氧化系统及时清除,若产生过多,超过机体清除能力,可导致组织、细胞的损伤,即为氧化应激。胰岛β细胞内的抗氧化酶水平较低,对氧化应激敏感,所以更容易受到ROS的攻击而受损[7]。目前认为,氧化应激可激活c-Jun氨基酸末端激酶,继而激活蛋白转录因子的磷酸化,直接调控β细胞中凋亡相关基因的表达而促进β细胞凋亡;增多的活性氧还可促使生物膜脂质过氧化,致使细胞膜通透性增加,钙内流增加,继而激活磷脂酶,促进膜磷脂分解,导致β细胞损伤。而抗氧化剂可抑制β细胞凋亡[8],进一步说明了氧化应激参与β细胞的损伤过程。在评价氧化应激时多采用SOD、MDA的含量测定,SOD是机体主要的抗氧化酶,可以清除自由基而减轻氧化应激损伤,其水平可以反映机体的抗氧化能力;MDA是生物膜脂质过氧化的产物,其水平可以反映体内的脂质过氧化程度。本研究结果显示,模型组大鼠胰腺组织中的SOD水平降低、MDA水平升高,镜下观察胰岛萎缩、体积缩小、β细胞减少,说明糖尿病大鼠胰腺组织中存在氧化应激状态,其自由基清除能力降低,抗氧化能力降低,β细胞损伤。翻白草黄酮治疗后,与模型组大鼠比较,胰腺组织中的SOD水平升高、MDA水平降低,镜下观察胰岛体积增加、β细胞数增加,表明翻白草黄酮对胰岛β细胞具有修复作用,其机制可能与降低糖尿病大鼠胰腺组织内的脂质过氧化、提高其抗氧化能力有关。
近年来提出,2型糖尿病是一种自然免疫和低度炎症性疾病,炎症因子与糖尿病及其并发症的关系密切,体内的糖代谢紊乱可以刺激炎症因子(如IL-6、TNF-α等)大量的生成,胰岛β细胞同样出现炎症反应,继而功能障碍和凋亡[2,9]。IL-6主要由白细胞合成分泌,可加速胰岛素受体底物的降解,抑制酪氨酸自身磷酸化及磷脂酸肌醇-3-激酶活性,促进胰岛β细胞的凋亡;高浓度的IL-6还可以诱导胰腺β细胞胞浆内不透明物质产生、自体吞噬的出现和线粒体的变形等细胞超微机构的变化,这些变化共同引起胰岛β细胞死亡[10]。TNF-α主要由激活的巨噬细胞释放,可以刺激β细胞内诱导型一氧化氮合酶在胰岛细胞内的表达增加,促进NO的合成,从而影响β细胞的生长和增殖[11],NO又能激活巨噬细胞释放促炎症因子,可激活核转录因子-кB,通过Fas途径引起β细胞凋亡[12]。因此,炎症状态可导致胰岛β细胞损伤,促进糖尿病的发生、发展。本实验研究中,糖尿病模型组大鼠的TNF-α、IL-6水平显著高于正常对照组,证实了2型糖尿病大鼠体内存在炎症因子的过度表达。翻白草黄酮治疗后,糖尿病大鼠的TNF-α、IL-6水平降低,表明翻白草黄酮可降低糖尿病大鼠体内的炎症水平,从而保护胰岛β细胞。
综上所述,翻白草黄酮具有保护β细胞作用,促进β细胞修复,其保护作用可能是通过减轻胰腺组织内的氧化应激水平及降低全身炎症反应而实现的。今后将继续深入研究,明确翻白草黄酮促进β细胞修复的具体分子学机制。
参考文献
[1]Piro S,Rabuazzo AM,Renis M,et al. Effects of Metformin on oxidative stress,adenine nucleotides balance and glucose-induced insulin release impaired by chronic free fatty acids exposure in rat pancreatic islets[J].J Endocrinol Invest,2012,35(5):504-510.
[2]洪旭,陈海平,于恒池.老年2型糖尿病患者血清炎症因子水平及其与大血管病变的相关性[J].中国糖尿病杂志,2011,19(8):571-574.
[3]刘顺,单淇,周渭渭,等.翻白草糖尿病防治物质基础研究近况与展望[J].世界科学技术-中医药现代化,2010,12(2):165-171.
[4]曹兰秀,张振宇.翻白草对胰岛素抵抗大鼠的影响[J].辽宁中医药大学学报,2011,13(8):196-197.
[5]尹长江,杨坤宝,张学军,等.枸杞多糖对2型糖尿病大鼠的降糖作用研究[J].中成药,2014,36(8):1750-1753.
[6]Brownlee M. The pathobiology of diabetic complications:a unifying mechanism [J].Diabetes,2005,54(6):1615-1625.
[7]Rains JL,Jain SK. Oxidative stress,insulin signaling, and diabetes[J]. Free Radic Biol Med,2011,50(5):567-575.
[8]Kim MJ,Jung KH,Uhm YK,et al. Preservative effect of electrolyzed reduced water on pancreatic beta-cell mass in diabetic db/db mice[J].Biol Pharm Bull,2007,30(2):234-236.
[9]Arora P,Garcia-Bailo B,Dastani Z,et al.Genetic polymorphisms of innate immunity-related inflammatory pathways and their association with factors related to type 2 diabetes[J].BMC Med Genet,2011,12:95-99.
[10]崔思远,李芳.IL-6与2型糖尿病关系的研究进展[J].中国微生态杂志,2012,24(11):1051-1054.
[11]Bruun JM,Roeske-Nielsen A,Richelsen B,et al. Sulfatide increases adiponectin and decreases TNF-alpha,IL-6,and IL-8 in human adipose tissue in vitro[J]. Mol Cell Endocrinol,2007,263(1-2):142-148.
[12]Matthews VB,Allen TL,Risis S,et al. Interleukin-6-deficient mice develop hepatic inflammation and systemic insulin resistance[J].Diabetologia,2010,53(11):2431-2441.
(本文编辑: 董历华)
Flavonoids fromPotentilladiscolorBunge playing a protective and mechanical role for the type 2 diabetic rats islet cellXUShi-zhen,XIANGDong-yu,MENGFan-wei,etal.ShandongcollegeoftraditionalChinesemedicine,Yantai264199,China
【Abstract】ObjectiveThis article aims to study the protective mechanism of Flavonoids from Potentilla Discolor Bunge (PDB) to the type 2 Diabetic rats islet cell. MethodsUsing high fat-high sucrose diet to feed rats for 6 weeks, then the researchers copy the type 2 diabetic rats model with Streptozotocin(STZ). Model rats are randomly divided into the model group, the positive drug control group (rosiglitazone hydrochloride, 4 mg/kg), the low dose of flavone group (3 g/kg), and the high dose of flavone group (6 g/kg). At the same time, healthy rats are used as the experimental rats of normal group with 10 rats in each group. They are intervened by drug for 4 weeks. Then, trace blood sugar appearance tests fasting blood-glucose, radio immunity measures fasting insulin (FINS) and calculates insulin sensitivity index (ISI) and ELISA measures the level of tumor necrosis factor (TNF-α) and Interleukin-6(IL-6). Meanwhile, part of the pancreas tissue homogenate after xanthine oxidase method measures the level of SOD, and TBA measures the content of malondialdehyde (MDA). Take part of the pancreas pathological slices, and then observe the shape variation of the pancreas. ResultsFlavone from Potentilla Discolor Bunge(PDB) can reduce FBG, FINS, TNF alpha, and IL-6 levels and can improve insulin resistance. In addition, it is clear that it improves the level of SOD in the pancreatic tissue of rats and decreases MDA content. Pathological section shows an apparent reduction of the damage to islet cell, which is obvious in the high dose of flavonoids (6 g/kg). ConclusionFlavonoids from Potentilla Discolor Bunge (PDB) plays a protective role for type 2 Diabetic rats islet cell. In addition, the mechanism of its protective effect may through reducing the oxidative stress level in the pancreatic tissue and reducing the systemic inflammatory response.
【Key Words】Potentilla discolor;Flavonoids;Type 2 diabetes;Rat;Protective effect
(收稿日期:2015-08-12)
【中图分类号】R285.5
【文献标识码】A
doi:10.3969/j.issn.1674-1749.2016.02.005
作者简介:宿世震(1979- ),2015级在读硕士研究生,讲师。研究方向:动物模型及解剖学研究。E-mail:ssz169@126.com

