无乳链球菌Sip基因的克隆与原核表达
杨学云,王 蒴,吴建勇,王登峰,李建军(新疆畜牧科学院兽医研究所,新疆 乌鲁木齐 830000)
无乳链球菌Sip基因的克隆与原核表达
杨学云,王蒴,吴建勇,王登峰,李建军
(新疆畜牧科学院兽医研究所,新疆乌鲁木齐830000)
摘要:无乳链球菌表面免疫相关蛋白(Surface immunogenic proteins,Sip)具有高度保守性,是无乳链球菌疫苗研究的重要靶标。通过PCR技术扩增Sip基因,将其插入pET-22b载体构建重组质粒pET-22b-Sip,并对重组质粒进行双酶切、PCR鉴定及测序;转入BL21(DE3)中诱导表达,检测重组蛋白的大小及反应原性。结果表明,所扩增Sip基因大小为1 300bp,与GeneBank参考序列同源性为99.16%;蛋白分析表明,目的蛋白大小为50KDa,具有良好的反应原性,为无乳链球菌的免疫预防提供依据和基础。
关键词:无乳链球菌;表面蛋白;Sip基因;克隆与表达
10.16863/j.cnki.1003-6377.2016.01.009
无乳链球菌(Streptococcus agalactiae)是引起奶牛乳腺炎的主要传染性病原之一,对奶牛养殖及牛奶卫生安全具有重要的意义[1,2]。根据其荚膜多糖抗原性的不同,分为10种血清型,分别为Ⅰa,Ⅰb,Ⅱ,Ⅲ,Ⅳ, Ⅴ,Ⅵ,Ⅶ,Ⅷ,Ⅸ型[3]。但是各个血清型之间没有交叉保护力[4],这给无乳链球菌的免疫预防带来困难。筛选出各个血清型之间都具有保守性的候选抗原是免疫预防的关键。Sip蛋白是暴露于无乳链球菌表面的一种免疫相关蛋白,具有高度保守性,广泛存在于人源和牛源的多个血清型无乳链球菌株中,并与细菌的黏附和定植有关,因此是研究新型疫苗的良好的候选靶抗原[5,6,7]。本文通过基因工程技术,成功克隆了无乳链球菌Sip基因,并进行诱导表达、表达条件优化及蛋白反应原性的鉴定,为无乳链球菌的免疫预防提供依据及数据支持。
1 材料和方法
1.1菌株与载体
无乳链球菌KT639株分离自新疆奎屯奶牛场乳腺炎奶样中;E.coilDH5α感受态细胞购自北京鼎国昌盛生物技术有限责任公司;E.coilBL21(DE3)购自天根生化科技(北京)有限公司;原核表达载体pET-22b由实验室保存。
1.2试剂
DNA Marker D、D15000 DNA Marker、2XTaq PCR MasterMix、HRP标记的鼠抗兔IgG抗体、大量DNA产物纯化试剂盒、质粒小提取试剂盒均购自天根生物公司;氨苄青霉素、TMB、IPTG、LB液体培养基、LB固体培养基、SDS-PAGE凝胶配制试剂盒均购自上海生工生物工程有限公司;Bradford蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;蛋白分子量Marker(低)、BamHⅠ、HindⅢ、T4 DNA连接酶均购自Takara公司;预染Marker购自Fermentas公司;HRP标记的鼠抗兔IgG抗体购自Earthox公司;丙烯酰胺、双丙烯酰胺购自Pharmacia公司;TEMED购自Fluka公司;SDS、考马斯亮蓝R-250,甘氨酸等均为国产分析纯。
1.3引物
根据GenBank发表的无乳链球菌Sip基因序列(AF151361.1),设计一对引物,核苷酸序列为:
P1:5'-CCCGGATCCTAAAATGAATAAAAAGGTACTATTG-3';
P2:5'-CCCAAGCTTTTTGTTAAATGATACGTGAAC-3';
引物由生工生物工程(上海)有限公司合成。
1.4无乳链球菌基因组DNA的制备
将无乳链球菌分离株KT639接种于TSB液体培养基中,37℃摇床中振荡培养24 h。次日取菌液1.5 mL,用细菌基因组DNA提取试剂盒提取细菌DNA。
1.5无乳链球菌Sip基因的PCR扩增
50μL PCR反应体系:PCR Master Mix 25 μL,上下游引物(20 μmoL/L)各0.5 μL,基因组DNA 2 μL,ddH2O 22 μL。反应条件:①94℃预变性5 min,②94℃变性1 min,③59℃退火45 s,④72℃延伸1 min,②~④循环30次,然后72℃终末延伸10 min。用1.0%琼脂糖凝胶对PCR产物进行电泳检测[8]。
1.6表达载体的构建
用Amp抗性的LB培养基对含pET-22b质粒的菌种进行培养,37℃、170 r/min振荡培养(12~16)h,然后取培养液用质粒提取试剂盒提取质粒。用BamHⅠ和HindⅢ分别对Sip基因片段和pET-22b质粒进行双酶切,然后用DNA回收试剂盒对双酶切产物进行回收。将Sip基因与pET-22b载体进行连接,然后转化到E.coil BL21(DE3)感受态细胞,对重组质粒用BamHⅠ和HindⅢ进行双酶切和PCR鉴定,将阳性重组质粒pET-22b-Sip交由上海生工测序公司进行测序。
1.7重组菌的诱导表达
将重组质粒pET-22b-sip/BL21(DE3)及空载体pET-22b/BL21(DE3)菌液接种于5 mL含Amp抗性的LB液体培养基中,37℃振荡培养,当OD600达到0.6~0.8时加入IPTG至菌液终浓度为1.0mmoL/L,37℃诱导表达4 h,SDS-PAGE分析表达产物。
1.8重组菌最佳表达条件
将重组菌接种于含有氨苄青霉素(50 μg/mL)的LB培养基中,37℃振荡培养至OD600为0.6时,加入IPTG至终浓度为1.0 mmoL/L,分别诱导1 h、2 h、3 h、4 h、5 h;加入IPTG至终浓度为1.0 mmoL/L,分别在25℃、30℃、37℃下培养至最佳诱导时间;分别加入IPTG至终浓度为0.25 mmoL/L、0.5 mmoL/L、0.75 mmoL/L、1.0 mmoL/L、1.25 mmoL/L、1.5 mmoL/L、2.0 mmoL/L、2.5 mmoL/L、3.0 mmoL/L,在最佳诱导温度下,振荡培养至最佳诱导时间。通过对诱导的产物进行蛋白电泳分析,从而确定重组菌最佳的诱导表达条件。
1.9表达蛋白的免疫印迹鉴定
将表达产物转移至硝酸纤维膜并进行western blotting检测,兔抗无乳链球菌免疫血清为一抗,HRP标记的鼠抗兔IgG抗体为二抗,用TMB进行染色。
2 结果
2.1无乳链球菌Sip基因扩增结果
以无乳链球菌分离株KT639的DNA为模板,用PCR方法成功扩增出1300 bp的目的条带,与预期片段大小相符(图1)。
2.2重组质粒的鉴定
对重组质粒pET-22b-Sip分别进行PCR鉴定和BamHⅠ和HindⅢ的双酶切鉴定。结果显示,扩增出的片段大小约为1 300 bp,与目的片段大小相近;经BamHⅠ和HindⅢ双酶切得到的两条特异性片段,其中一条大分子量片段与pET-22b位置相同,约在5 500 bp左右;另一条片段分子量约为1 300 bp,与目的基因Sip大小一致(图2),表明重组表达载体构建成功。测序结果表明,测序所得的1305个碱基中有11个碱基发生变化,核苷酸序列同源性为99.16%;有4个氨基酸发生变化,氨基酸序列同源性达到99.08%。
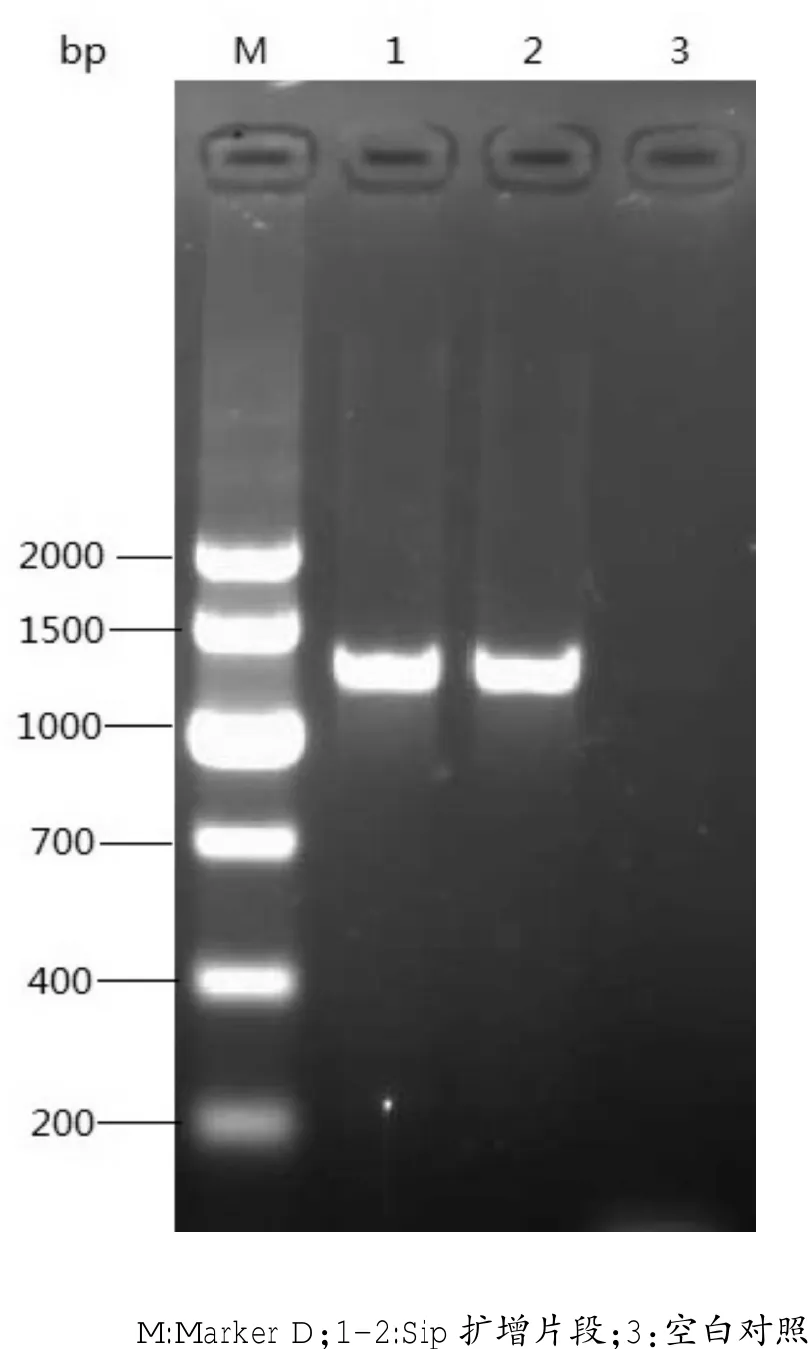
图1 无乳链球菌Sip基因PCR扩增结果
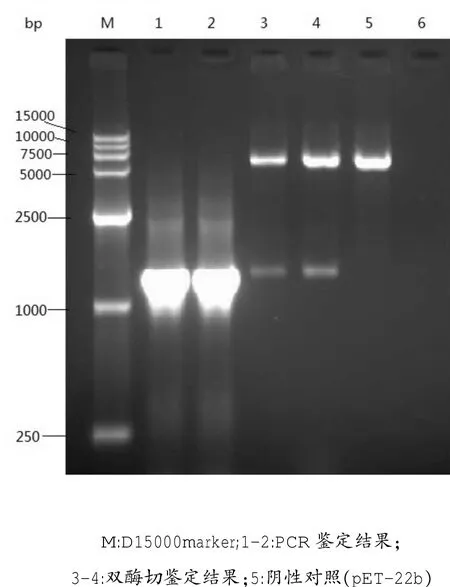
图2 重组质粒pET-22b-Sip的PCR及双酶切鉴定
2.3重组菌的诱导表达
经SDS蛋白电泳分析,在50 KDa附近出现重组目的蛋白条带;Sip重组蛋白一部分以可溶形式表达,一部分以包涵体形式表达(图3),经Bandcan软件分析,可溶性蛋白占菌体总蛋白的37.6%。
2.4重组菌最佳表达条件
2.4.1不同诱导时间优化
对诱导1 h、2 h、3 h、4 h、5 h后的表达产物分别进行SDS-PAGE分析。结果显示,诱导时间为3 h时蛋白表达量最高(图4),确定诱导最佳时间为3 h。
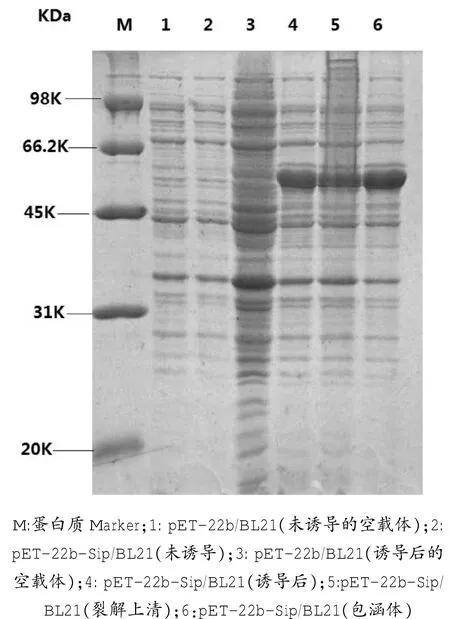
图3 表达产物的蛋白电泳分析
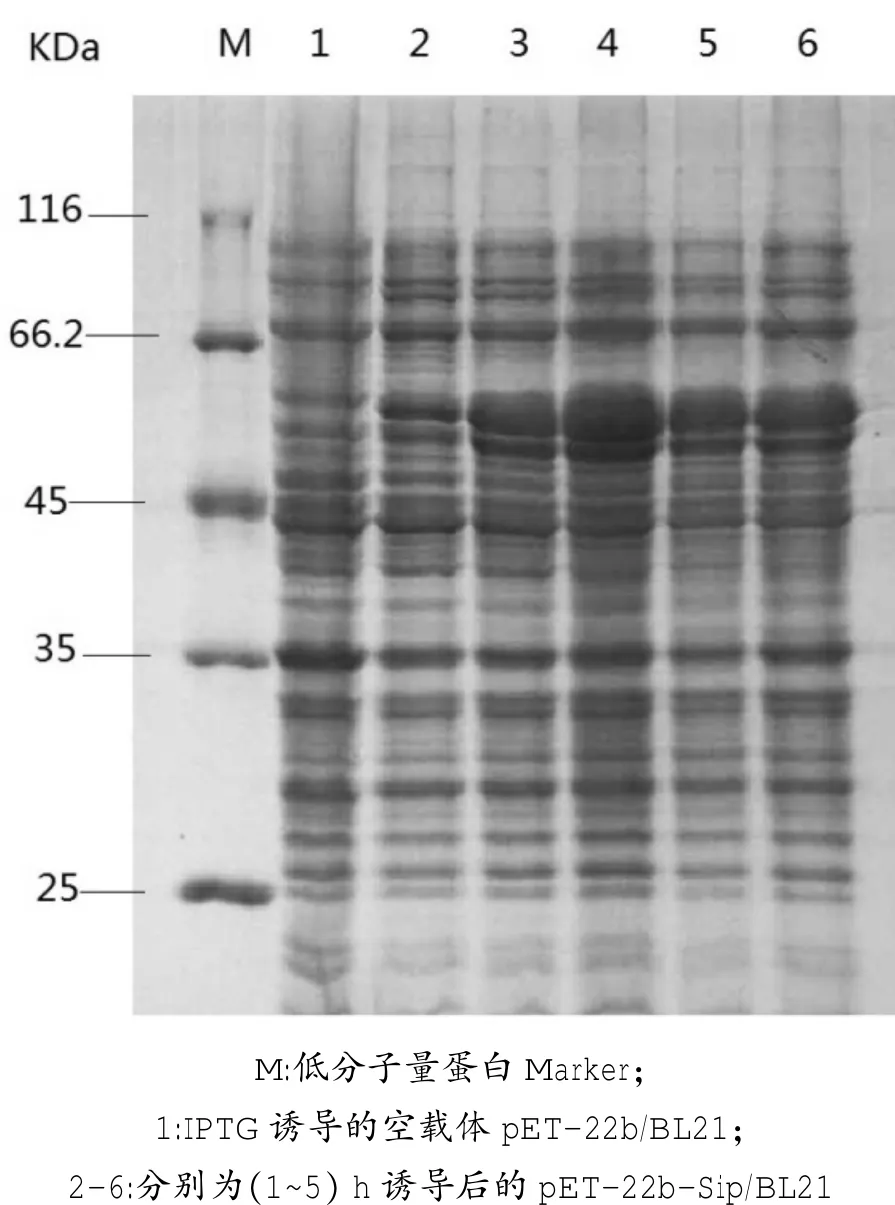
图4 不同诱导时间对目的蛋白表达量的影响
2.4.2不同诱导温度优化
在25℃、30℃、37℃条件下诱导表达3 h,分别进行蛋白电泳分析。结果显示,当诱导温度为25℃时,蛋白的表达量相对最高(图5),因此确定最佳诱导温度为25℃。
2.4.3不同IPTG浓度优化
经Bandcan软件检测后,IPTG浓度在1.25 mmoL/L时表达量相对较高(图6),因此将1.25 mmoL/L作为IPTG的最佳浓度。
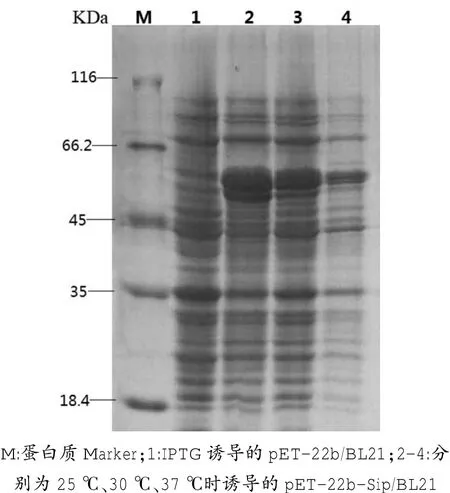
图5 不同诱导温度下蛋白的表达量
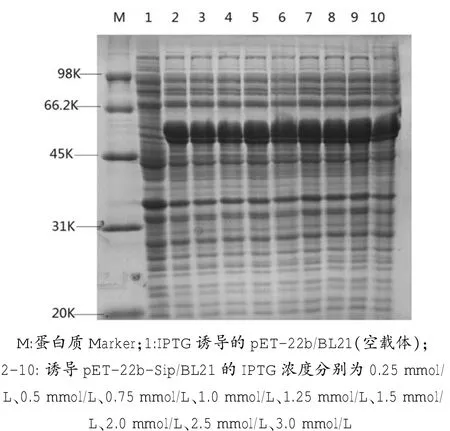
图6 不同浓度的IPTG对目的蛋白表达量的影响
2.5重组表达蛋白的免疫印迹鉴定
对Sip重组表达蛋白进行免疫印迹分析,约在50KDa处出现一条明显的条带(图7),重组表达的Sip蛋白可与无乳链球菌免疫血清发生特异性反应,说明Sip蛋白具有较好的反应原性。
3 讨 论
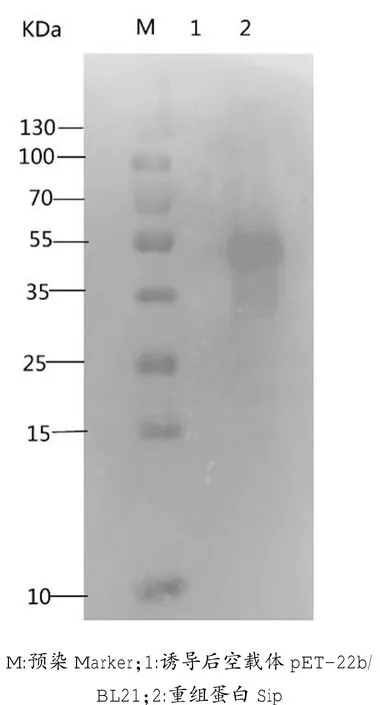
图7 重组蛋白的免疫印迹分析
目前研究证实,包括无乳链球菌在内的链球菌属全菌体灭活苗对奶牛的保护力较弱,而研究较多的荚膜多糖疫苗、结合疫苗也缺乏广泛保护力,免疫保护效果都不理想[9,10]。这可能由于(1)该菌缺乏抗原生态学特异性;(2)灭活后抗原活性降低或消失;(3)无乳链球菌本身抗原结构较复杂,已确定的10种血清型之间缺乏交叉保护力。通常情况下,无乳链球菌的毒力因子和抗原因子在同一个靶标组分上,而靶标蛋白只有在细菌细胞保持完整活状态下才能发挥其毒力作用,而其抗原性在亚单位状态下仍会存在。因此,将亚单位有效靶标蛋白作为重点研究对象,已成为该领域研究的热点。
Sip基因存在于无乳链球菌的多个血清型中,且具有高度保守性和良好的免疫原性[11]。已有研究者对无乳链球菌sip全基因组进行克隆并测定其核苷酸序列发现,sip基因由1305个核苷酸组成,是一个开放的阅读框,编码434个氨基酸,分子量为45.5KDa,存在1个由25个氨基酸组成的信号肽。本研究依据GenBank中已发表的sip基因序列(AF151361.1)及表达载体pET-22b的多克隆位点,在sip片段的上下游设计引物,于P1引物上游添加BamHⅠ酶切位点,P2引物上游添加HindⅢ酶切位点,并在每个酶切位点前添加三个保护性碱基以增强其特异性。本研究克隆的无乳链球菌分离株KT369的Sip基因与GenBank公布的Sip基因(AF151361.1)比对显示,核苷酸及氨基酸同源性均在99%以上,与Brodeur报道[5]的无乳链球菌不同分离株间核苷酸同源性在98%以上相一致,说明无乳链球菌新疆分离株sip基因与GenBank登录的sip基因序列差异极小,具有共同的进化来源。
由于pET-22b是高效表达载体,表达的重组蛋白通常以包涵体形式存在,而包涵体不具有天然构象,没有生物活性,并且需要变性、复性等处理,操作复杂并且耗时。本实验通过对重组蛋白进行可溶性分析发现,表达的sip重组蛋白一部分以可溶性形式存在,为了提高可溶性蛋白的表达水平,对诱导温度、时间及IPTG浓度进行了适当优化,最终获得了较高表达的可溶性蛋白。通过对重组表达的蛋白进行了Western blotting鉴定分析,结果表明Sip蛋白具有良好的反应原性,为进一步开展基因工程亚单位疫苗的研制提供了数据支持和依据。
参考文献:
[1]李建军,杨学云,王治才,等.新疆集约化奶牛场隐性乳房炎流行病学和病原学研究[J].新疆农业科学. 2008(02):369-373.
[2] Broadbent J R,Chou Y C, Gillies K, et al. Nisin inhibits several gram -positive,mastitis-causingpathogens[J].Journal of dairy science.1989,72(12):3342-3345.
[3]Slotved H C,Kong F,Lambertsen L,et al.Serotype IX,a Proposed New Streptococcus agalactiae Serotype [J].JClin Microbiol.2007,45(9):2929-2936.
[4]Kogan G,Uhrin D,Brisson JR,et al.Structural and immunochemical characterization of the type VIII group B Streptococcus capsular polysaccharide[J].JBiol Chem.1996,271(15):8786-8790.
[5]Brodeur B R,Boyer M,Charlebois I,et al.Identification of group B streptococcal Sip protein,which elicits cross-protective immunity[J].Infect Immun.2000,68(10):5610-5618.
[6]Maione D,Margarit I,Rinaudo C D,et al.Identification of a universal Group B streptococcus vaccine by multiple genome screen[J].Science.2005,309(5731):148-150.
[7]Martin D,Rioux S,Gagnon E,et al.Protection from group B streptococcal infection in neonatalmice by maternal immunization with recombinant Sip protein[J].Infect Immun.2002,70(9):4897-4901.
[8]吴建勇,王登峰,杨学云,等.铜绿假单胞菌外毒素A基因的克隆与原核表达[J].草食家畜,2013(2):58-62.
[9]Lachenauer C S,Kasper D L,Shimada J,et al.Serotypes VIand VIIIpredominate among group B streptococci isolated from pregnant Japanese women[J].Journal of Infectious Diseases.1999,179(4):1030-1033.
[10]Baker C J,Paoletti L C,Rench M A,et al.Use of Capsular Polysaccharide—Tetanus Toxoid Conjugate Vaccine for Type IIGroup B Streptococcus in Healthy Women[J].Journal of Infectious Diseases.2000, 182(4):1129-1138.
[11]Lindahl G,Stalhammar-Carlemalm M,Areschoug T.Surface proteins of Streptococcus agalactiae and related proteins in other bacterial pathogens[J].Clin Microbiol Rev.2005,18(1):102-127.
Cloning and Prokaryotic Expression of Streptococcus Agalactiae Sip Gene
YANG Xue-yun,WANG Shuo,WU Jian-yong,WANG Deng-feng,LIJian-jun
(Institute of Veterinary Medicine,Xinjiang Academy of Animal Science,Urumqi830000,China)
Abstract:Streptococcus Agalactiae surface immunogenic protein (Sip)is a highly conservative important target for the study of Streptococcus Agalactiae vaccine.The Sip gene was amplified by PCR and be inserted into vector pET-22b from a recombinant vector pET-22b-Sip.After identified by PCR,restriction enzyme digestion and sequencing methods,the recombinant plasmid was transformed into BL21 (DE3)and induced to express by IPTG.The size and reactionogenicity of recombinant protein was detected.The results showed that the sip gene was 1300bp and was 99.16% in homology with reference sequence of GeneBank. The recombinant protein was found to be about 50KDa as expected and showed good reactionogenicity.This research provided the basis and foundation for the immunization against Streptococcus Agalactiae.
Key words:streptococcus agalactiae;surface protein;sip gene;cloning and expression
收稿日期:2015-12-15修回日期:2015-12-24
作者简介:杨学云(1978-),男,副研究员,从事牛羊疫病防治研究。E-mail:yangxyxj@163.com
基金项目:新疆自治区自然科学基金项目(2013211B29)
中图分类号:S917
文献标识码:A
文章编号:1003-6377(2016)01-0036-06

