氨基酸功能化的果胶/姜黄素胶体粒子的合成与性质
杨泽川,李 帆,黄庆荣,张 国,石彤非
( 1.吉林大学材料科学与工程学院,长春130012;2.中国科学院长春应用化学研究所,高分子物理与化学国家重点实验室,长春130022; 3.Department of Food Science,Rutgers University,New Jersey 08901,USA)
氨基酸功能化的果胶/姜黄素胶体粒子的合成与性质
杨泽川1,2,李帆2,黄庆荣3,张国1,石彤非2
( 1.吉林大学材料科学与工程学院,长春130012;
2.中国科学院长春应用化学研究所,高分子物理与化学国家重点实验室,长春130022; 3.Department of Food Science,Rutgers University,New Jersey 08901,USA)
摘要通过酯化反应合成了新型的氨基酸功能化的果胶衍生物,通过红外光谱( FTIR)和元素分析确认了果胶衍生物的化学组成及结构,用动态光散射( DLS)和透射电子显微镜( TEM)表征了果胶衍生物胶体的形貌和尺寸.结果表明,果胶衍生物胶体呈现不规则的球状结构,粒度分布较均一,平均粒径200 nm.用紫外-可见( UV-Vis)光谱测试了果胶衍生物胶体对姜黄素的包裹和控制释放,结果表明,姜黄素能够有效被果胶衍生物胶束包裹.体外细胞毒理实验结果表明,果胶衍生物胶体载体能显著提高姜黄素对HepG2细胞生长的抑制作用.
关键词pH响应;胶体粒子;药物输运;肿瘤抑制;氨基酸功能化;果胶衍生物;姜黄素
维生素[1]、益生菌[2]和生物活性肽[3]等食源性功能因子有助于身体健康及疾病治疗.姜黄素是从姜科植物姜黄根茎中提取的一种植物多酚,具有抗肿瘤、抗炎症、抗菌、抗人体免疫缺陷病毒( HIV)及降血脂等药理活性[4~7].姜黄素在水中的溶解性较差,生物利用率低,理化及生物稳定性差(如易被氧化、光降解、在碱性pH下不稳定以及易被酶降解),很难应用于临床[8].借助合成的纳米载体[9,10]对姜黄素进行包裹可提升姜黄素的溶解性及稳定性,通过偶联生物活性小分子可实现载体的靶向输运,提高了姜黄素的生物利用率.目前已报道的纳米载体多数是人工合成的两亲性聚合物,具有环境响应性的食源性纳米载体尚少报道.
果胶是一种源自水果和蔬菜的具有生物活性的天然多糖[11],由于其具有无毒、生物可降解、来源广泛及成本低等优点,作为微球、微胶囊的重要组成部分,广泛应用于缓控释制剂及药物输运体系中[12~14].果胶在水溶液中以高度溶胀的水凝胶形式存在,在生理环境下果胶的控释效果通常不理想.因此,可设想通过适当的功能化修饰来获得果胶的环境响应性质,并使得果胶能够在水溶液中形成纳米尺度的胶体用于包裹天然的活性因子.
本文通过简单的酯化反应,将pH响应型的氨基酸衍生物Boc-组氨酸修饰到天然果胶分子上,制得pH响应型果胶衍生物,这种新型的果胶衍生物能够在水溶液中形成纳米尺度的胶体粒子,并将姜黄素负载到果胶衍生物上,制得了果胶衍生物-姜黄素纳米胶体粒子.通过紫外-可见( UV-Vis)光谱、动态光散射( DLS)和透射电子显微镜( TEM)等表征了果胶衍生物胶体粒子的理化性质,探索了果胶衍生物-姜黄素胶体粒子的形貌结构、载药率和不同pH环境下的体外药物释放特性,对载有姜黄素的果胶衍生物纳米粒子在HepG2细胞中的摄取及细胞毒性进行了初步评价.
1 实验部分
1.1试剂与仪器
果胶(源自橘皮)、无水甲酰胺、Boc-组氨酸( Boc-histidine)、无水二甲基亚砜( DMSO)、无水二甲基甲酰胺( DMF)、1,1'-羰基二咪唑( CDI)、4-吡咯烷基吡啶( PYP)、姜黄素、Dulbecco’s modified eagle medium( DMEM)培养基和Cell Counting Kit-8( CCK-8)试剂和胎牛血清( FBS),Sigma-Aldrich公司; 2,2'-联吡啶和N-甲基吡咯烷酮( NMP),分析纯,国药化学试剂集团;异丙醇、二氯甲烷和丙酮,分析纯,北京化工厂;再生纤维素透析膜(截留分子量为3500和5000),进口分装.
Bruker AV400型400 MHz核磁共振谱( NMR)仪,DMSO-d6为溶剂;美国Nicolet公司Nicolet Nexus 470傅里叶红外光谱( FTIR)仪,无水KBr压片;德国Elementar公司VarioEL元素分析( EA)仪;日本JEOL的JEM-2010型透射电子显微镜( TEM) ;北京普析通用公司TU-1901型紫外-可见( UV-Vis)分光光度计; ALV 5000型激光光散射仪,德国ALV/Laser vertriebsgesellschaft m.b.H公司.
1.2 Boc-组氨酸-果胶( His-Pectin)胶体粒子的合成
合成路线如Scheme 1所示.将0. 744 g( 3. 9 mmol)果胶加入到15 mL无水DMSO中溶解12 h得到果胶溶液;将1. 0 g( 3. 9 mmol) Boc-组氨酸溶于5 mL DMSO和5 mL DMF的混合溶剂中反复“冷冻-抽真空-解冻”3次后加入0. 572 g( 3. 5 mmol) CDI,于30℃搅拌反应3 h,活化Boc-组氨酸,加入果胶溶液,加入PYP( 0. 052 g,0. 35 mmol),在室温条件下避光反应24 h后终止反应,用二氯甲烷与异丙醇(体积比为2∶1)沉淀,沉淀物真空干燥后重新溶于20 mL去离子水中,在超纯水中透析24 h(透析膜的截留分子量为5000),除去未反应的小分子杂质后冻干,得到His-Pectin胶体粒子1. 21 g,产率为70%.其中,Boc-组氨酸与果胶分子上糖单元的摩尔比M( Boc-组氨酸)∶M(果胶糖单元) = 1∶1.将Boc-组氨酸的用量改为0. 5 g( 1. 95 mmol),重复上述实验,得到的His-Pectin胶体粒子标记为His0. 5-Pectin,作为对照.
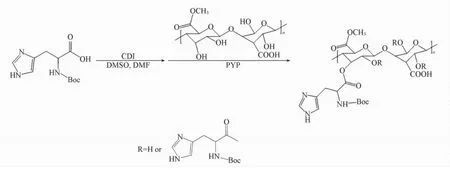
Scheme 1 Synthetic routes of His-Pectin colloidal particles
1.3 His-Pectin胶体粒子对姜黄素溶解度的影响
取3支5 mL离心管( a~c),分别加入2 mL去离子水,在a离心管中加入1 mg His-Pectin胶体粒子,在b离心管中加入1 mg姜黄素,在c离心管中加入1 mg His-Pectin胶体粒子及1 mg姜黄素,振荡1 h后静置10 min,然后检测样品的吸光度.
1.4姜黄素载药胶束的制备及表征
将姜黄素溶于丙酮(浓度为20 mg/mL)中,His-Pectin溶于去离子水(浓度为10 mg/mL)中,在冰水浴及高速搅拌下,将姜黄素溶液缓慢滴加至His-Pectin溶液中,使姜黄素与His-Pectin的质量比分别为1∶20,1∶10,1∶5,搅拌1 h使姜黄素充分包裹到样品胶束中,然后在4~8℃的去离子水中透析24 h(每6 h换一次水,透析袋的截留分子量为3500).透析结束后,在3000 r/min条件下(离心力为860g)离心10 min,冻干保存.
用透射电子显微镜( TEM)观察纳米胶束的形貌;采用激光粒度仪测定载药胶束和空白胶束的粒径及粒径分布.
1.5姜黄素/His-Pectin胶体粒子的体外释放
配制4 μg/mL的姜黄素甲酰胺溶液和1 mg/mL的His-Pectin甲酰胺溶液,用紫外-可见分光光度计扫描,确定最佳吸收波长.配制浓度分别为10~50 μg/mL的姜黄素溶液,紫外测定吸收值(波长425 nm),以浓度为横坐标,吸收值为纵坐标绘制标准曲线.
称取一定量的姜黄素/His-Pectin胶体粒子,测定其在425 nm处的吸光度值,对照姜黄素标准曲线,计算姜黄素/His-Pectin胶体粒子的包埋率( LE)和载药率( LC) :
LE=( mCurcumin/mp)×100%,LC=( mCurcumin/md)×100%
式中: mCurcumin为胶体粒子中姜黄素的质量,mp为投药的质量,md为二者的总质量.
将1. 0 mL包裹姜黄素的His-Pectin溶液加入透析袋中,分别置于20 mL不同pH( 7. 4,5. 6,4. 0)值的磷酸盐缓冲溶液( PBS,0. 1 mol/L)中,于37℃恒温振荡( 100 r/min),间隔一定时间取样1 mL,并补充l mL新鲜PBS溶液.由紫外-可见分光光度计检测每个时间点的释放介质的吸光度,并根据标准曲线计算姜黄素的累积释放百分比,每组3个平行样,取平均值.
1.6 His-Pectin胶体粒子的体外细胞毒理实验
取对数生长期的HepG2细胞,用胰酶消化,终止后离心收集,制成细胞悬液,调整细胞浓度,接种于96板上,l00 μL/孔,每孔细胞数约为1. 8×104个.置于37℃,5%(体积分数) CO2培养箱中孵育24 h后,于倒置显微镜下观察,可见细胞贴壁生长.每组分别加入不同浓度的His-Pectin胶体粒子溶液,在37℃,5% CO2,饱和湿度条件下继续孵育培养24 h;每孔加入10 μL CCK-8试剂,放置2 h后,测定96孔板在450 nm波长的吸光度值(由PERLON GDNM-9602型酶标仪测定).
1.7体外肿瘤细胞活性实验
姜黄素、His-Pectin胶体粒子及姜黄素/His-Pectin胶体粒子对肿瘤细胞的毒性测试由CCK-8试剂在HepG2细胞系中进行.HepG2细胞的培养条件如下:培养液用含有10%(体积分数)的胎牛血清( FBS)的DMEM培养,在5%CO2和95%相对湿度下进行.HepG2细胞以约10000 Cell/孔的密度接种在96孔板中,在100 μL的培养质中生长24 h,移除多孔板中的培养介质,分别加入含有不同浓度姜黄素及载有姜黄素/His-Pectin胶体粒子的DMEM培养液,继续培养24 h;培养板每孔加入10 μL CCK-8溶液,放置2 h后,测试96孔板在450 nm波长的吸光度值.细胞的存活率( Cell viability)由下式计算:
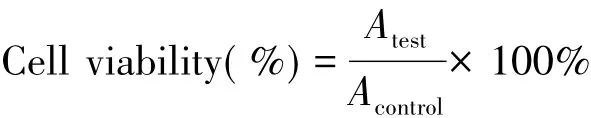
式中: Atest代表姜黄素、His-Pectin胶体粒子以及载有姜黄素/His-Pectin胶体粒子在450 nm处的吸光度数值,Acontrol代表空白孔在450 nm处的吸光度数值,取4组实验的平均值.上述细胞毒性测试中所使用溶液与试剂均通过孔径为0. 22 μm的过滤头(美国PALL公司)进行灭菌处理.
2 结果与讨论
2.1载体His-Pectin的合成与表征
以天然果胶为骨架,以低毒的DMSO和甲酰胺为溶剂,采用简单的酯化反应将氨基酸接枝到果胶骨架上,形成了一种两亲性的果胶衍生物His-Pectin.以1,1'-羰基二咪唑( CDI)为酯化反应试剂是由于CDI及其反应副产物无毒,反应中所产生的咪唑和二氧化碳能够很容易从产物中分离出去,此外,采用CDI试剂能够避免DMSO作为反应溶液时经常会发生的氧化、降解及其它副反应,如Moffatt反应等[15],其合成过程如Scheme 1所示.
图1给出未修饰的果胶分子( a)和His-Pectin胶体粒子( b)的红外光谱.3419 cm-1处为His-Pectin胶体粒子上的—OH与杂环上—NH的共同吸收峰;在1750 cm-1处,果胶分子和His-Pectin胶体粒子均出现了归属于酯基的CO伸缩振动峰,并且His-Pectin胶体粒子的吸收峰明显增强,表明除了果胶分子骨架上原有的酯基外,Boc-组氨酸通过酯化反应接枝到果胶骨架上,形成了新的酯键,使CO基团的吸收峰增强;在图1谱线b中,在1510 cm-1处出现归属于Boc-组氨酸的—NH吸收峰,在1253 cm-1处出现酰胺吸收峰,进一步证实了His-Pectin中存在Boc-组氨酸基团.
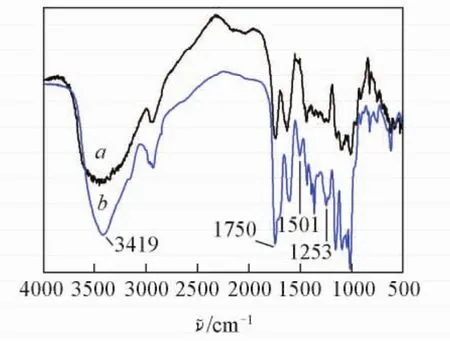
Fig.1 FTIR spectra of Pectin( a) and
通过元素分析测定样品的取代度( DS),通过样品中的含氮量计算出样品中组氨酸的含量,进而得出取代度.结果列于表1.

Table 1 Characterization of Pectin and His-Pectin byH eliesm-Peencttainl( a bn)alyses
2.2浊度测试
从图2可以看出,当pH在3~10之间时,果胶为透明的水凝胶状,其浊度不随pH值变化而变化,而His-Pectin表现出典型的两性弱聚电解质性质.His-Pectin胶体粒子上既存在果胶分子的半乳糖醛酸基团,又含有Boc-组氨酸的咪唑基团.一方面,His-Pectin胶体粒子所含的半乳糖醛酸pKa值约为3. 5[16].pH值高于3. 5时,His-Pectin胶体粒子上的半乳糖醛酸脱去质子,使His-Pectin分子带负电荷;另一方面,His-Pectin胶体粒子所含的Boc-组氨酸pKa约为7,在酸性条件下,所含的咪唑基团吸收质子,使His-Pectin分子带正电.Zeta电位结果显示,His-Pectin的等电点约为4.由图2可见,pH在3~5之间时,浊度明显升高,水凝胶呈不透明状,等电点处pH=4出现浊度极大值,这主要归因于His-Pectin的咪唑基团和羧基之间的静电吸引力.在等电区间以外,随着咪唑基的质子化和羧基的去离子化程度增高,His-Pectin在水溶液中的溶解性增大,呈现出浊度降低.
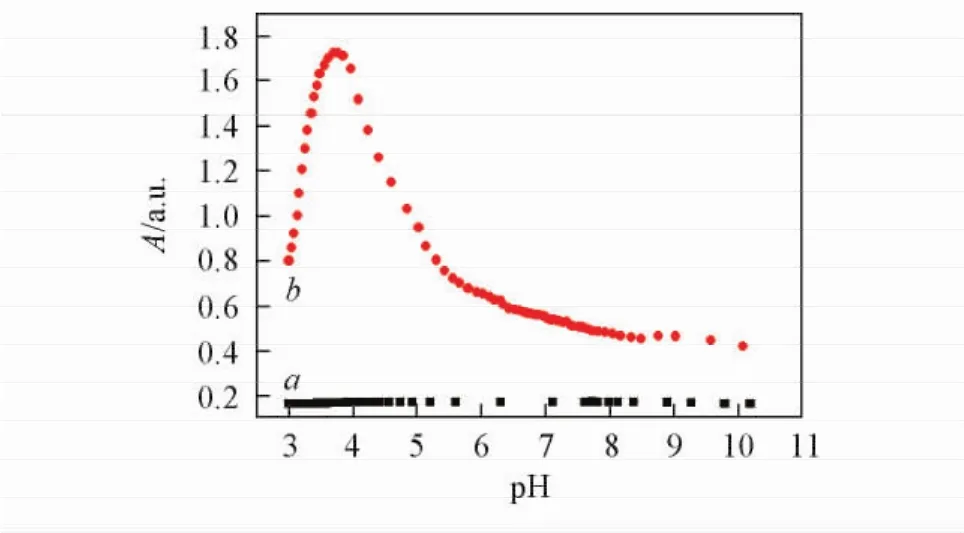
Fig.2 Effect of pH on the solubility of Pectin( a) and His-Pectin colloidal particles ( b ) in water( 3 mg/mL)
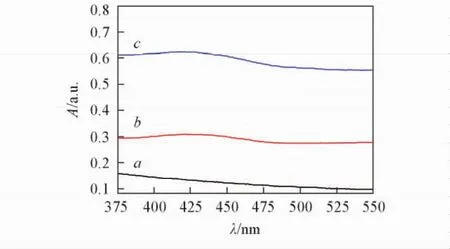
Fig.3 UV-Vis spectra of His-Pectin( a),Curcumin ( b ) and mixture of His-Pectin and Curcumin( c)
2.3 His-Pectin胶体粒子对姜黄素溶解度的影响
图3谱线a为His-Pectin胶体粒子的紫外-可见光谱,在425 nm处未出现特征峰;图3谱线b为姜黄素的紫外-可见光谱,在425 nm处出现1个很小的吸收峰;图3谱线c为His-Pectin胶体粒子与姜黄素通过简单共混所得混合溶液的紫外-可见光谱,425 nm处的吸收峰值约为0. 62,远大于姜黄素,说明姜黄素的溶解性明显增加,进而证实了His-Pectin胶体粒子可以提高姜黄素的溶解度.
2.4 His-Pectin胶体粒子及姜黄素/His-Pectin胶体粒子的形貌与尺寸
由图4可以看出,His-Pectin胶束呈近似于球状形貌,粒径约为100 nm.包裹姜黄素的His-Pectin胶体粒子同样具有球状形貌.当m( Curcumin)∶m( His-Pectin)为1∶20时,包裹药物的粒子尺寸约为80 nm,随着姜黄素含量的增加,包裹药物的粒子尺寸逐渐增大,当m( Curcumin)∶m( His-Pectin)为1∶5时,粒子尺寸达到200 nm左右.

Fig.4 TEM images of His-Pectin( A) and Curcumin/His-Pectin colloidal particles( B—D)m( Curcumin)∶m( His-Pectin) : ( B) 1∶20; ( C) 1∶10; ( D) 1∶5.
DLS结果表明(表2),在37℃条件下,His0. 5-Pectin胶体粒子的尺寸为285 nm,包裹药物后,当m( Curcumin)∶m( His0. 5-Pectin)为1∶20时,姜黄素/His0. 5-Pectin胶体粒子尺寸减小到218 nm; His-Pectin胶体粒子的尺寸为131 nm,当m( Curcumin)∶m( His-Pectin)为1∶20时,姜黄素/His-Pectin胶体粒子尺寸减小到115 nm.包裹姜黄素的His-Pectin胶体粒子尺寸偏小,这可能是由于包裹药物后,姜黄素的疏水作用使胶体粒子变得更紧密[17].随着姜黄素含量的增大,姜黄素/His-Pectin胶体粒子的尺寸也逐渐增大,当m( Curcumin)∶m( His-Pectin)为1∶5时,姜黄素/His-Pectin胶体粒子的尺寸达到233 nm.以上结果表明,His-Pectin是一个包裹姜黄素的良好载体,而且包裹药物后载药胶体粒子的尺寸也比较小,在生物医用领域有很广泛的潜在应用价值.

Table 2 Characterization of the size and distribution of the colloidal particles at 37℃( n=3)
2.5姜黄素/His-Pectin载药胶束的包埋率和载药率
采用紫外-可见分光光度法测定组氨酸含量不同的His0. 5-Pectin与His-Pectin载药胶体粒子中姜黄素的含量,并计算姜黄素的包埋率与载药率.姜黄素浓度( X)与吸光度值( Y)呈良好的线性关系,线性方程为Y=-0. 05501+0. 12349X,R = 0. 9965.将姜黄素/His-Pectin载药胶束分散于甲酰胺溶液中,高速搅拌破坏胶体粒子以确保胶体粒子中包载的姜黄素完全释放出来,通过线性方程计算姜黄素/ His-Pectin载药胶体粒子的包埋率和载药率,结果列于表3.由表3所可见,随着组氨酸修饰度的增加,His-Pectin的载药率和包埋率明显增加,这归功于组氨酸能够增强果胶衍生物的疏水性,从而有利于疏水药物的包裹.而随着姜黄素含量的增加,His-Pectin胶体粒子的包埋率明显下降,载药率明显提高,这是由于制备过程中,过量的姜黄素使载体对药物的承载能力达到了一定程度的饱和,多余的姜黄素在水溶液中形成沉淀,从而使姜黄素包埋率有所下降.

Table 3 LE and LC of Curcumin/His-Pectin colloidal particles
用透析的方法研究了37℃时,在不同pH值环境下,姜黄素/His-Pectin[m ( Curcumin)∶m( His-Pectin) = 1∶20]胶体粒子中姜黄素的扩散释放行为.图5给出姜黄素体外释放的动力学曲线.从图5可以看出,当pH=7. 4时,在最初5 h内,药物释放曲线基本呈线性,His-Pectin在10 h之内将姜黄素基本释放完毕.随着pH值的降低,控释的释放速率明显减慢,将pH值调整为4后,药物的释放程度进一步减小,这可能由于此时His-Pectin的溶解性较差,由于His-Pectin和疏水的姜黄素之间存在疏水缔合作用,使姜黄素由载体向水溶液中的扩散变慢.
2.6 His-Pectin胶体粒子的细胞毒性
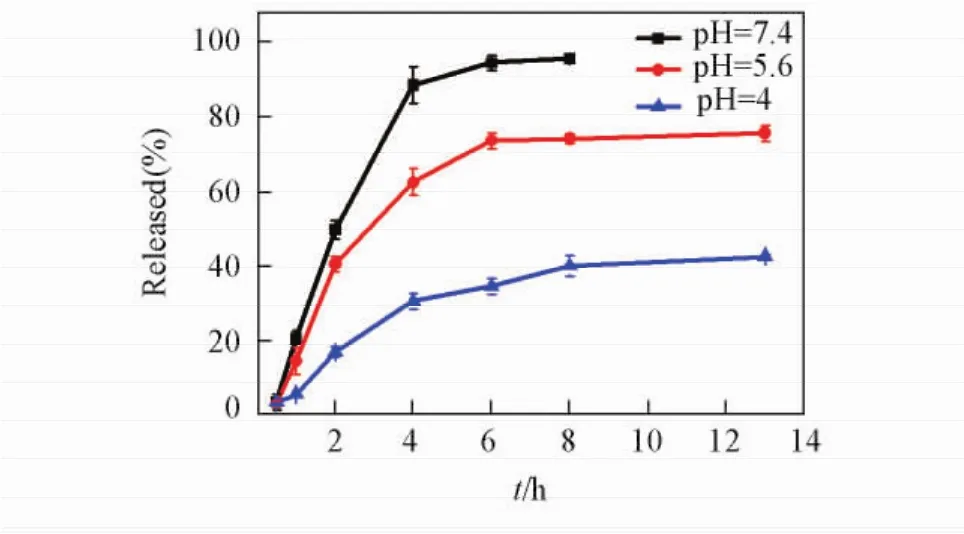
Fig.5 The in vitro Curcumin release profiles for Curcumin/His-Pectin[m ( Curcumin)∶m( His-Pectin) = 1∶20]colloidal particles with different pH value
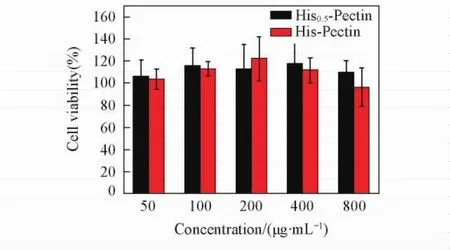
Fig.6 Cytotoxicity of His-Pectin colloidal particles in HepG2 cellsMean±standard derivation( n=4).
His-Pectin胶体粒子由果胶和组氨酸衍生物构成,HepG2细胞在与不同浓度的His-Pectin胶体粒子共孵育24 h后,HepG2细胞存活率如图6所示.可见,在50 μg/mL浓度下,经His-Pectin处理的细胞存活率基本超过了100%,将His-Pectin的浓度增大到800 μg/mL未见细胞毒性明显增加,细胞的存活率仍然大于94%.以上数据说明,His-Pectin具有很低的细胞毒性.
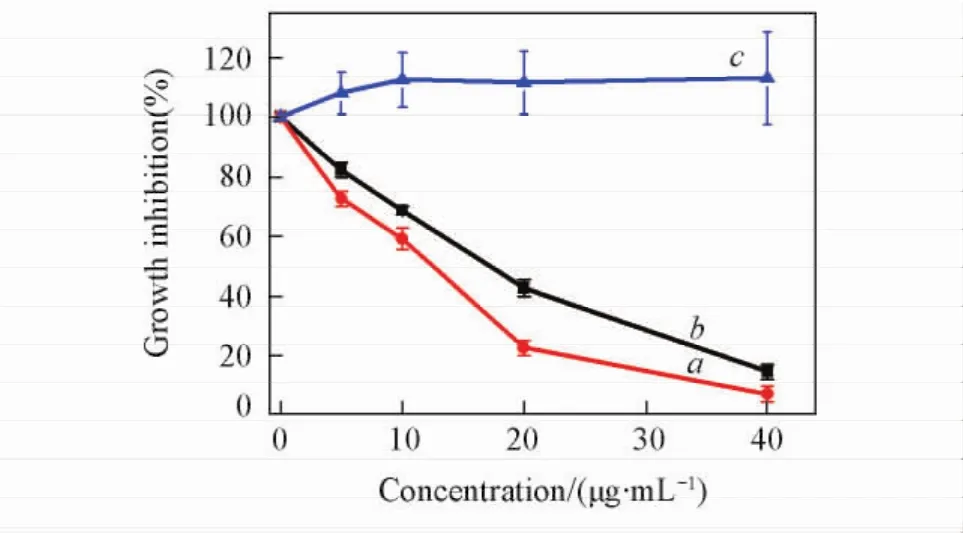
Fig.7 Effect of Curcumin/His-Pectin colloidal particles( a),Curcumin( b) and His-Pectin ( c) on growth inhibition in HepG2 cell
2.7抗肿瘤活性
为了研究His-Pectin胶体粒子作为载体包裹姜黄素的抗肿瘤活性,用CCK-8试剂测试了载有姜黄素的His-Pectin胶体粒子对HepG2细胞的增值效果,并以姜黄素及His-Pectin空载体作为对照.由图7可见,His-Pectin载体本身对于HepG2细胞的生长增值没有影响.对于姜黄素,IC50(使50%的细胞死亡所需样品的浓度)值约为15 μg/mL,而对于载有姜黄素的His-Pectin胶体粒子,IC50值约为11. 5 μg/mL,姜黄素经His-Pectin载体包裹后明显增强了其对HepG2细胞生长的抑制作用.
3 结 论
本文将Boc-组氨酸修饰到天然果胶骨架上,制备出在水溶液中具有pH响应性的纳米胶体,并将其作为输运载体对姜黄素进行包裹及控释.研究结果表明,His-Pectin胶体粒子包裹姜黄素,能够获得平均粒径为200 nm左右的载药胶体.通过细胞毒理测试,His-Pectin胶体粒子的浓度在800 μg/mL以下未见明显的细胞毒性,表明His-Pectin胶体粒子作为姜黄素载体是可行的.体外释放及抗肿瘤实验结果表明,姜黄素/His-Pectin胶体粒子在不同pH值条件下,药物的释放动力学性质存在明显差异,在酸性环境下药物释放速率明显变缓.体外细胞实验结果显示,His-Pectin胶体粒子载体能够明显提高姜黄素对HepG2细胞生长的抑制作用.综上,这种氨基酸修饰的天然果胶胶体粒子体系可望作为一种新型的pH可控释放姜黄素的理想载体,在生物医药领域中获得应用.
参考文献
[1]Omenn G.S.,Goodman G.E.,Thornquist M.D.,Balmes J.,Cullen M.R.,Glass A.,New England Journal of Medicine,1996,334,1150—1155
[2]Madsen K.,Cornish A.,Soper P.,Kaigney C.M.,Jijon H.,Yachimec C.,Doyle J.,Jewell L.,Simone C.D.,Gastroenterology,2001,121( 3),580—591
[3]Clare D.A.,Swaisgood H.E.,Journal of Dairy Science,2000,83( 6),1187—1195
[4]Anand P.,Kunnumakkara A.B.,Newman R.A.,Aggarwal B.B.,Molecular Pharmaceutics,2007,4( 6),807—818
[5]Ruby A.J.,Kuttan G.,Babu K.D.,Rajasekharan K.N.,Kuttan R.,Cancer Lett.,1995,94,79—83
[6]Lantz R.C.,Chen G.J.,Solyom A.M.,Jolad S.D.,Timmermann B.N.,Phytomedicine,2005,12,445—452
[7]Aggarwal B.B.,Kumar A.,Bharti A.C.,Anticancer Res.,2003,23,363—398
[8]Anand P.,Thomas S.G.,Kunnumakkara A.B.,Sundaram C.,Harikumar K.B.,Sung B.,Tharakan S.T.,Misra K.,Priyadarsini I.K.,Rajasekharan K.N.,Aggarwal B.B.,Biochem.Pharmacol.,2008,76,1590—1611
[9]Anand P.,Nair H.B.,Sung B.K.,Kunnumakkara A.B.,Yadav V.R.,Tekmal R.R.,Aggarwal B.B.,Biochem.Pharmacol.,2010,79,330—338
[10]Bisht S.,Feldmann G.,Soni S.,Ravi R.,Karikar C.,Maitra A.,Journal of Nanobiotechnology,2007,5( 3),1—18
[11]Liu L.,Fishman M.L.,Kost J.,Hicks K.B.,Biomaterials,2003,24,3333—3343
[12]Marreto R.N.,Ramos M.F.S.,Silva E.J.,Freitas O.D.,Freitas L.A.P.D.,AAPS Pharm.Sci.Tech.,2013,14( 3),1227—1235
[13]Jantrawut P.,Assifaouib A.,Chambin O.,Carbohydrate Polymers,2013,97( 2),335—342
[14]Puga A.M.,Lima A.C.,Mano J.F.,Concheiro A.,Lorenzo C.A.,Carbohydrate Polymers,2013,98( 1),331—340
[15]Heinze T.,Liebert T.,Heublein B.,Hornig S.,Adv.Polym.Sci.,2006,205,199—291
[16]Vandamme T.F.,Lenourry A.,Charrueau C.,Chaumeil J.C.,Carbohydrate Polymers,2002,48( 3),219—231
[17]Stigliano C.,Key J.,Ramirez M.,Aryal S.,Decuzz P.,Advanced Functional Materials,2015,25( 22),3371—3379
Synthesis and Properties of the Amino Acid Functionalized Curcumin/His-Pectin Colloidal Particles†
YANG Zechuan1,2,LI Fan2,HUANG Qingrong3,ZHANG Guo1*,SHI Tongfei2*
( 1.Institute of Materials Science and Engineering,Jilin University,Changchun 130012,China; 2.State Key Laboratory of Polymer Physics and Chemistry,Changchun Institute of Applied Chemistry,Chinese Academy of Sciences,Changchun 130022,China; 3.Department of Food Science,Rutgers University,New Jersey 08901,USA)
AbstractNew pH-responsive pectin derivatives were designed and synthesized by esterification.The architectures of the polymers were confirmed by Fourier transform infrared( FTIR) spectrophoto meter and Elemental analyses( EA).The prepared micelles properties were determined by UV-Vis spectra and transmission electron microscope( TEM).The cytotoxicity of Curcumin/His-Pectin colloidal particles was assessed using the cell counting kit-8 assay.The His-Pectin colloidal particles exhibited an irregular spherical shape from TEM photographs.Moreover,curcumin can be efficiently encapsulated in His-Pectin colloidal particles.The mean diameter of the curcumin colloidal particles was about 200 nm with narrow size distribution.The cytotoxic assays of Curcumin/His-Pectin colloidal particles demonstrated high inhibitory effect on HepG2 cell growth compared to the free curcumin.It was concluded that His-Pectin colloidal particles can efficiently encapsulate curcumin in vitro and promote the inhibition of HepG2 cell growth in vitro.
Keywords pH-Responsive; Colloidal particles; Drug delivery; Growth inhibition of tumor cells; Amino acid functionalized; Pectin derivatives; Curcumin
( Ed.: W,Z)
†Supported by the National Natural Science Foundation of China( No.21174146).
基金项目:国家自然科学基金(批准号: 21174146)资助.
收稿日期:2015-07-27.网络出版日期: 2016-01-06.
doi:10.7503/cjcu20150591
中图分类号O636.1+3
文献标志码A
联系人简介:张国,男,博士,教授,主要从事遇水膨胀及半导高分子智能材料研究.E-mail: guozhang@ jlu.edu.cn石彤非,男,博士,研究员,主要从事合成高分子与生物大分子相行为及相转变研究.E-mail: tfshi@ ciac.jl.cn

