酮洛芬固体分散体的制备及其体外溶出度研究
王小宁,张存劳,马 婷
(西安医学院药学院,陕西 西安 710021)
酮洛芬固体分散体的制备及其体外溶出度研究
王小宁,张存劳,马 婷
(西安医学院药学院,陕西 西安 710021)
目的 将酮洛芬制成固体分散体,考察其体外溶出特性。方法 以聚乙二醇(PEG)为载体,用熔融法制备固体分散体,用正交试验筛选最优处方和制备工艺,X射线衍射法对其进行表征,并对固体分散体进行体外溶出度研究。结果 固体分散体最优处方和工艺为,PEG 6000为载体,药物与载体比例为1∶5,制备温度为100℃,制备时间为30 min。制成的固体分散体在pH=7.6的介质中释放速率最快,45 min时溶出百分率为94.5%。结论 酮洛芬固体分散体可显著提高酮洛芬的体外溶出速率。
酮洛芬;固体分散体;体外溶出度;聚乙二醇
酮洛芬(KPF)为非甾体类抗炎药,临床主要用于治疗风湿性或类风湿性关节炎、骨关节炎等疾病,疗效确切。但由于酮洛芬是水难溶性药物,简单混合制成的制剂溶出度较差[1-2]。固体分散技术是提高难溶性药物溶出度的常用方法,药物在固体分散体中可形成固体溶液、微晶或无定型分散状态,具有很高的分散程度,因此溶解度和溶出速率可显著提高[3-4]。本试验中采用熔融法制备酮洛芬固体分散体,以体外溶出度为指标,考察了亲水性高分子载体材料和用量对固体分散体性能的影响,为酮洛芬的制剂开发奠定基础。现报道如下。
1 仪器与试药
ALC-201.4型分析天平(赛多利斯);DHG9140B型电热鼓风干燥箱(上海安亭科学仪器有限公司);DRT-TW型调温电热套(河南巩义予华仪器有限责任公司);XRD-7000S/L型X射线衍射仪(津岛企业管理有限公司);D-800LS型智能溶出仪(天津市光学仪器厂);UV-2102 PCS型紫外分光光度计(尤尼柯仪器有限公司)。酮洛芬原料药(湖北拓楚慷元医药化工有限公司);聚乙二醇(PEG)4000,PEG 6000,PEG 10000(广东光华化学厂有限公司);聚维酮PVPK30,北京化学试剂公司)。
2 方法与结果
2.1 制备
分别称取处方比例的酮洛芬与载体,过筛后混合均匀,得到酮洛芬与载体的物理混合物。将制备好的物理混合物置烧杯中,将烧杯置恒温水浴中,在制备温度下,搅拌30 min直到酮洛芬完全熔融,得到固体分散体,在干燥箱中放置24 h,过150 μm筛,得到均匀的粉末状样品,备用[5]。
2.2 X射线衍射试验
取酮洛芬原料药、酮洛芬与PEG 6000 1∶1物理混合物、酮洛芬固体分散体进行X射线衍射表征。X射线衍射条件:Cu-Ka射线作为X射线;管电流20 mA;管电压40 kV;衍射角(2θ),测定范围5~50°(5°/min)。结果见图1。X射线衍射试验表明,酮洛芬为结晶较好的化合物,其较具特征的衍射峰为 17.36°,18.42°,20.08°,22.90°,23.98°,27.72°。酮洛芬和载体的物理混合物X射线衍射试验结果可见,酮洛芬的主要衍射峰在图中均有显现,说明混合后药物和辅料并未发生化学变化,仍以原晶体状态存在。固体分散体的X射线衍射图谱表明,酮洛芬的主要衍射峰已消失,推断固体分散体中酮洛芬以分子状态在载体中分散。
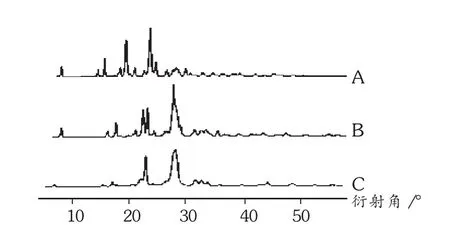
图1 X-射线衍射图
2.3 体外溶出试验
最大吸收波长确定:精密称取酮洛芬 40 mg,在50 mL容量瓶中用95%乙醇振荡溶解后,稀释至刻度。精密吸取1 mL,置100 mL容量瓶中,用95%乙醇稀释至刻度,摇匀,制成8 μg/mL的溶液。在220~400 nm波长范围内检测紫外吸收,以95%乙醇为空白对照。结果酮洛芬的最大吸收波长为266 nm波长。
标准曲线制备:精密称取酮洛芬10 mg,置100 mL容量瓶中,用95%乙醇溶解,定容至刻度,得质量浓度为100 μg/mL的贮备液。分别将贮备液稀释成质量浓度为4,6,8,10,12 μg/mL的溶液,在266 nm波长处测定吸光度,以吸光度(A)对浓度(C)作标准曲线,得标准曲线方程 A=0.042 5 C+0.173 2,r=0.991 6(n=5)。结果表明,酮洛芬质量浓度在4~12 μg/mL范围内与吸光度线性关系良好。
加样回收试验:精密称取9份酮洛芬-PEG 6000(1∶4)固体分散体4 mg,分别置25 mL容量瓶中,分别精密加入酮洛芬对照品贮备液适量,95%乙醇稀释至刻度,制成低、中、高质量浓度的供试品溶液,在266 nm波长处测定吸光度,计算回收率。结果平均回收率为99.6%,RSD为1.33%(n=9),表明方法回收率良好,不受载体干扰。
溶出度测定:参照2010年版《中国药典(二部)》溶出度测定法和释放度测定法,采用智能溶出仪桨法进行体外溶出度测定[6]。分别取各处方固体分散体(相当于酮洛芬20 mg)进行体外溶出试验。设定转速为100 r/min,水浴温度为37℃(上下不超过0.5℃),溶出介质为500 mL的蒸馏水。自药物接触介质开始计时,分别于0,5,10,20,30,60,120 min时取样5 mL,过0.22 μm微孔滤膜后,取续滤液2 mL,置容量瓶稀释,同时向介质中补加等体积同温度蒸馏水。样品溶液于266 nm波长处测定吸光度,代入标准曲线方程求算溶出率,并绘制溶出曲线。
2.4 制备工艺优选
正交试验:选择对溶出度影响较大的因素载体相对分子质量(因素 A)、载体用量(因素 B)、制备温度(因素 C)、制备时间(因素 D)为考察因素,以45 min的体外溶出度为考察指标,进行 L9(34)正交试验。因素水平见表1,正交试验及结果见表2,方差分析见表3。
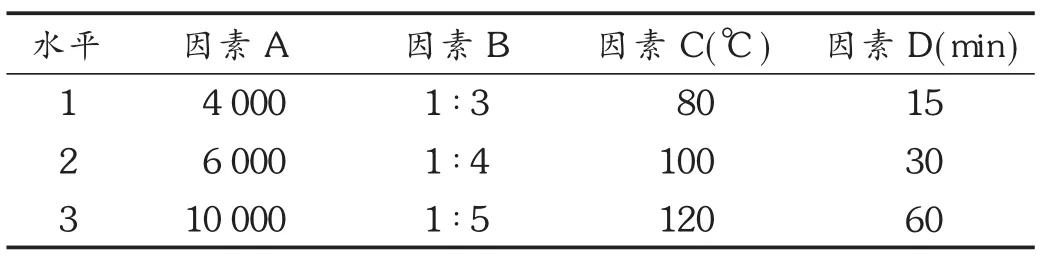
表1 正交试验因素及水平表
优选:可见,各因素对酮洛芬溶出速率的影响程度依次为B>A>D>C,且载体用量(B)对溶出速率有显著影响(P<0.05),故酮洛芬固体分散体最佳制备工艺为A2B3C3D3,即以PEG 6000为载体,原料与载体比例为1∶5,制备温度为120℃,制备时间为60 min。但考虑到因素C和D差异不显著,考虑到温度和时间对药物的稳定性影响和成本问题,故将优选工艺定为A2B3C2D2,即PEG 6000为载体,原料与载体比例为1∶5,制备温度为100℃,制备时间为30 min。
验证试验:按A2B3C3D3和 A2B3C2D2工艺制备分别固体分散体,平行制备3份,按溶出度测定项下方法操作。结果见4。
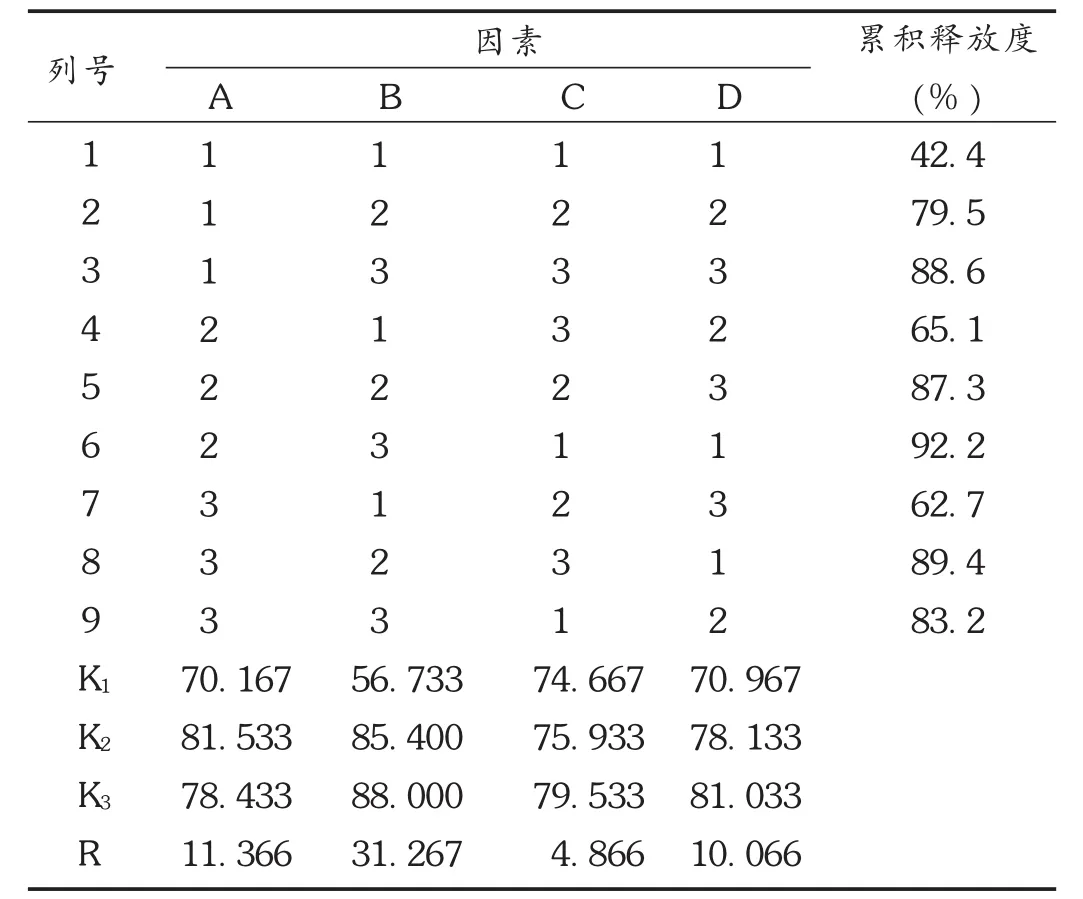
表2 L9(34)正交试验及结果
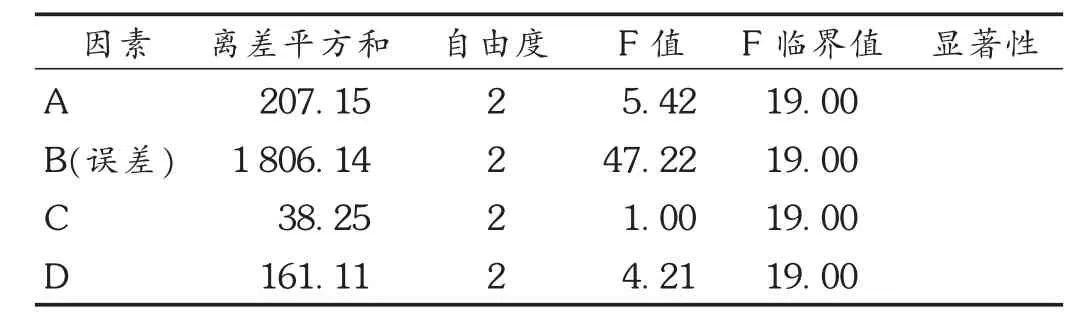
表3 方差分析结果
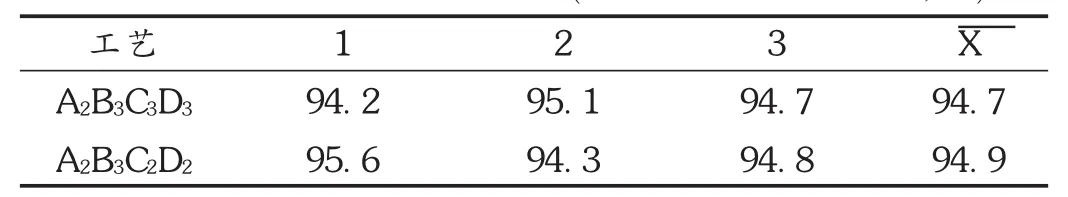
表4 优选工艺验证试验结果(45 min的体外溶出度,%)
2.5 不同pH溶出介质中溶出特性考察
按最优处方及制备工艺制备酮洛芬固体分散体,选择pH在1.2~7.6范围的释放介质进行体外溶出试验,溶出曲线见图2。可见,随着pH的增大,溶出速率加快,在pH=7.6下溶出速率最快,45 min时累积溶出度已达到94.5%。因此,酮洛芬制成固体分散体后,提高了药物的肠道吸收,有效增加了药物的生物利用度。
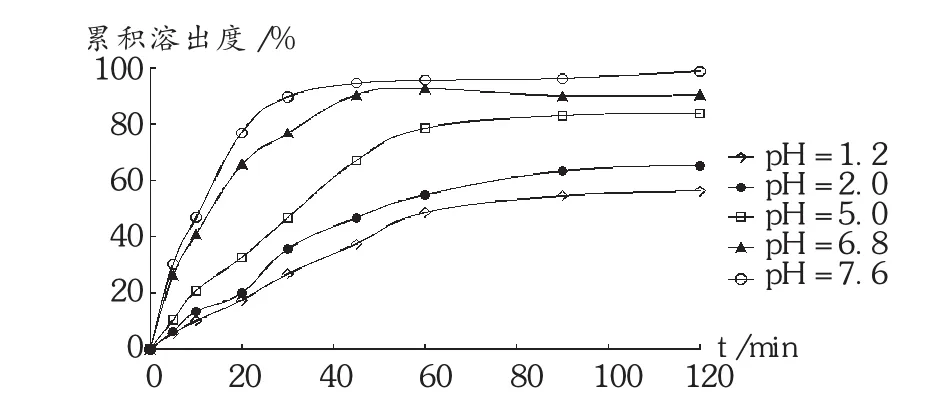
图2 溶出介质pH对固体分散体中酮洛芬溶出的影响
3 讨论
根据Noyes-Whitney方程,药物的溶出速率与药物的表面积成正比,固体分散体最大特点在于药物高度分散于载体中,增加了药物的溶出表面积,从而提高了难溶性药物的溶出速率和吸收速率[7]。
PEG是水溶性高分子无定形聚合物,由两列平行的螺状链所组成,经熔融-凝结后PEG分子中螺旋的空间晶格产生缺损,当药物相对分子质量不超过1 000时,可插入于螺旋链的缺损晶格,形成填充型固体溶液,此时药物以分子状态分散。以PEG作辅料,可制备速释型固体分散体,能大大提高酮洛芬的溶解度,有利于其溶出[8]。
方差分析结果显示,酮洛芬与PEG的用量比例对溶出度有显著性影响。载体用量的增大提高了酮洛芬在载体中的分散程度,使其溶解度和溶出速率均增大[9]。
酮洛芬固体分散体在pH=7.6的介质中释放最快,对其释放度数据进行拟合,Weibull模型为酮洛芬固体分散体释放的最佳拟合模型,即释放度拟合方程[10]为Ln{Ln[1/1-Ft]}=0.800 2Lnt-2.163 5,r2=0.949 9。经重复性试验表明,按最佳处方和工艺制备酮洛芬固体分散体,2 h的累积体外释放度为94.5%,促进药物溶出效果显著。对于进一步开发酮洛芬的口服固体剂型具有重要意义。
[1]陈 琰,胡晋红,范国荣,等.酮洛芬的制剂研究[J].药学进展,2001,15(4):219-223.
[2]姚宝君,王启帅,牛万刚,等.酮洛芬含量测定方法及药效学研究进展[J].中国药业,2006,15(21):60-61.
[3]王苏会,王 瑞,孙晓迪,等.固体分散体及其技术在药物制剂中的应用进展[J].中医药导报,2014,20(10):54-56.
[4]张桂侠,彭安堂,赵玉斌,等.药物粒径缩小的意义与方法[J].中国药业,2013,22(3):1-2.
[5]魏 敏,关 皎,徐 璐,等.熔融法制备布洛芬固体分散体[J].沈阳药科大学学报,2010,27(1):15-19.
[6]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:附录ⅩC-ⅩD.
[7]刘建平.生物药剂学与药物动力学[M].第4版.北京:人民卫生出版社,2014:35-36.
[8]黄 凯,陈芳晓,钱春梅.固体分散技术国外研究进展[J].中国药业,2008,17(21):64-66.
[9]王汝兴,陈大为,胡海洋,等.酮洛芬-聚乙烯吡咯烷酮固体分散物的制备及其体外溶出度的研究[J].沈阳药科大学学报,2006,4(4):201-204.
[10]张 莉,夏运岳 .用电子表格 Excel计算药物溶出度Weibull分布参数[J].药学进展,2002,26(1):48-50.
Preparation and In-Vitro Dissolution of Ketoprofen Solid Dispersion
Wang Xiaoning,Zhang Cunlao,Ma Ting
(College of Pharmacy,Xi′an Medical University,Xi′an,Shaanxi,China 710021)
Objective To prepare ketoprofen solid dispersion and to investigate its in-vitro dissolution.M ethods Polyethylene glycol was selected as matrix to prepare solid dispersion by melting method.Orthogonal design was used to optimize the prescription and process.Powder X-ray was used to characterize the solid dispersion and the in-vitro dissolution was investigated.Results The optimal preparation and process of ketoprofen solid dispersion was prepared at temperature of 100℃ for 30 min with PEG 6000 as a carrier and the drug and carrier ratio was 1∶5.The in-vitro dissolution rate was 94.5% during 45 min in the medium of pH= 7.6.Conclusion Solid dispersion can significantly improve the in-vitro dissolution rate of ketoprofen.
ketoprofen;solid dispersion;in-vitro dissolution;polyethylene glycol
R944;R971+.1
A
1006-4931(2016)01-0022-03
王小宁(1987-),女,硕士研究生,讲师,研究方向为药物新剂型,(电子信箱)wangxn_0508@126.com。
2015-07-27)

