氮、磷、钾对盐胁迫谷子幼苗形态和生理指标的影响
呼红梅++王莉

摘要:以盆栽谷子晋谷21号为试验材料,采用“3414”不完全正交试验设计,从植物生长状况、渗透调节物质、保护酶活性等研究氮(N)、磷(P)、钾(K)对盐胁迫谷子幼苗形态及生理指标的影响,探索营养元素N、P、K含量及配比与谷子抗盐性的关系。结果表明,谷子幼苗在轻度盐胁迫下施用N、P、K分别为100、87、249 mg/kg,中度盐胁迫下施用N 100 mg/kg,P 43.5、87.0 mg/kg,K 124.5、249 mg/kg,重度盐胁迫下施用N、P、K分别为100、43.5、124.5 mg/kg有利于植物生长;N、P、K配合施用,其交互作用效果更利于谷子生长而提高抗盐性,但适宜的N、P、K肥料用量范围变小;N、P、K用量过高会造成盐害,不利于谷子抗盐。
关键词:谷子;幼苗;盐胁迫;形态指标;生理指标
中图分类号: S515.062文献标志码: A文章编号:1002-1302(2016)02-0117-05
收稿日期:2015-03-02
基金项目:国家科技支撑计划重点项目(编号:2008BADA4B01);山西省引进优秀人才专项基金(2010);山西省留学基金(2011)。
作者简介:呼红梅(1987—),女,山西吕梁人,硕士,主要从事植物生理生态学研究。E-mail:hhm135527@126.com。
通信作者:王莉,副教授,硕士生导师,主要从事植物生理生态学研究。E-mail:wangli11882003@126.com。目前,我国耕地面积约为1.35亿 hm2[1],其中盐碱土占耕地面积的 20%,主要分布于土壤蒸发量大、降水量少的干旱、半干旱地区及滨海地区[2],这些地区也是我国谷子种植分布较多的地域。开发盐碱地,提高作物的抗盐性,对补充我国耕地资源、确保国家粮食安全具有不可替代的作用。
谷子[Setaria italic (L.) Beauv.]古称粟,是禾本科狗尾草属的1个栽培种,对土壤盐分中度敏感,土壤盐胁迫常常造成谷子萌发率低、出苗不全、幼苗长势弱等现象,严重影响谷子的产量和经济效益,研究盐胁迫对谷子幼苗生长的影响对谷子生产具有重要意义[3-4]。氮(N)、磷(P)、钾(K)作为作物生长的3大主要营养元素,对提高作物的抗盐性有重要作用。有研究表明,盐胁迫下适宜的氮肥可以改善马铃薯的光合能力,显著提高马铃薯脱毒苗叶片的SOD和POD活性[5];适量的P、K肥能提高NaCl胁迫下玉米苗期叶片中的叶绿素含量和干物质量,增强渗透调节能力和POD、SOD、CAT活性,使MDA含量降低[6];增施磷肥能促进黑麦草幼苗生长,增加干物质积累,提高叶片叶绿素含量,增加可溶性糖、可溶性蛋白质及脯氨酸含量[7];适量的钾肥,可提高菊芋幼苗在盐境下的生物量,促进光合作用[8],马铃薯脱毒苗叶片的脯氨酸含量显著提高[9],玉米幼苗叶片和根系中MDA 含量降低,POD、SOD、CAT 活性增加[10],NaCl胁迫下冬小麦幼苗地上部和地下部的生长、可溶性糖含量、抗氧化酶的活性提高,电解质外渗量和MDA含量降低[11]。目前,NaCl胁迫下,以N、P、K单一养分对作物抗盐性的研究较多,且多集中于玉米、大麦、小麦、马铃薯、甜高粱等作物[5,9-13],对谷子耐盐性的研究报道甚少,主要集中于谷子发芽期、幼苗前期耐盐性鉴定指标研究、耐盐品种和基因型的筛选、盐胁迫对谷子农艺性状及产量的影响[3-4,14-15],施肥对盐胁迫下谷子幼苗的影响尚未见报道。本试验通过研究N、P、K对盐胁迫下谷子幼苗形态和生理指标的影响,分析N、P、K含量及配比与谷子幼苗抗盐性的关系,为合理施肥提高谷子抵抗盐胁迫能力提供理论依据。
1材料与方法
1.1试验材料
试验于2014年5月在山西师范大学生命科学学院实验室内进行,采用直径、高分别为9、12.5 cm的盆播种谷子,每盆装沙500 g,供试沙子经清水反复洗涤,几乎不含有养分。供试谷子品种为晋谷21号。供试肥料为:Ca(NO3)2·4H2O,含N 11.9%;KH2PO4,含P2O5 52.1%、K2O 34.6%;K2SO4,含K2O 54.1%。
1.2试验设计
试验采用农业部推荐的“3414”不完全正交设计(表1),最佳施肥量为N ∶P2O5 ∶K2O=1 ∶0.67 ∶1,2/3的氮肥、全部磷肥和钾肥一次性施入沙中。另外,加入B、Mn、Zn、Cu、Mo、Fe、Mg分别为0.5、0.5、0.05、0.02、0.01、5.6、0.5 mg/kg。设无盐胁迫、轻度盐胁迫、中度盐胁迫、重度盐胁迫4个胁迫处理水平,沙中NaCl用量分别为0(CK)、0.4、0.8、1 g/kg。
试验时,挑选籽粒成熟且饱满的种子,用1% KMnO4溶液浸泡10 min进行消毒,用蒸馏水清洗干净,备用;每盆播种30粒,置于昼夜温度分别为30、20 ℃、光照15 h/d的人工气候培养箱中进行培养;出苗后,留苗10株培养45 d,取样调查测定相关指标。土壤水分控制采用称质量法,每盆保持最大田间持水量的60%。
1.3指标测定与方法
幼苗株高、叶面积分别采用直接测量法、AM 300型叶面积仪进行测量;相对叶绿素含量用CM-1000叶绿素仪直接测定;茎、叶和根干物质的质量测定,先将茎、叶和根烘干,采用分析天平称量;可溶性糖、可溶性蛋白质、脯氨酸含量分别
采用蒽酮比色法、考马斯亮蓝G-250染色法、磺基水杨酸法[16]测定;过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性分别采用愈创木酚法、氮蓝四唑(NBT)光化还原法、紫外吸收法[17]测定;丙二醛(MDA)含量采用硫代巴比妥酸法[18]测定。
1.4数据处理
用Excel 2003处理数据和作图;用SPSS 16.0在α=0.05水平上对试验结果进行方差分析和Duncans多重比较。
2结果与分析
2.1N、P、K对盐胁迫谷子幼苗生长的影响
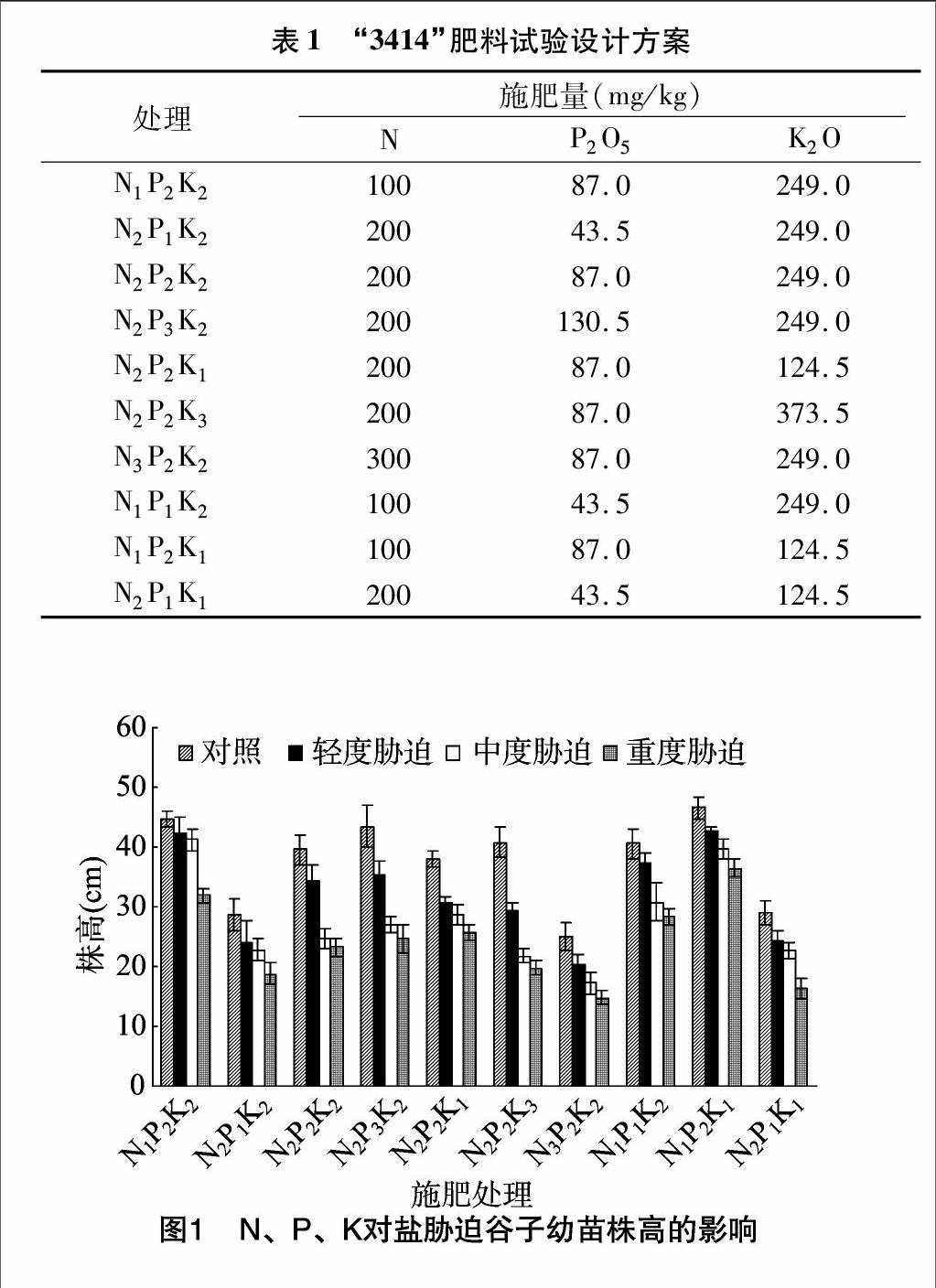
由图1至图4可知,相同P2K2水平下,3种盐处理随施N量的增加,谷子幼苗株高、叶面积、叶绿素含量、干物质质量呈减小趋势,且差异显著(P<0.05,下同),与无盐胁迫(CK)相比,N1水平的谷子幼苗株高、叶面积、叶绿素含量、干物质质量降幅相对最小,轻度、中度与重度盐胁迫的株高降幅分别为5.7%、7.9%、28.8%,叶面积降幅分别为9.5%、22.2%、40.7%,叶绿素含量降幅分别为4.7%、14.1%、20.3%,干物质质量降幅分别为25.8%、31.1%、46.0%。
相同N2K2水平下,3种盐处理随施P量的增加,谷子幼苗株高、叶面积呈增加趋势,叶绿素含量呈减小趋势;轻度盐胁迫下,谷子幼苗P2、P3株高大于P1,P1、P2叶绿素含量大于P3,叶面积大小为P3>P2>P1,差异显著;中度、重度盐胁迫下,谷子幼苗的株高大小为P3>P2>P1,P3叶面积大于P1、P2,P1叶绿素含量大于P2、P3,差异显著;轻度与中度盐胁迫下,随施P量的增加干物质质量呈先增加后减小趋势,轻度盐胁迫下P2干物质质量大于P1、P3,中度盐胁迫下P1、P2干物
质质量大于P3,差异显著;重度盐胁迫下,随施P量的增加干物质质量呈减小趋势,P1、P2干物质质量与P3差异显著。与无盐胁迫相比,轻度盐胁迫下,P2水平的株高降幅相对最小,为13.1%,叶面积在不同P水平间降幅差异不显著,叶绿素含量在P1、P2水平降幅相对较小,分别为13.1%、16.2%,干物质质量在P1水平降幅相对最小,为30.6%;中度、重度盐胁迫下,株高、叶面积、叶绿素含量、干物质质量在P1水平的降幅相对最小,株高降幅分别为20.7%、34.6%,叶面积降幅分别为30.9%、45.3%,叶绿素含量降幅分别为20.5%、289%,干物质质量降幅分别为37.4%、50.5%。
相同N2P2水平下,轻度盐胁迫处理,随施K量的增加,谷子幼苗株高、叶面积、干物质质量呈先增加后减小的趋势,K2株高大于K1、K3,K1、K2的叶面积、干物质质量大于K3,差异显著;中度、重度盐胁迫下,随施K量的增加,谷子幼苗株高、叶面积、干物质质量呈减小趋势,中度盐胁迫下均为K1>K2>K3,差异显著,重度盐胁迫下株高为K1>K2>K3,K1叶面积、干物质质量大于K2、K3,差异显著;随施K量的增加,轻度、中度盐胁迫下叶绿素含量呈先增加后减小的趋势,重度盐胁迫下叶绿素含量呈减小趋势,3种盐胁迫下,K1、K2叶绿素含量大于K3,差异显著。与无盐胁迫相比,轻度盐胁迫下株高在K2水平,叶面积、叶绿素含量、干物质质量在K1水平降幅相对最小,分别为13.1%、15.6%、10.0%、33.5%;中度、重度盐胁迫下,株高、叶面积、叶绿素含量、干物质质量在K1水平降幅相对最小,其中,株高降幅分别为24.4%、32.6%,叶面积降幅分别为29.3%、39.8%,叶绿素含量降幅分别为225%、31.0%,干物质质量降幅分别为 41.5%、58.2%。
N、P、K交互作用情况下,轻度盐胁迫处理,株高与干物质质量在N1P2K1,叶绿素含量在N1P2K2,叶面积在N1P2K2、N1P2K1相对较大;中度盐胁迫下,株高、叶面积、叶绿素含量在N1P2K2、N1P2K1及干物质质量在N1P2K1相对较大;重度盐胁迫下,株高、叶面积、干物质质量在N1P2K1,叶绿素含量在N1P2K2、N1P2K1相对较大。与无盐胁迫相比,轻度盐胁迫下,株高在N1P2K2、N1P2K1、N1P1K2的降幅相对较小,分别为5.7%、8.0%、8.4%,中度盐胁迫下N1P2K2、重度盐胁迫下N1P2K1的降幅相对最小,分别为7.9%、21.8%;叶面积、叶绿素含量在不同处理间降幅差异不显著,干物质质量在N1P2K1、N1P2K2、N1P1K2的降幅相对较小。
2.2N、P、K对盐胁迫谷子幼苗渗透调节物质的影响
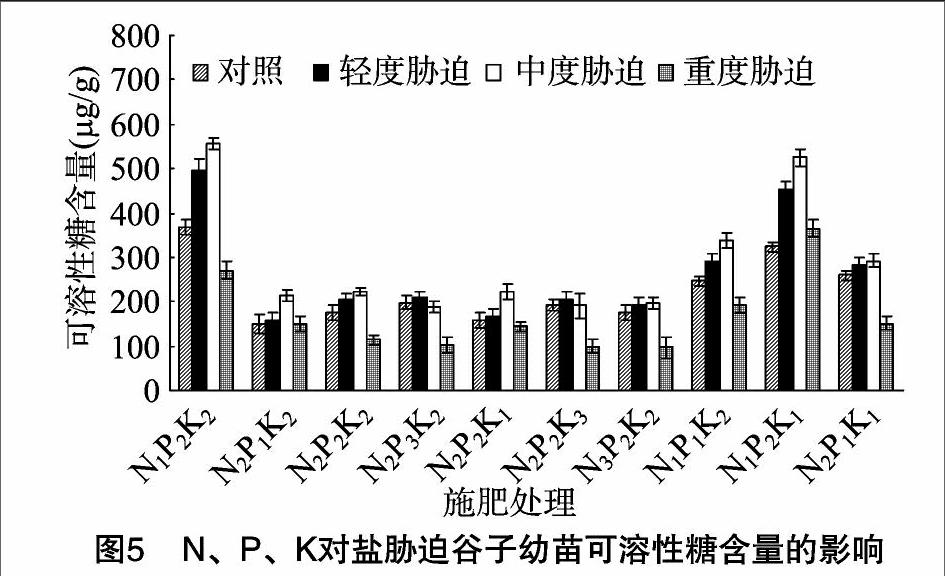
由图5至图7可知,相同P2K2水平下,3种盐胁迫处理,随施N量的增加,谷子幼苗可溶性糖、可溶性蛋白质、脯氨酸含量呈减小趋势,轻度盐胁迫下N1可溶性糖含量大于N2、N3,可溶性蛋白质、脯氨酸含量大小为N1>N2>N3,中度与重度盐胁迫下,可溶性糖、可溶性蛋白质、脯氨酸含量大小为N1>N2>N3,差异显著。与无盐胁迫相比,轻度与中度盐胁迫下可溶性糖、可溶性蛋白质、脯氨酸含量在N1水平增幅相对较大,其中,可溶性糖含量增幅分别为35.1%、51.3%,可溶性蛋白质含量增幅分别为22.5%、32.4%,脯氨酸含量增幅分别为45.5%、76.8%;重度盐胁迫下,可溶性糖、可溶性蛋白质含量在N1水平降幅相对最小,分别为26.2%、13.4%,脯氨酸含量则增幅相对最大,为20.3%。
相同N2K2水平下,随施P量增加,轻度盐胁迫的谷子幼苗可溶性糖、脯氨酸含量呈增加趋势,P2、P3>P1,中度盐胁迫的谷子幼苗可溶性糖、脯氨酸含量呈先增加后减小趋势,P1、P2>P3,重度盐胁迫的谷子幼苗可溶性糖、脯氨酸含量呈减小趋势,P1可溶性糖含量大于P2、P3,脯氨酸含量大小为P1>P2>P3,差异显著;随施P量的增加,轻度盐胁迫的谷子幼苗可溶性蛋白质含量呈先增加后减小趋势,P2>P3>P1,中度与重度盐胁迫的谷子幼苗可溶性蛋白质含量呈减小趋势,P1>
P2>P3,差异显著。与无盐胁迫相比,谷子幼苗可溶性糖、可溶性蛋白质、脯氨酸含量在轻度盐胁迫下P2水平的增幅相对最大,分别为17.6%、9.3%、28.9%,中度盐胁迫下P1水平的增幅相对最大,分别为42.4%、23.2%、46.4%;重度盐胁迫下,可溶性糖、可溶性蛋白质含量在P1水平的降幅相对最小,分别为9.7%、10.7%,脯氨酸含量增幅相对最大,为2.8%。
相同N2P2水平下,随施K量的增加,轻度与中度盐胁迫处理谷子幼苗可溶性糖含量呈先增加后减小的趋势,重度盐胁迫下可溶性糖含量呈减小趋势,轻度盐胁迫下K2、K3可溶性糖含量大于K1,中度盐胁迫下K1、K2可溶性糖含量大于K3,重度盐胁迫下K1可溶性糖含量大于K2、K3,差异显著。随施K量的增加,轻度盐胁迫下可溶性蛋白质、脯氨酸含量呈先增加后减小趋势,K2可溶性蛋白质、脯氨酸含量大于K1、K3,中度与重度盐胁迫下可溶性蛋白质、脯氨酸含量呈减小趋势,K1、K2可溶性蛋白质含量大于K3,中度盐胁迫下,K1脯氨酸含量大于K2、K3,重度盐胁迫下脯氨酸含量大小为 K1>K2>K3,差异显著。与无盐胁迫相比,可溶性糖、可溶性蛋白质、脯氨酸含量在轻度盐胁迫K2水平的增幅相对最大,分别为17.6%、9.3%、28.9%,中度盐胁迫K1水平的增幅相对最大,分别为39.0%、47.1%、80.6%,重度盐胁迫下,可溶性糖含量在K1水平降幅相对最小,为9.6%,可溶性蛋白质、脯氨酸含量增幅相对最大,分别为1.9%、22.3%。
N、P、K交互作用下,轻度盐胁迫下可溶性糖与可溶性蛋白质含量在N1P2K2、脯氨酸含量在N1P2K1相对最高,中度盐胁迫下可溶性糖含量在N1P2K2、可溶性蛋白质与脯氨酸含量在N1P2K1相对最高,重度盐胁迫下可溶性糖、可溶性蛋白质、脯氨酸含量N1P2K1相对最高。与无盐胁迫相比,轻度盐胁迫下,可溶性糖含量在N1P2K1、N1P2K2的增幅相对最大,分别为39.6%、35.1%,可溶性蛋白质含量在N1P2K2的增幅相对最大,为22.5%,脯氨酸含量在N1P2K1、N1P2K2、N1P1K2的增幅相对较大,分别为53.9%、45.5%、39.6%;中度与重度盐胁迫下,可溶性糖、可溶性蛋白质、脯氨酸含量在N1P2K1的增幅相对最大,中度盐胁迫下的增幅分别为62.2%、59.3%、93.9%,重度盐胁迫下的增幅分别为12.8%、11.3%、38.7%。
2.3N、P、K对盐胁迫谷子幼苗保护酶活性的影响
由图8至图10可知,相同P2K2水平下,随施N量的增加,3种盐胁迫处理谷子幼苗的POD、SOD、CAT酶活性呈减小趋势,N1>N2>N3,差异显著。与无盐胁迫相比,POD、SOD、CAT酶活性在轻度与中度盐胁迫下N1水平增幅相对最大,重度盐胁迫下降幅相对最小,其中,轻度盐胁迫下的增幅分别为49.9%、31.6%、86.8%,中度盐胁迫下的增幅分别为74.6%、48.2%、111.1%;重度盐胁迫下的降幅分别为12.2%、11.2%、9.7%。
相同N2K2水平下,随施P量的增加,轻度与中度盐胁迫谷子幼苗的POD、SOD、CAT酶活性呈先增加后减小的趋势,重度盐胁迫下POD、SOD酶活性显著减小;轻度盐胁迫下,P2的POD、SOD酶活性大于P1、P3,P2、P3的CAT酶活性大于P1,中度盐胁迫下,P1、P2的POD、SOD、CAT酶活性大于P3,重度盐胁迫下POD、SOD酶活性大小为P1>P2>P3,差异显著,CAT酶活性在不同P水平间差异不显著。与无盐胁迫相比,轻度盐胁迫下POD酶活性在P1水平增幅相对最大,为19.2%,SOD、CAT酶活性在P2水平增幅相对最大,分别为11.7%、65.1%;中度盐胁迫下,POD、SOD酶活性在P1水平增幅相对最大,分别为25.6%、26.2%,CAT酶活性在P1、P2水平增幅相对较大,分别为78.5%、74.0%;重度盐胁迫下,POD、SOD、CAT酶活性在P1水平降幅相对最小,分别为 16.9%、15.5%、17.7%。
相同N2P2水平下,随施K量增加,轻度盐胁迫谷子幼苗的POD酶活性呈先增加后减小趋势,中度与重度盐胁迫下POD酶活性呈减小趋势;轻度盐胁迫下K2的POD酶活性大于K1、K3,中度盐胁迫下K1的POD酶活性大于K2、K3,重度盐胁迫下的POD酶活性为K1>K2>K3,差异显著。随施K量增加,轻度与中度盐胁迫下SOD酶活性呈增加趋势,重度盐胁迫下SOD酶活性呈减小趋势;轻度盐胁迫下SOD酶活性为K3>K2>K1,中度盐胁迫下K2、K3的SOD酶活性大于K1,重度盐胁迫下K1、K2的SOD酶活性大于K3,差异显著。随施K量的增加,轻度与中度盐胁迫下CAT酶活性呈先增加后减小趋势,重度盐胁迫下呈减小趋势;轻度盐胁迫下,K2、K3的CAT酶活性大于K1,中度盐胁迫下K1、K2的CAT酶活性大于K3,重度盐胁迫下K1的CAT酶活性大于K2、K3,差异显著。与无盐胁迫相比,轻度盐胁迫下,POD酶活性在K1水平增幅相对最大,为18.6%,SOD、CAT酶活性在K2水平增幅相对最大,分别为11.7%、65.1%;中度盐胁迫下,POD、SOD酶活性在K1水平增幅相对最大,分别为35.2%、270%,CAT酶活性在K1、K2水平增幅相对较大,分别为651%、74.0%;重度盐胁迫下,POD、SOD、CAT酶活性在K1水平降幅相对最小,分别为17.9%、17.1%、9.0%。
N、P、K交互作用情况下,轻度盐胁迫处理,POD酶活性在N1P2K2、N1P2K1及SOD酶活性在N1P2K2、CAT酶活性在N1P2K1相对较高;中度与重度盐胁迫下,POD与CAT酶活性在N1P2K1、SOD酶活性在N1P2K2相对最高。与无盐胁迫相比,轻度盐胁迫下谷子幼苗的POD、SOD酶活性在N1P2K2、N1P2K1、N1P1K2的增幅相对较大,分别为49.9%、43.9%、35.2%和31.6%、27.2%、23.0%,CAT酶活性在N1P2K1、N1P2K2的增幅相对较大,分别为91.8%、86.8%;中度盐胁迫下,POD、SOD酶活性在N1P2K1的增幅相对最大,分别为 90.9%、66.8%,CAT酶活性在N1P2K1、N1P2K2的增幅相对较大,分别为111.5%、111.1%;重度盐胁迫下,POD、SOD酶活性在N1P2K1的降幅相对最小,分别为4.4%、1.8%,CAT酶活性增幅相对最大,为14.4%。
2.4N、P、K对盐胁迫谷子幼苗MDA含量的影响
由图11可知,相同P2K2水平下,随施N量的增加,3种盐胁迫处理MDA含量呈增加趋势,N3>N2>N1,差异显著。与无盐胁迫相比,轻度、中度与重度盐胁迫下MDA含量在N1水平增幅相对最小,分别为11.6%、55.%、85.8%。
相同N2K2水平下,随施P量的增加,轻度盐胁迫下MDA含量呈先减小后增加趋势,中度与重度盐胁迫下MDA含量
呈增加趋势;轻度与中度盐胁迫下P3的MDA含量大于P1、P2,重度盐胁迫下MDA含量大小为P3>P2>P1,差异显著。与无盐胁迫相比,轻度、中度与重度盐胁迫下MDA含量在P1水平的增幅相对最小,分别为47.7%、60.8%、86.3%。
相同N2P2水平下,随施K量的增加,3种盐胁迫处理MDA含量呈增加趋势;轻度盐胁迫下,K3的MDA含量大于K1、K2,中度与重度盐胁迫下MDA含量为K3>K2>K1,差异显著。与无盐胁迫相比,轻度、中度与重度盐胁迫下MDA含量在K1水平增幅相对最小,分别为49.4%、63.0%、88.8%。
N、P、K交互作用情况下,轻度盐胁迫处理的谷子幼苗MDA含量在N1P2K2、N1P2K1水平相对较小,中度与重度盐胁迫下N1P2K1水平相对最小。与无盐胁迫相比,轻度盐胁迫下MDA含量在N1P2K1、N1P2K2的增幅相对较小,分别为 10.1%、11.6%,中度与重度盐胁迫下N1P2K1的增幅相对最小,分别为14.8%、32.7%。
3讨论与结论
盐害是农业生产上重要的逆境危害之一。生长指标和生物量反映逆境胁迫下植物的适应性和逆境胁迫效应[19],渗透调节是植物适应盐胁迫的最基本特征之一[20],抗氧化酶活性的提高是活性氧自由基增加和胁迫条件下保护酶系统建立的标志[21],植物器官在逆境条件或衰老时,丙二醛(MDA)含量用于表示细胞膜质过氧化程度和植物对逆境条件反应的强弱。本试验结果表明,轻度盐胁迫下,谷子幼苗在N1、P2、K2水平,即N、P、K含量分别为100、87、249 mg/kg时各指标相对较好,此时株高的降幅较小,渗透调节物质含量、SOD、CAT酶活性增幅较大;中度盐胁迫下,N1、P1、P2、K1、K2水平,即N含量为100 mg/kg,P含量为43.5、87 mg/kg,K含量为124.5、249 mg/kg时各指标相对较好,各形态指标及干物质质量的降幅相对较小,渗透调节物质含量和POD、SOD酶活性增幅相对大;重度盐胁迫下,N1、P1、K1水平,即N、P、K含量分别为100、43.5、124.5 mg/kg 时各指标较好,各形态指标及干物质质量、保护酶活性的降幅相对较小,N1、P1水平可溶性糖和可溶性蛋白含量降幅相对较小,脯氨酸含量增幅相对较大,K1水平可溶性糖含量降幅相对最小,可溶性蛋白质、脯氨酸含量增幅相对最大;3种盐胁迫下,N1、P1、K1水平MDA含量增幅相对最小。这表明谷子幼苗在轻度盐胁迫下N1、P2、K2水平、中度盐胁迫下N1、P1、P2、K1、K2水平及重度盐胁迫下N1、P1、K1水平抗盐效果较好,适量施肥对提高谷子体内渗透调节物质含量、保护酶活性有好处,有利于抵抗盐胁迫,较高的N、P、K增加了总盐分浓度,盐害加重,对谷子生长不利。N、P、K交互作用下,轻度盐胁迫谷子幼苗的形态指标及干物质质量在N1P2K2、N1P2K1、N1P1K2相对较好,N1P2K2有利于渗透调节物质、保护酶抗盐性的发挥,N1P2K2、N1P2K1有利于减轻膜脂过氧轻度化作用;中度与重度盐胁迫下,形态指标及干物质质量在N1P2K1相对最好,有利于渗透调节物质、保护酶抗盐性的发挥及减轻膜脂过氧化作用。这说明,盐胁迫下适当多施用P、K可以缓解盐胁迫。
逄焕成等认为,NaCl胁迫下分别施N 150、300、450 mg/kg(土),能显著增加小麦株高、叶面积、干物质积累量[12]。宁建凤试验发现,海盐浓度8.3、16.7 g/L条件下施N 200 mg/kg,可使2种海盐处理的芦荟叶片可溶性糖、脯氨酸含量增幅最大,有利于增强芦荟植株的渗透调节能力,降低芦荟叶片中MDA含量[22]。沈振国等研究认为,Nacl 0.85、1.25 g/kg(土)胁迫下,大麦叶片的SOD酶活性下降,施N 100、200 mg/kg (土)能增加叶片的SOD酶活性,特别是在NaCl浓度较高时,N素的效应更为明显[23]。逄焕成等研究得出的最佳N施肥量[12,22-23]高于本试验结果,可能是由于本试验采用沙培,没有土壤吸附离子造成的缓解作用。因此,盐地谷子苗期施肥时,可根据耕地土壤对肥料的吸附特性适当增加N、P、K用量。
王玉凤研究表明,含150 mmol/L NaCl、1 mmol/L总磷的1/2 Hongland 营养液培养玉米幼苗的干质量、叶绿素、可溶性糖、可溶性蛋白质含量和POD、SOD、CAT酶活性等明显增加,MDA含量降低[6]。杨晓英等认为,2、3 g/kg NaCl胁迫及施N 100 mg/kg(土)条件下,施P2O5 100 mg/kg (土)能明显增加黑麦草幼苗干物质积累、叶绿素、可溶性糖、可溶性蛋白质、脯氨酸含量,促进盐胁迫下黑麦草幼苗的生长[7]。郑延海等研究发现,1.58 g/kg (沙) NaCl胁迫下,KNO3浓度为 10 mmol/L时可以使小麦幼苗株高、叶面积受到的盐分伤害得到缓解,POD、SOD、CAT酶活性升高、MDA含量降低,过高的KNO3浓度(15 mmol/L)对小麦生长不利[11]。本试验结果与以上结论均相似。
参考文献:
[1]杨立,王博祺,韩锋. 改革开放以来我国耕地保护绩效定量研究——基于数量保护的视角[J]. 农机化研究,2015(3):1-6.
[2]赵可夫,李法曾. 中国盐生植物[M]. 北京:科学出版社,1999:1-6.
[3]崔兴国,时丽冉. 衡水地区14份夏谷品种种子萌发期耐盐性研究[J]. 作物杂志,2011(4):117-119.
[4]田伯红,王建广,李雅静,等. 谷子品种芽期和苗期对NaCl胁迫的反应及耐盐性鉴定[C]. 2008中国作物学会学术年会论文摘要集,2008:123.
[5]张瑞玖,蒙美莲,郦海龙,等. NaCl胁迫下氮对马铃薯的调控作用[J]. 中国农学通报,2010,26(6):146-149.
[6]王玉凤. 玉米苗期对NaCl胁迫的响应与耐盐性调控机理的研究[D]. 沈阳:沈阳农业大学,2008.
[7]杨晓英,杨劲松. 盐胁迫对黑麦草幼苗生长的影响及磷肥的缓解作用[J]. 土壤通报,2005(6):85-88.
[8]黄增荣,隆小华,刘兆普,等. KNO3对NaCl胁迫下两菊芋品种幼苗生长及光合能力的影响[J]. 草业学报,2011,20(1):82-88.[9]王朝霞,蒙美莲,张静,等. NaCl胁迫下钾对马铃薯的调控作用[J]. 作物杂志,2012(4):94-97.
[10]王玉凤,薛盈文,杨克军,等. 钾对NaCl胁迫下玉米幼苗保护酶活性等生理特性的影响[J]. 黑龙江八一农垦大学学报,2010,22(4):19-22.
[11]郑延海,宁堂原,贾爱君,等. 钾营养对不同基因型小麦幼苗NaCl胁迫的缓解作用[J]. 植物营养与肥料学报,2007,13(3):381-386.
[12]逄焕成,杨劲松,谢晓红. 氯化钠胁迫下施氮对冬小麦生长发育及体内氯、钠离子积累的影响[J]. 植物营养与肥料学报,2005,11(5):654-658,664.
[13]穆静,刘小京,徐进,等. 氮素对NaCl胁迫下甜高粱种子萌发及芽苗生长与生理的影响[J]. 中国生态农业学报,2012,20(10):1303-1309.
[14]智慧,刁现民,吕芃,等. 人工盐胁迫法鉴定谷子及狗尾草物种耐盐基因型[J]. 河北农业科学,2004,8(4):15-18.
[15]田伯红. 盐碱胁迫对谷子农艺性状及产量的影响[J]. 河北农业科学,2009,13(10):4-5.
[16]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:258-260.
[17]王学奎. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006:172-173.
[18]张志良,瞿伟菁. 植物生理学实验指导[M]. 北京:高等教育出版社,2003:274-276.
[19]宋云鹏. 外源硅对NO-3胁迫下黄瓜幼苗生长及生理生化特性的影响[D]. 泰安:山东农业大学,2011:37.
[20]刘友良,汪良驹. 植物对盐胁迫的反应和耐盐性[M]//余叔文,汤章城.植物生理与分子生物学. 2版.北京:科学出版社,1998:752-798.
[21]Meloni D A,Oliva M A,Martinez C A,et al. Photosynthesis and activity of superoxide dismutase,peroxidase and glutathione reductase in cotton under salt stress[J]. Environmental and Experimental Botany,2003,49(1):69-76.
[22]宁建凤. 氮对盐胁迫下库拉索芦荟生长及生理特性的影响[D]. 南京:南京农业大学,2005:46.
[23]沈振国,沈其荣,管红英,等. NaCl胁迫下氮素营养与大麦幼苗生长和离子平衡的关系[J]. 南京农业大学学报,1994,17(1):22-26.聂俊,邱俊荣,史亮亮,等. 有机肥和化肥配施对抛栽水稻产量、品质及钾吸收转运的影响[J]. 江苏农业科学,2016,44(2):122-125.

