机器人辅助腹腔镜与后腹腔镜活体供肾切取术的临床研究
阮东丽 张更 刘克普 李智斌 高龙 秦卫军 王延柱 杨晓剑 袁建林
·论著·
机器人辅助腹腔镜与后腹腔镜活体供肾切取术的临床研究
阮东丽 张更 刘克普 李智斌 高龙 秦卫军 王延柱 杨晓剑 袁建林
目的 比较机器人辅助腹腔镜活体供肾切取术与后腹腔镜活体供肾切取术的临床疗效,评估机器人辅助腹腔镜供肾切取术对供、受者的安全性和有效性。方法 回顾性分析2013年9月至2015年8月第四军医大学西京医院泌尿外科31例行机器人辅助腹腔镜活体供肾切取术(机器人组)及29例行后腹腔镜活体供肾切取术(后腹腔镜组)供、受者临床资料。比较机器人组和后腹腔镜组供者术前一般情况、手术时间、热缺血时间、术中出血量、住院时间、并发症发生情况、术后随访情况,以及两组受者手术前后血清肌酐值、手术并发症和术后移植肾功能。计量资料组间比较采用t检验,计数资料组间比较采用χ2检验。结果 机器人组与后腹腔镜组手术均顺利完成。两组供者术中出血量分别为(39±15)和(62±37)mL,住院时间分别为(4.6±1.0)和(5.4±1.5)d,差异均有统计学意义(t=3.01和2.46,P均<0.05);手术时间、热缺血时间及并发症发生率差异均无统计学意义(P均>0.05)。此外,机器人辅助腹腔镜组2例供者术中出现脾脏损伤,1例出现术后出血;后腹腔镜组1例供者术后出现泌尿系统感染,1例术后术后第6天发现髂外静脉血栓,1例术后出现伤口脂肪液化。两组供者术后随访6个月以上,均无高血压、蛋白尿、肾功能异常等并发症发生。两组受者术后第7、30天血清肌酐值分别为(120±26)和(132±43)μmol/L,(115±18)和(118±39)μmol/L,差异均无统计学意义(t=0.78和0.96,P均>0.05)。机器人组及后腹腔镜组受者移植肾存活比例分别为100.0%(31/31)和96.6%(28/29)。结论 机器人辅助腹腔镜活体供肾切取术具有安全、可靠、创伤小、恢复快、不影响供移植肾功能等优势,是一种可供选择的供肾切取方式。
机器人辅助腹腔镜; 后腹腔镜; 肾移植
目前,活体供肾切取的手术方式主要有开放性、腹腔镜及机器人辅助腹腔镜供肾切取术3种。腹腔镜供肾切取术具有创伤小、术后恢复快等优势,已逐步替代开放性供肾切取术,成为活体供肾切取的主要方式[1-2]。第四军医大学西京医院泌尿外科2012年引入达芬奇机器人系统,已完成机器人辅助腹腔镜手术300余例。本研究回顾性分析我院机器人辅助腹腔镜及后腹腔镜活体供肾切取术供、受者的临床资料,并对二者的手术效果进行比较,以评估机器人辅助腹腔镜供肾切取术对供、受者的安全性和有效性。
1 资料与方法
1.1 研究对象与分组
2013年9月至2015年8月,我院共完成机器人辅助腹腔镜活体供肾切取术31例(机器人组)及后腹腔镜供肾切取术29例(后腹腔镜组),均为自愿捐献。供、受者关系以父母捐献给子女为主,供者均签署知情同意书,并通过医院医学伦理委员会审核通过。所有供者均无腹部手术史,无高血压、心脏病、肺结核、糖尿病及肝肾疾病等病史;术前查血清肌酐、尿素氮、肝功能等生化指标均正常;HBsAg、HCV抗体、HIV抗体定性检查均为阴性;腹部B超检查示双肾动静脉未见异常,输尿管无畸形;术前常规检查无手术禁忌证。
1.2 手术方法
机器人辅助腹腔镜供肾切取术供者采取斜卧位,为避免肝脏对右肾的影响,且左肾静脉较长便于腹腔镜手术操作和肾移植手术,原则上首选左肾,如因肾小球滤过率及血管畸形等原因不能以左肾为供肾,则切取右肾。
1.2.1 机器人辅助腹腔镜供肾切取术(以取左肾为例)
供者全麻成功后,取供肾对侧70°角斜位,术前留置14F导尿管。取脐上2.0 cm腹直肌旁横行皮肤切口(长约1.2 cm)作为镜头孔,建立气腹并保持气腹压力12~15 mmHg(1 mmHg=0.133 kPa,下同),将12 mm套管针置入腹腔,置入向上30°角镜头。直视下以镜头孔为中心,距锁骨中线肋缘下、髂前上棘内上方两横指处分别置入8 mm套管针作为头、尾侧机械臂孔。镜头孔与尾侧机械臂孔中点斜下方置入12 mm套管针为辅助孔。套管置入后将向上30°角镜头更换为向下30°角镜头。将床旁3个机械臂与上述相应套管连接,分别置入镜头、单机电剪(第1机械臂)、双极电凝(第2机械臂),辅助孔置入吸引器或抓钳等辅助器械。
采用腹腔供肾切取方法,分离肾周组织,显露术野。沿结肠旁沟切开后腹膜,切断脾结肠韧带,将左半结肠及上段降结肠翻向内下,切开肾周筋膜,于肾周筋膜外分离左肾背侧、腹侧及下极,于肾上极将肾周筋膜前后层离断,分离肾上腺与肾脏之间组织,向下游离输尿管至髂血管分叉处,注意保护输尿管血供。沿输尿管内侧向上分离至肾门处,于肾门前方打开左肾静脉鞘,分离左肾静脉至下腔静脉处,分别游离腰静脉、肾上腺中央静脉及生殖静脉,远心端均用Hem-o-Lok夹夹闭,近心端结扎切断。于肾静脉后方将肾动脉鞘切开,由于肾动脉鞘分布有丰富的淋巴管,应使用超声刀低档逐渐切断,以预防术后淋巴瘘的发生。分离左肾动脉至腹主动脉平面,将肾周组织完全游离。供肾完全游离后,以辅助孔为起点沿腹直肌切开皮肤约6 cm,深至肌层。于髂血管分叉处切断输尿管,肾动、静脉根部用2枚Hem-o-Lok夹夹闭并切断。停止气腹,移去镜头及机械臂,切开肌层及腹膜,手辅助取出供肾,立即进行灌注、修整。观察有无出血,肾窝留置引流管1根,缝合各切口,术毕。
1.2.2 后腹腔镜供肾切取术(以取左肾为例)
供者全麻成功后,取供肾对侧卧位,髂嵴上方2 cm处做10 mm切口,置入10 mm套管针及镜头,确认穿刺进入腹膜后间隙,建立气腹,保持气腹压力12~15 mmHg。钝性分离腹膜后间隙,直视下于12肋缘下腋前线及腋后线分别置5、12 mm套管针。沿腰大肌向头侧逐渐打开肾筋膜及肾周脂肪囊,在脂肪囊内紧贴肾实质表面用超声刀游离肾脏,依次游离腹侧下极、背侧上下极、肾蒂血管、输尿管及肾上极,尽可能多地保留肾门周围结缔组织。根据动脉搏动寻及肾动脉,分离至腹主动脉起始部。完全游离肾静脉,分别游离腰静脉、肾上腺中央静脉及生殖静脉,远心端均用Hem-o-Lok夹夹闭、近心端结扎的方式切断。在肾下极寻及输尿管并游离至髂血管交叉处,待肾脏游离完毕、肾血管完全暴露后,离断输尿管。自腋前线穿刺点向脐部延长5~6 cm 切口,至切开腹外斜肌、腹内斜肌,钝性分离腹横机,左手进入后腹腔握住肾脏和血管,分别在肾动静脉根部用2枚Hem-o-Lok夹夹闭并迅速切断,左手直接取出肾脏,立即进行灌注修整。观察有无出血,肾窝留置引流管1根,缝合各切口,术毕。
1.3 观察指标
比较机器人组和后腹腔镜组供者术前一般情况、手术时间、热缺血时间、术中出血量、住院时间、并发症发生情况、术后随访情况及受者手术前后血清肌酐值、手术并发症和术后移植肾功能。
1.3 统计学分析
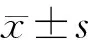
2 结 果
2.1 两组供者术前一般情况
比较机器人组及后腹腔镜组供者性别、年龄、术前体质量指数及血清肌酐值,差异均无统计学意义(P均>0.05),详见表1。

表1 机器人组及后腹腔镜组供者术前一般情况比较
2.2 两组供者围手术期情况
机器人组及后腹腔镜组手术均顺利完成,两组供者均于术后第2天给予全流食,并下地活动,术后24 h内拔除导尿管。机器人组和后腹腔镜组供者术中出血量分别为(39±15)和(62±37)mL,住院时间分别为(4.6±1.0)和(5.4±1.5)d,差异均具有统计学意义(P均<0.05)。两组手术时间、热缺血时间和并发症发生率差别均无统计学意义(P均>0.05),见表2。
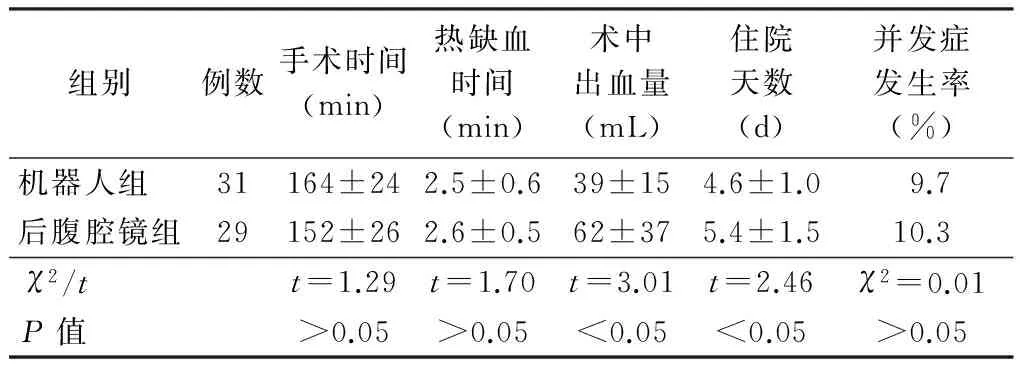
表2 机器人组及后腹腔镜组供者围手术期情况比较
2.3 两组供者术后并发症发生情况
机器人组供肾取出时,2例供者出现脾脏损伤,均于术中行脾脏修补术;1例供者术后暗红色引流液较多,术后第4天复查血红蛋白87 g/L,遂给予止血、纠正贫血等对症治疗,引流液明显减少,术后2周拔除引流管。其余供者术后均恢复良好,未发生术后并发症。后腹腔镜组1例供者术后出现泌尿系统感染,查尿常规示:白细胞3+,红细胞1+,有明显尿频、尿急症状,遂给予抗感染治疗,并嘱其多饮水,经上述处理后该供者明显好转;1例供者术后第6天因左下肢水肿、皮肤颜色暗沉行下肢血管B超检查,发现髂外静脉血栓,遂行下腔静脉滤器植入术,手术顺利,术后恢复良好,此供者术前血管B超未发现血栓形成;1例供者术后伤口出现脂肪液化,愈合延迟。其余供者术后均恢复良好,无手术并发症发生。
2.4 两组受者移植肾功能
机器人组及后腹腔镜供组受者术前血清肌酐水平分别为(740±96)和(716±125)μmol/L,差异无统计学意义(t=0.45,P>0.05);两组受者术后第7、30天血清肌酐分别为(120±26)和(132±43)μmol/L、(115±18)和(118±39)μmol/L,差异均无统计学意义(t=0.78和0.96,P均>0.05)。两组受者移植肾均在血管开放后10~30 s排尿。机器人组1例受者术后出现移植肾功能延迟恢复,给予血液透析、调整免疫抑制剂等治疗后,术后第1个月血清肌酐恢复正常。后腹腔镜组1例受者术后出现漏尿,给予留置移植肾周引流管及尿管充分引流尿液,效果欠佳,后行移植肾输尿管再植术,术后恢复良好;1例受者术后第2个月出现重度肺部感染,给予抗细菌、真菌、病毒等综合治疗后,肺部感染治愈,因治疗过程中停用免疫抑制剂,并应用引起肾损害的药物,最终导致移植肾失功。两组其余受者术后均恢复良好,无手术相关并发症发生。
两组供、受者术后随访中位时间16个月(6~25个月),供者无高血压、蛋白尿、肾功能异常等远期并发症发生;除后腹腔镜组1例受者术后出现移植肾失功外,其余移植肾功能均良好,移植肾存活比例分别为100.0%(31/31)和96.6%(28/29)。
3 讨 论
活体肾移植供肾切取术与常规肾脏切除术不同,此种手术为保护功能性手术,需要尽量将手术本身对供者的损伤降至最低,术中应最大限度地减少对肾脏的碰触,肾脏切取后应保留足够长度的动、静脉及输尿管。随着腹腔镜技术的发展,越来越多的中心开始开展腹腔镜活体供肾切取术,并取得了良好的效果[3-4]。机器人辅助腹腔镜活体供肾切取术是供肾切取手术的最新进展,该方法源于常规腹腔镜下供肾切取术[5]。
尽管腹腔镜下供肾切取术的技术已经非常成熟,但仍然受到设备上的限制而存在诸多缺点,例如二维视野、操作臂僵直、打结及缝合困难、术者舒适程度差、易疲劳等[6-7]。机器人外科手术系统因其具有高清的三维视野、智能灵巧的内腕系统,大大提高了手术安全性和术者舒适度,同时缩短了学习曲线,这些优势使其在腹腔镜外科领域得到了广泛应用[8-9]。
本研究结果显示,机器人辅助腹腔镜活体供肾切取术与后腹腔镜供肾切取术相比,手术时间、热缺血时间及并发症发生率无明显差异,且术中出血量减少,住院时间明显缩短;术后早期移植肾功能恢复良好;供者在术后长达6~25个月的随访中,无高血压、蛋白尿、肾功能异常等远期并发症发生;受者在同样的随访时间内移植肾功能均良好,未发现肾功能异常及蛋白尿等情况。以上结果说明机器人辅助腹腔镜供肾切取术对供者是安全的,在移植肾功能恢复方面与后腹腔镜供肾切取术相比,亦是有效的。
活体肾移植供者术后严重并发症的发生率很少超过2%,严重的心理后遗症也非常少见[10]。供者外科手术引起的并发症主要包括肺不张(7.4%)、切口感染(4.3%)、气胸(1.5%)、出血(0.9%)、肺炎(0.9%)、切口血肿(0.6%)、尿路感染(0.3%)及手术死亡(0.03%)等,长期风险主要涉及供肾切取手术对供者肾功能及血压的影响,主要表现为高血压及微量蛋白尿的出现,以及慢性肾病的发生[11]。虽然经腹腔途径手术操作空间大,但易损伤腹腔脏器。有文献报道机器人辅助腹腔镜供肾切取术的主要并发症有肠梗阻、淋巴瘘及肾静脉置管相关性感染等[12]。在本研究中,虽然机器人辅助腹腔镜供肾切取术组供肾取出时2例供者出现脾脏损伤,1例术后出血,但未出现上述并发症。后腹腔镜组1例供者术后泌尿系统感染,1例术后第6天发现髂外静脉血栓,1例术后伤口脂肪液化,愈合延迟。
微创手术的真正含义是对组织损伤小,使患者最大程度受益。与后腹腔镜下供肾切取术相比,机器人辅助腹腔镜供肾切取术的优势有:(1)手术操作空间大,可以避免辅助腹腔镜器械反复接触肾脏,减少副损伤的发生;(2)能够充分游离下腔静脉,肾静脉根部应用Hem-o-Lok夹,尽可能保证了供肾静脉的全长,而后腹腔镜左肾切取术无法实现这一点;(3)先游离肾静脉,后游离肾动脉,手术全程对肾脏的接触和位置改变减少,减少肾动脉痉挛的发生,更加符合供肾切取过程中“不接触肾脏”的原则;(4)应用机器人系统中的三维视野及灵巧的内腕系统,在处理中央静脉、腰静脉及生殖静脉时可以更多地使用打结完成,减少了Hem-o-Lok夹的使用及意外发生。
目前,制约机器人辅助腹腔镜推广使用的主要因素是手术费用过高。4 163例腹腔镜活体供肾切取与142例机器人辅助腹腔镜活体供肾切取Meta分析发现:机器人手术费用显著高于传统腹腔镜,而在手术并发症和移植物功能方面与传统腹腔镜相比差异无统计学意义[13]。机器人手术作为一种新的医疗技术引进本院,考虑到患者对机器人手术存在逐渐了解的过程,且避免因费用问题影响手术方式的选择,医院方面在初期给予减免机器人使用费,使我们在开展机器人腹腔镜供肾切取过程中暂无需考虑费用过高给患者带来的经济压力。
机器人手术系统是高端的新兴医疗器械,相信随着制造工艺的进展和专利的到期,昂贵的设备成本必然降低。同时,机器人手术系统改善医务人员工作条件,提高工作效率,降低人力成本,其更短的学习曲线有利于培养更多的腹腔镜操作医师,从而降低整个微创手术的基本成本。
综上所述,机器人辅助腹腔镜活体供肾切取术安全可行,随着成本的降低,使其在临床上推广成为可能。
1 Leventhal JR, Deeik RK, Joehl RJ, et al. Laparoscopic live donor nephrectomy-is it safe?[J]. Transplantation, 2000, 70(4):602-606.
2 Pradel FG, Limcangco MR, Mullins CD, et al. Patients′ attitudes about living donor transplantation and living donor nephrectomy[J]. Am J kidney Dis, 2003,41(4): 849-858.
3 赵磊, 马潞林, 侯小飞, 等. 后腹腔镜活体供肾切取术115例总结[J/CD]. 中华腔镜泌尿外科杂志:电子版, 2009, 3(2):98-102.
4 董隽, 卢锦山, 祖强, 等. 改良手辅助后腹腔镜活体供肾切取术(附视频)[J/CD]. 中华移植杂志:电子版, 2010, 4(3):219-220.
5 Giacomoni A, Di Sandro S, Lauterio A, et a1. Initial experience with robot-assisted nephrectomy for living-donor kidney transplantation: feasibility and technical notes[J]. Transplant Proc, 2013, 45(7):2627-2631.
6 殷长军, 张炜, 顾民, 等, 腹腔镜活体供肾切取术(附16例报告)[J]. 中华泌尿外科杂志, 2005, 26(10):669-671.
7 Pietrabissa A, Abelli M, Spinillo A, et al. Robotic-assisted laparoscopic donor nephrectomy with transvaginal extraction of the kidney[J]. Am J Transplant, 2010, 10(12):2708-2711.
8 Benway BM, Bhayani SB, Rogers CG, et al. Robot assisted partial nephrectomy versus laparoscopic partial nephrectomy for renal tumors:a multi-institutional analysis of perioperative outcomes[J]. J Urol, 2009, 182(3):866-872.
9 Ellison JS, Montgomery JS, Wolf JS, et al. A matched comparison of perioperative outcomes of a single laparoscopic surgeon versus a multisurgeon robot-assisted cohort for partial nephrectomy[J]. J Urol, 2012, 188(1):45-50.
10 Ingelfinger JR. Risks and benefits to the living donor[J]. N Engl J Med, 2005, 353(5):447-449.
11 Levey AS, Danovitch G, Hou S. Living donor kidney transplantation in the United States-looking back, looking forward[J]. Am J Kidney Dis, 2011, 58(3):343-348.
12 Huberf J, Renouh E, Mourey E, et a1. Complete robotic-assistance during laparoscopic living donor nephrectomies:an evaluation of 38 procedures at a single site[J]. Int J Urol, 2007, 14(11):986-989.
13 Monn MF, Gramm AR, Bahler CD, et al. Economic and utilization analysis of robot-assisted versus laparoscopic live donor nephrectomy[J]. J Endourol, 2014, 28(7):780-783.
(本文编辑:徐小明)
阮东丽, 张更, 刘克普, 等. 机器人辅助腹腔镜与后腹腔镜活体供肾切取术的临床研究[J/CD]. 中华移植杂志: 电子版, 2016, 10(3):117-121.
Clinical research of robot-assisted laparoscopy versus retroperitoneal laparoscopy for living donor nephrectomy
RuanDongli,ZhangGeng,LiuKepu,LiZhibin,GaoLong,QinWeijun,WangYanzhu,YangXiaojian,YuanJianlin.
DepartmentofUrology,XijingHospital,theFourthMilitaryMedicalUniversity,Xi′an710032,China
RuanDongli,Email:745501416@qq.com
Objective To compare the outcomes of robot-assisted laparoscopy and retroperitoneal laparoscopy for living donor nephrectomy and to investigate the safety and feasibility of robot-assisted laparoscopic living donor nephrectomy. Methods Sixty cases of living donor nephrectomy from September 2013 to August 2015 were retrospectively reviewed. Thirty-one donors were performed with robot-assisted laparoscopic living donor nephrectomy (robot group), Twenty-nine donors underwent retroperitoneal laparoscopic living donor nephrectomy (retroperitoneal group). General preoperative, operation time, warm ischemia time, intraoperative hemorrhage volume, hospitalization time, complications and data of follow-up of the donors, and preoperative and postoperative serum creatinine value, complications and allograft function of the recipients between the two groups were compared. Results Both of the two groups were performed successfully. Intraoperative hemorrhage volume and hospitalization time of robot group and retroperitoneal group were (39±15) and (62±37) mL, (4.6±1.0) and (5.4±1.5) d, respectively, both were significantly reduced in robot group (t=3.01 and 2.46,Pall<0.05). But operation time, warm ischemia time and complications occurred rate in the two groups had no significant difference (Pall>0.05). In robot group, 2 donors occured with splenic injury during operation and 1 donor was detected with hemorrhage after operation. In retroperitoneal group, 1 donor occured with urinary tract infection, 1 donor occured with external iliac vein thrombosis, 1 donor was detected with wound fat liquefaction after operation. All the donors were followed up for more than 6 months, no hypertension, proteinuria, renal dysfunction and other long-term complications were detected. The blood creatinine of robot group and retroperitoneal group of recipients after operation of 7th day and 30th day were (120±26) and (132±43) umol/L, (115±18) and (118±39) umol/L, respectively, there was no statistical difference (t=0.78 and 0.96,Pall>0.05). The survival rate of recipients in the two groups were 100% (31/31) and 96.6% (28/29), respectively. Conclusions Robot-assisted laparoscopic nephrectomy was a safe, reliable, minimal invasive and effective procedure for living-donor kindey transplantation, which was an alternative way for living donor nephrectomy.
Robot-assisted laparoscopy; Retroperitoneal laparoscopy; Kindey transplantation
10.3877/cma.j.issn.1674-3903.2016.03.005
710032 西安,第四军医大学西京医院泌尿外科
阮东丽,Email:745501416@qq.com
2016-05-06)

