水稻小粒矮秆突变体sgd1(t)的表型分析及基因克隆
汪鹏 蔡跃 陈韦韦 马婧 陈新刚 唐小洁 尤小满 孔飞 张杰 燕海刚 汪国湘
江玲 张文伟* 万建民
(南京农业大学 作物遗传与种质创新国家重点实验室/长江流域杂交水稻协同创新中心/农业部长江中下游粳稻生物学与遗传育种重点实验室, 南京210095; *通讯联系人,E-mail:zhangww@njau.edu.cn)
水稻小粒矮秆突变体sgd1(t)的表型分析及基因克隆
汪鹏蔡跃陈韦韦马婧陈新刚唐小洁尤小满孔飞张杰燕海刚汪国湘
江玲张文伟*万建民
(南京农业大学 作物遗传与种质创新国家重点实验室/长江流域杂交水稻协同创新中心/农业部长江中下游粳稻生物学与遗传育种重点实验室, 南京210095;*通讯联系人,E-mail:zhangww@njau.edu.cn)
汪鹏, 蔡跃, 陈韦韦,等. 水稻小粒矮秆突变体sgd1(t) 的表型分析及基因克隆. 中国水稻科学, 2016, 30(1): 1-9.
摘要:在日本晴T-DNA突变体库中筛选得到小粒矮秆突变体sgd1(t) ,经多代自交稳定遗传。sgd1(t) 出现植株矮化、粒型圆小、叶色深绿和颖壳厚实等表型。茎秆及颖壳细胞扫描电镜结果表明,sgd1(t) 茎秆细胞不能形成正常细胞列、维管束发育异常;颖壳表皮细胞排列紧密但不规则;GA信号转导途径响应正常。遗传分析表明突变体sgd1(t) 的矮秆性状受一对隐性核基因控制。采用图位克隆方法,将sgd1(t) 定位于第9染色体短臂Indel标记DF13和DF26之间,物理距离约为230 kb。该区间存在已克隆的矮秆基因BC12/GDD1。测序结果显示,sgd1(t) 在该基因第4个外显子发生由G到T的单碱基突变,导致第186位保守氨基酸由甘氨酸突变为缬氨酸。
关键词:水稻; 小粒矮秆; 基因克隆; BC12/GDD1 ; 单碱基突变
株高是水稻株型建成重要的农艺性状之一,直接影响水稻品种的生产潜力和抗倒伏性。20世纪60年代,绿色革命基因的成功应用,使水稻单产提高了20%~30%[1],之后杂种优势的利用和超级稻育种的兴起,都建立在矮化育种的成果之上。由此可见,株型改良一直以来都是水稻育种工作的主线之一。
目前,已定位的株高基因达到132个,涉及水稻的全部染色体,其中,已克隆的株高基因达到21个(http://www.shigen.nig.ac.jp/rice/oryzabase; http://www.ricedata.cn)。大多数株高基因与植物激素相关,包括赤霉素(Gibberellins, GA)相关基因,如sd1、d35、slr1、gid2[2-5],油菜素内酯(Brassinosteroids, BR)相关基因,如d2、d61[6-8],以及独脚金内酯(Strigolactones, SL)相关基因,如d10、d14等[9-11]。其中,GA合成途径相关基因SD1编码GA20氧化酶,催化GA53形成GA20。在sd1突变体中,GA合成前体物质GA53含量显著升高导致有活性的GA20和GA1减少,植株变矮。D35编码GA合成初始阶段的内根-贝壳杉烯氧化酶(OsKO2),OsKO2是催化贝壳杉烯向贝壳杉酸转化过程的关键酶之一,该基因突变使得GA合成受阻,导致半矮化表型。此外,高秆基因slr1和矮秆基因gid2均为GA信号转导途径基因。SLR1编码一个包含DELLA结构域的蛋白,是GA信号的抑制子;GID2编码GA信号转导中的一个正向调控因子,GID2是SCFGID2复合体的一部分,该复合体能与磷酸化的SLR1结合,引起泛素化介导的SLR1蛋白的降解,使GA信号向下游传递[12-13]。因此,深入研究GA相关的株高突变体是一项非常重要的工作。
目前育种上利用的矮化基因主要是sd1及其等位基因,这种单一的遗传背景已经成为水稻新品种选育的瓶颈[14]。因此,挖掘和鉴定新的矮化基因,开展株高相关基因的定位、克隆和功能研究,阐明其遗传、分子及生理生化机制,对水稻育种和生产具有十分重要的指导意义。在本研究中,我们从日本晴(Nipponbare)T-DNA突变体库中筛选得到一个小粒矮秆突变体sgd1(t)[15],并对sgd1(t) 进行表型分析及基因定位,结合细胞学观察和激素响应,拟初步揭示引起sgd1(t) 矮化表型的遗传和分子机理。
1材料与方法
1.1材料
小粒矮秆突变体sgd1(t) 是在日本晴(Nipponbare)T-DNA突变体库中筛选得到的,经潮霉素检测,发现并不具备潮霉素抗性基因的表型,因此sgd1(t) 应是在组培过程中发生的变异,同时sgd1(t) 经江苏南京和海南三亚多代自交繁殖,其突变特征及各方面农艺性状均已稳定。
1.2遗传分析及定位群体的构建
2011年8月,在南京实验基地将sgd1(t) 与Pusher、NJ-11、Dular配制3个杂交组合用于定位,同时配制sgd1(t) /日本晴和日本晴/sgd1(t) 正反交组合用于遗传分析,按单株收获F1种子,经海南南繁获得F2种子。2012年7月,在南京土桥实验基地单株种植各亲本和F2群体;在成熟期,对F2群体中株高正常的植株和矮秆植株,进行株数调查统计用于遗传分析。选用后代高矮分离相对明显的sgd1(t) /Dular的F2群体用于定位,鉴定并选取其中具有小粒矮化表型的约2500个极端单株用于初定位及精细定位,同时筛选群体中分子标记为杂合型的单株,最终按单株收取极端单株及杂合型单株的种子。
1.3农艺性状调查
抽穗期以播种至抽穗的天数来表示。在水稻抽穗期考查小粒矮秆突变体sgd1(t)和野生型日本晴的多项重要形态指标,包括株高、单株分蘖数、穗长、每穗粒数、粒长、粒宽、粒厚、千粒重、节间长度等。
1.4茎秆、颖壳的细胞学扫描电镜观察
分别取成熟期sgd1(t) 和日本晴的最上节间和种子;FAA固定液固定样品2 h以上,70%、80%、90%、100%乙醇梯度脱水,每级5 min,脱水剂体积高于材料的3倍;置于烘箱,临界点干燥;将样品用导电胶固定于铜台上,并将样品调整至适合观察的位置;样品喷金,扫描电镜观察。
1.5GA处理实验
采用何祖华等[16]的方法进行实验,略作改动。
1)将sgd1(t) 和日本晴种子用1%的次氯酸钠溶液浸种1 h,用无菌水清洗3次,然后将种子浸入水中24 h,黑暗条件下置于30℃培养箱生长1 d;
2)当种子露白时,挑选发芽一致的种子转移至含有梯度浓度的GA3溶液的1%琼脂培养基上,置于14 h光照/10 h黑暗、25℃的培养箱生长,并开始计时;
3)10 d后,测其第2叶鞘伸长长度。同时设置清水对照,每个梯度实验设置3个重复。
1.6色素含量的测定
sgd1(t) 和日本晴植株在抽穗后至成熟前,植株叶片颜色差异显著。随机取5片叶片,剪成长宽1 cm(0.02 g左右)片段后,称其实际重量,将其浸泡于5 mL的95%的乙醇溶液中,在室温黑暗条件下浸泡48 h。用分光光度计测量665 nm、649 nm和470 nm三个波长下溶液的光密度。根据Lichtenthaler等[17]对Arnon法进行修正后提出的计算公式:
Ca=13.95D665-6.88D649;
Cb=24.96D649-7.32D665;
Cx=(1000D470-2.05Ca-114Cb)/245。
求得各色素的浓度后,再依据:细胞色素含量(mg·g-1)=(叶绿素的浓度×提取液体积×稀释倍数)/样品鲜重,计算组织中各细胞色素的含量。sgd1(t) 和日本晴分别取3个植株进行测定。
1.7基因定位
利用已发表的分布于水稻12条染色体上的SSR序列,采用极端个体分组和隐性基因组分析法,取sgd1(t) /Pusher F2群体中10株极端个体构建两个隐性池,利用全基因组中在sgd1(t) 和Pusher间存在多态的标记进行连锁分析,找到与sgd1(t) 基因连锁的分子标记。根据基因初步的定位结果,在目标基因附近区域的BAC序列上继续设计分子标记,同时扩大定位群体对基因进行精细定位;并利用已公布的日本晴数据库中的序列信息,找到各标记所对应的BAC克隆,构建覆盖目的基因的物理图谱。
SSR标记的开发:利用日本水稻基因组研究计划(http://rgp.dna.affrc.go.jp/IRGSP/index.html)下载粳稻日本晴的第9染色体的BAC/PAC序列;将400~500 bp长的序列在NCBI上(http://www.ncbi.nlm.nih.gov/BLAST/Genome/plantBlast.shtml)与相应的93-11序列进行比对,如果两者的SSR重复次数有差异,利用Primer Premier 5.0软件设计合成SSR引物。
Indel标记的开发:利用NCBI的BLAST程序将相应区段粳稻日本晴基因组的克隆序列与籼稻93-11基因组的克隆序列进行比对(http://www.ncbi.nlm.nih.gov/BLAST),据此发现插入/缺失(insertion/deletion,InDel)序列差异(选择标准:100~200 bp之间大小的片段有3 bp以上的差异)。然后利用Primer Premier 5.0引物设计软件在其两侧设计引物。研究设计并用于精细定位的多态性SSR及InDel引物见表2。
2结果与分析
2.1突变体sgd1(t) 表型分析
由图1-A和表1可以看出,突变体sgd1(t) 表现出明显的矮化,其中野生型日本晴的株高为106.79±9.90 cm,而sgd1(t) 的株高为36.64±3.01 cm,只有野生型的31.82%。sgd1(t) 植株5个节间和日本晴相比,都明显缩短,但缩短比例各不相同,倒1、2、3、4、5节间分别为野生型的32.1%、43.0%、44.4%、69.9%和50.0%(图1-C,D)。除了植株矮化外,sgd1(t) 还表现出多分蘖的特征(图1-A,表1),抽穗期延迟了10 d左右。此外,sgd1(t) 颖壳表皮粗糙、厚实,粒长、粒宽、粒厚、千粒重及每穗粒数均显著下降(表1)。
sgd1(t) 的叶片深绿,叶绿素含量测定表明,Chl a/b比值与野生型相比没有明显差异,但sgd1(t) 的色素含量明显高于野生型(图2)。
2.2sgd1(t) 茎秆及颖壳切面细胞学形态观察
将茎秆进行纵切后观察,日本晴节间分生区细胞呈规则的长方形,排列整齐,形成纵向细胞列(图3-A);sgd1(t)植株中,未伸长茎节的细胞呈方形甚至圆形,排列散乱,不能形成正常细胞列,在纵向上不能正常伸长(图3-B)。表明sgd1(t)节间细胞不伸长是其节间未伸长的主要原因。
从外向内,日本晴的横切面由厚壁细胞、维管束及薄壁细胞组成;维管束整齐均匀地分布在薄壁细胞之间(图3-C,E)。而在sgd1(t) 植株中,茎秆的横切面结构显示,茎秆的薄壁细胞较野生型小,且发育不成熟,但细胞层数有所增加。sgd1(t) 茎秆的维管束发育不正常,未能形成正常的中空结构,且散乱地分布在薄壁细胞之间。这说明sgd1(t) 茎秆维管束的发育受到了影响(图3-D,F)。
表1日本晴和sgd1(t) 的主要农艺性状比较
Table 1. Comparison of agronomic traits between Nipponbare and sgd1(t) .

农艺性状Agronomictraits日本晴Nipponbaresgd1(t)株高Plantheight/cm106.79±9.9036.64±3.01**单株分蘖数Tillernumberperplant19.6±3.4422.0±4.96**粒长Grainlength/mm 7.81±0.385.42±0.30**粒宽Grainwidth/mm 3.21±0.152.37±0.45**粒厚Grainthickness/mm 2.17±0.111.13±0.25**千粒重1000-grainweight/g25.58±1.3418.21±1.51**每穗粒数No.ofgrainsperpanicle114.50±20.1730.62±6.10**
数据表示为平均值±标准差 (n=10);**表示经t-测验在 0.01 水平上差异显著。
Data are the mean±SD(n=10);**, Significant atP<0.01 byt-test.

A-日本晴和sgd1(t) 在成熟期植株形态比较,标尺30 cm; B-日本晴和sgd1(t) 稻谷及糙米表型(n=5),标尺5 mm; C,D-穗及各节间长度模型。 P,Ⅰ,Ⅱ, Ⅲ, Ⅳ, Ⅴ分别代表稻穗,倒1、2、3、4、5节间(n=10)。
A, Gross morphology of Nipponbare andsgd1(t) at the mature stage, bar=30 cm; B, Morphology of seed and brown rice of Nipponbare andsgd1(t) (n=5),bar=5 mm; C and D, Diagram of the length of the panicles and internodes (n=10). P,Ⅰ,Ⅱ, Ⅲ, Ⅳ, Ⅴ indicate the panicle and the five upper internodes, respectively.
图1日本晴和sgd1(t) 性状比较
Fig. 1. Morphological characterization of Nipponbare and sgd1(t).
通过电镜扫描可以观察到,日本晴颖壳表皮细胞呈圆形、排列整齐、细胞间隙均匀有规律,而突变体sgd1(t) 表皮细胞排列紧密、呈不规则状、细胞形状发生改变,导致整体细胞呈现小突起状(图4-A,B);同时对颖壳中部进行横切面扫描,结果显示日本晴横切面细胞能够均衡地分布在表皮细胞之下,而突变体sgd1(t)横切面细胞不规则,细胞形态发生变化,有大有小,从而导致细胞间填充物散乱(图4-C,D)。
2.3sgd1(t) 对GA的敏感性
根据对外源GA的反应,与GA相关的矮化突变可分为GA缺陷型突变和GA钝感型突变[18],GA缺陷型突变指GA代谢途径受阻导致内源GA含量降低甚至缺乏[19],外施GA能恢复野生型表型;GA钝感型突变指由于GA信号传导受阻导致对GA响应的改变[20],外施GA不能恢复到野生型表型。由图5可以看出,不同浓度GA3处理野生型和sgd1(t)发现,两者第2叶鞘都明显伸长,说明sgd1(t) 对GA敏感,低浓度能使其恢复部分表型;GA3浓度为10-4mol/L,sgd1(t) 基本上能和野生型达到同一高度,证实了sgd1(t) 的GA信号转导途径正常,外施GA能够得到响应(图 5)。

A-叶片颜色;B-色素含量水平(n=3)。 Chl a-叶绿素a; Chl b-叶绿素b; β-carotenoids-类胡萝卜素; Chl a/b-叶绿素a与叶绿素b的比值; Chl a+b-叶绿素a与叶绿素b之和。
A, Leave color; B, Pigment contents (n=3). Chl a, Chlorophyl a; Chl b, Chlorophyl b; Chl a/b, Ratio of chlorophyl a to chlorophyl b; Chl a+b, Sum of chlorophyl a and chlorophyl b.
图2日本晴和sgd1(t) 的叶片
Fig. 2. Leaves of Nipponbare and sgd1(t).

A、B茎秆纵切面,标尺100 μm; C、D 茎秆横切面,标尺1mm; E、F为C、D方框区域放大图,标尺100 μm; SC, 厚壁细胞; VB,维管束; PC, 薄壁细胞。
A and B, Longitudinal sections, bar=100 μm; C and D, Transverse sections, bar=1 mm; E and F, Magnifications of indicated regions in C and D, bar=100 μm. SC, Sclerenchyma cells; VB, Vascular bundle; PC, Parenchyma cells.
图3日本晴和sgd1(t)的茎秆切面电镜扫描
Fig. 3. Electronic microscopy analysis of culm cells of Nipponbare and sgd1(t).

A,B分别为野生型和突变体的颖壳表皮细胞,标尺200 μm; C,D分别为野生型和突变体中部颖壳横切面细胞,标尺50 μm。
A and B, Epidermis cells, bar=200 μm; C and D,Transverse sections, bar=50 μm.
图4日本晴和sgd1(t) 的颖壳电镜扫描
Fig. 4. Electronic microscopy analysis of the glume cells of Nipponbare and sgd1(t).
2.4 sgd1(t) 的遗传分析

2.5 sgd1(t) 基因的定位
利用sgd1(t) /Dular F2群体56个极端单株进行连锁分析,将其中的10个等量提取DNA构成混池,发现在第9染色体上SSR标记RM444和RM524与矮秆基因连锁,在此位置附近用其他引物对F2群体极端个体进行验证,发现Indel标记D28和BC3也与矮秆基因连锁,初步将基因定位在Indel标记C3和SSR标记RM219之间,遗传距离为20.7 cM。
在初定位的基础上开发标记,最终将矮秆基因定位在第9染色体短臂末端Indel标记DF26和DF13之间,物理距离为230 kb(图7-A,表2)。使用Rice Genome Annotation Project网站(http://rice.plantbiology.msu.edu/)预测该定位区间内的基因,在该区段内有一个已报道的矮秆基因GDD1(LOC_Os09g02650)[21]。GDD1是一种具有转录调控活性的驱动蛋白,可以通过调控水稻中GA的合成来调节细胞的伸长,与之前报道的脆秆基因BC12[22]等位。鉴于此,将BC12/GDD1确定为候选基因。使用DNAStar软件将测序结果与从NCBI(http://www.ncbi.nlm.nih.gov/)查到的BC12/GDD1的基因序列比对分析,发现突变体的BC12/GDD1基因在第4个外显子发生单碱基突变,由G变为T(图7-B),导致第186位甘氨酸突变为缬氨酸。
图 5GA3处理野生型和sgd1(t) 的幼苗表型(A)及第2叶鞘长度(B)(n=3)
Fig. 5. Seeding phenotype(A) and length of second leaf sheath(B) with GA3treatment between wild type and sgd1(t) (n=3).

图 6sgd1(t) 与Dular杂交F2群体株高分离频率
Fig. 6. Distribution of plant height in F2population derived from sgd1(t) /Dular.
3讨论
根据水稻前4到5个节间的伸长模式将矮化突变体分为五种,即“dn”穗及以下节间均缩短、“dm”倒1节缩短、“d6”穗颈节以下节间缩短、“nl”上部节间比下部节间显著缩短和“sh”穗颈节缩短[23]。相对于野生型,sgd1(t) 穗及各节间均有不同程度的缩短,因此属于“dn”型。
通过图位克隆方法将突变基因sgd1(t) 定位到水稻第9染色体Indel标记DF26和DF13之间约230 kb区域。Zhang等[21]和Li等[22]在该区域克隆了矮秆基因BC12/GDD1,该基因编码一个kinesin-4亚家族的驱动蛋白,参与调控细胞周期进程、纤维素微丝的排布及细胞壁的组成,通过调控GA生物合成途径来介导细胞伸长。表型比较发现,BC12/GDD1突变体bc12、gdd1与sgd1(t) 在植株表型上相似度很高,都表现为株高降低,穗及各节间长度显著缩短。测序结果显示,sgd1(t) 在该基因第4个外显子处发生单碱基突变,导致保守氨基酸的改变。由此,我们推定sgd1(t) 编码基因与BC12/GDD1等位。
对比基因突变位点可以发现,bc12在基因第4个外显子处发生26 bp的缺失,引起移码突变;gdd1在基因第19和20个外显子之间发生27 bp缺失,阻断mRNA的剪切,而sgd1(t) 在该基因第4个外显子处发生单碱基由G到T的突变,使甘氨酸突变为缬氨酸。因此,sgd1(t) 与bc12及gdd1在突变位点及方式上存在差异。kinesin-4亚家族蛋白含有三个高度保守的结构域:N端驱动蛋白结构域、螺旋卷曲结构域和C端球形结构域[24]。在BC12/GDD1中也存在一个基于微管且依赖ATP酶的驱动蛋白结构域,包含第1到405个氨基酸,其中第186位甘氨酸在动植物中高度保守(图7-C)。但在sgd1(t) 中,第186位甘氨酸突变为缬氨酸,可能影响了这个驱动蛋白结构域的构象,从而不利于该蛋白对微管的结合及移动,进而导致微管排布异常,纤维素微丝异常沉积,细胞形态发生改变。这与AtKRP125c突变引起皮层微管组织混乱和细胞形状异常的情况类似[25]。但sgd1(t) 仅仅是单碱基替换,突变基因仍具有部分功能,因此可能未产生类似bc12/gdd1的脆秆表型。
表 2用于精细定位的多态性Indel引物
Table 2. Indel markers designed for fine-mapping.

标记Marker正向引物序列(5'-3')Sequenceofforwardprimer(5'-3')反向引物序列(5'-3')Sequenceofreverseprimer(5'-3')D28CATATCAACTAGCCCTACCGGTCCATTATTGGCGTCCCDF16CAGATGGAGGTTACTCTGCTTCGTAGTCAATGTGCCACCAGTAGGGDF26ATGGAATTAACCGTGGCTGCTTTGGCCTCCATCAGDF13TATTGCACCTGCCTATTCGTTGATGCCACCATCCTCTTDF12TCTCATAAGCCCAAATCGTTAGTAGTCGTCGGCGTCATDF15ATCAGGGCATTCACCTCCGTAGCACCCCACAGCTCAAABC3TGATAGTGCAACGGCAAGGGTGGAGTTGTCAGCAGTGG
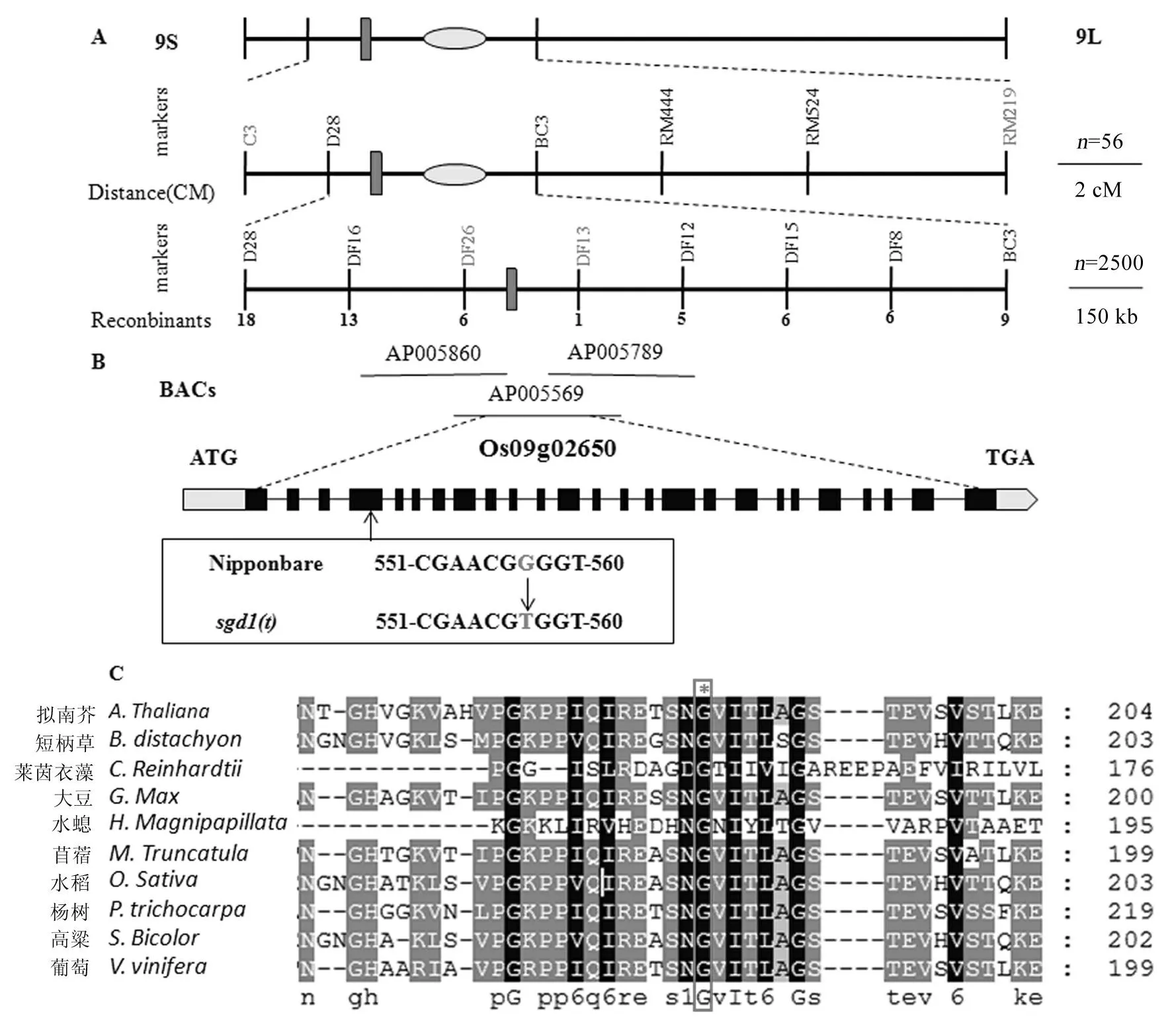
A-sgd1(t) 的物理图谱; B-sgd1(t) 的突变位点; C-BC12/GDD1蛋白同源序列比对。
A, Physical mapping ofsgd1(t); B, Mutation site ofsgd1(t); C, Comparison of amino acid sequences of BC12/GDD1.
图 7sgd1(t) 的图位克隆
Fig. 7. Map-based cloning of sgd1(t).
目前,克隆的水稻矮秆基因大多数来自粳稻,但这些矮秆材料农艺性状较差,难以在育种中直接利用,而一些矮秆的弱等位基因突变体不良性状相对缓和,在株型塑造上存在应用价值。本研究鉴定的小粒矮秆突变体sgd1(t) 是已报道的矮秆基因BC12/GDD1的复等位基因,株高降低,但茎秆机械强度没有下降。因此,这对于培育高产、抗倒伏的水稻品种具有积极的意义。
参考文献:
[1]Peng J,Richards D E,Hartley N M,et al. ‘Green revolution’genes encode mutant gibberellin response modulators.Nature. 1999,400(6741):256-261.
[2]Itoh H,Ueguchi-Tanaka M,Sentoku N,et al. Cloning and functional analysis of two gibberellin 3 beta -hydroxylase genes that are differently expressed during the growth of rice.ProcNatlAcadSciUSA, 2001,98(15):8909-8914.
[3]Ueguchi-Tanaka M,Ashikari M,Nakajima M,et al.GIBBERELLININSENSITIVEDWARF1 encodes a soluble receptor for gibberellin.Nature, 2005,437(7059):693-698.
[4]Sasaki A,Ashikari M,Ueguchi-Tanaka M,et al. Green revolution:A mutant gibberellin-synthesis gene in rice.Nature, 2002,416(6882):701-702.
[5]Gomi K,Sasaki A,Itoh H,et al. GID2,an F-box subunit of the SCF E3 complex,specifically interacts with phosphorylated SLR1 protein and regulates the gibberellin-dependent degradation of SLR1 in rice.PlantJ, 2004, 37(4):626-634.
[6]Yamamuro C,Ihara Y,Wu X,et al. Loss of function of a rice brassinosteroid insensitive1 homolog prevents internode elongation and bending of the lamina joint.PlantCell, 2000,12(9):1591-1606.
[7]Hong Z,Ueguchi-Tanaka M,Umemura K,et al. A rice brassinosteroid-deficient mutant,ebisudwarf(d2), is caused by a loss of function of a new member of cytochrome P450.PlantCell, 2003,15(12):2900-2910.
[8]Li H,Jiang L,Youn J H,et al. A comprehensive genetic study reveals a crucial role of CYP90D2/D2 in regulating plant architecture in rice (Oryzasativa).NewPhytol, 2013,200(4):1076-1088.
[9]Arite T,Iwata H,Ohshima K,et al. DWARF10,an RMS1/MAX4/DAD1 ortholog,controls lateral bud outgrowth in rice.PlantJ, 2007,51(6):1019-1029.
[10]Arite T,Umehara M,Ishikawa S,et al.d14, a strigolactone-insensitive mutant of rice,shows an accelerated outgrowth of tillers.PlantCellPhysiol, 2009,50(8):1416-1424.
[11]Zhou F,Lin Q,Zhu L,et al. D14-SCFD3-dependent degradation of D53 regulates strigolactone signalling.Nature, 2013,504(7480):406-410.
[12]Sasaki A,Itoh H,Gomi K,et al. Accumulation of phosphorylated repressor for gibberellin signaling in an F-box mutant.Science, 2003,299(5614):1896-1898.
[13]Hirano K,Asano K,Tsuji H,et al. Characterization of the molecular mechanism underlying gibberellin perception complex formation in rice.PlantCell, 2010,22(8):2680-2696.
[14]黄耀祥. 半矮秆、早长根深、超高产、特优质中国超级稻生态育种工程. 广东农业科学, 2001,3(3): 2-6.
Huang Y X. Ecological breeding engineering for maximum yield,super high quality of China super-rice with semi-dwarf and early growth and deep root.GuangdongAgricSci, 2001, 3(3):2-6. (in Chinese with English abstract)
[15]陈韦韦. 水稻小粒矮秆突变体sgd1(t)的表型分析及基因精细定位. 南京:南京农业大学,2011.
Chen W W. Phenotype analysis and gene fine mapping ofsgd1(t),a small-grain dwarfness mutant in rice (OryzaSativaL.). Nanjing: Nanjing Agricultural University,2011. (in Chinese with English abstract)
[16]何祖华,Etohkossi,石春海,等. 水稻株高基因对GA3敏感性及与酶的关系. 中国水稻科学. 1993,7(3): 143-147.
He Z H,Etohkossi,Shi C H,et al. Sensitivity of plant height genes to GA3and their relationship with enzymes in rice.ChinJRiceSci,1993,7(3):189-196. (in Chinese with English abstract)
[17]Lichtenthaler H K. Chlorophylls and carotenoids:Pigments of photosynthetic biomembranes.MethodsEnzymol,Academic Press,1987,350-382.
[18]Mitsunaga S, Tashiro T, Yamaguchi J. Identification and characterization of gibberellin-insensitive mutants selected from among dwarf mutants of rice.TheorApplGenet, 1994,87(6):705-712.
[19]Hedden P, Phillips A L. Gibberellin metabolism:New insights revealed by the genes.TrendsPlantSci, 2000,5(12):523-530.
[20]Gomi K,Matsuoka M. Gibberellin signalling pathway.CurrOpinPlantBio, 2003,6(5):489-493.
[21]Li J,Jiang J,Qian Q,et al. Mutation of rice BC12/GDD1,which encodes a kinesin-like protein that binds to a GA biosynthesis gene promoter,leads to dwarfism with impaired cell elongation.PlantCell, 2011,23(2): 628-640.
[22]Zhang M,Zhang B,Qian Q,et al. Brittle Culm 12,a dual-targeting kinesin-4 protein,controls cell-cycle progression and wall properties in rice.PlantJ, 2010,63(2):312-328.
[23]马良勇,包劲松,李西明,等. 水稻矮生基因的克隆和功能研究进展. 中国水稻科学, 2009,23(1): 1-11.
Ma L Y,Bao J S,Li X M,et al. Progress on cloning and functional analysis of dwarfism related genes in rice.ChinJRiceSci, 2009,23(1):1-11. (in Chinese with English abstract)
[24]Mazumdar M,Misteli T. Chromokinesins:Multitalented players in mitosis.TrendsCellBiol, 2005,15(7): 349-355.
[25]Bannigan A,Scheible W,Lukowitz W,et al. A conserved role for kinesin-5 in plant mitosis.JCellSci, 2007, 120:2819-2827.
Phenotyping and Gene Cloning of a Small-grain Dwarf Mutantsgd1(t) in Rice
WANG Peng, CAI Yue, CHEN Wei-wei, MA Jing, CHEN Xin-gang, TANG Xiao-jie, YOU Xiao-man, KONG Fei, ZHANG Jie, YAN Hai-gang, WANG Guo-xiang, JIANG Ling, ZHANG Wen-wei*, WAN Jian-min
(StateKeyLaboratoryofCropGeneticsandGermplasmEnhancement,NanjingAgriculturalUniversity/TheYangtzeRiverValleyHybridRiceCollaborationInnovationCenter/KeyLaboratoryofBiology,GeneticsandBreedingofjaponicaRiceinMid-lowerYangtzeRiver,MinistryofAgriculture,Nanjing210095,China;*Corresponding author, E-mail: zhangww@njau.edu.cn)
WANG Peng, CAI Yue, CHEN Weiwei, et al. Phenotyping and gene cloning of a small-grain dwarf mutantsgd1(t) in rice. Chin J Rice Sci, 2016, 30(1): 1-9.
Abstract:A small-grain dwarf mutant, designated as sgd1(t) , was identified from the T-DNA insertion mutant lines of Nipponbare.The mutant,genetically stable,was characterized by dwarf plant, small grain, dark green leaves and thick husk. Scanning electron microscope analysis on cell morphology of stem and hull revealed that stem cells in sgd1(t) failed to form normal cell column and vascular bundles, while epidermal cells with irregular shape in hulls were tightly packed, resulting in confusion in cell arrangement, and sgd1(t) was a GA-sensitive dwarf mutant. Genetic analysis showed that this trait of dwarfism was controlled by a pair of recessive nuclear gene. Through map-based cloning, the gene sgd1 (t) was mapped in an interval of 230 kb between the markers DF13 and DF26 on the short arm of chromosome 9. There was a dwarf gene BC12/GDD1 in this region. Sequence analysis showed that sgd1(t) had a single-base substitution (G to T) in the fourth exon of the gene, resulting in the replacement of glycine by valine in 186th conservative amino acid.
Key words:rice (Oryza sativa L.); small grain and dwarfism; gene cloning; BC12/GDD1; single-base substitution
文章编号:1001-7216(2016)01-0001-09
中图分类号:Q343.5; Q785
文献标识码:A
基金项目:国家科技支撑计划资助项目(2011BAD35B02-02); 生物种业能力提升计划资助项目([2012]1961); 江苏省自主创新课题资助项目[CX(12)1003]。
收稿日期:2015-01-29; 修改稿收到日期: 2015-05-09。

