不同养殖密度和换水频率对蚂蟥生长和内在品质影响的研究お
李蒙蒙 郭巧生 史红专 王嘉 戴道新 闫士猛 齐恒基 芦鑫 刘立涛


[摘要]采用生物量测定、3,5二硝基水杨酸比色法、对棕榈酸硝基苯酯(ρNPP)比色法、福林酚法等方法研究不同养殖密度和换水频率对蚂蟥生长、消化酶活性、生化指标和内在品质的影响。结果表明:蚂蟥的最终质量,特定生长率(SGR),增重率(WGR),淀粉酶,脂肪酶,蛋白酶活力,SOD,CAT,ALP酶活性与密度呈反比,与换水频率呈正比(P<005);换水频率与水中氨氮、亚硝酸盐和硫化氢呈负相关,与溶氧量呈正相关;养殖密度和换水频率对蚂蟥水分、总灰分、酸不溶性灰分、pH和抗凝血酶活性影响不显著。因此,每亩50万条为较适宜的养殖密度,每72 h 1次为较适宜的换水频率。
[关键词]蚂蟥;养殖密度;换水频率;生长;消化酶;抗逆酶
蚂蟥Whitmania pigra Whitman,又名宽体金线蛭,属于环节动物门黄蛭科动物[1],其干燥全体为中药材水蛭,是《中国药典》2015年版水蛭药材收载主要来源,具有破血通经,逐瘀消癥的功效[2]。由于市场对水蛭药材的巨大需求以及环境污染的日益加重,导致野生蚂蟥资源濒临枯竭。目前虽然蚂蟥室外人工养殖技术取得了初步成功,但仍存在许多诸如水温、光照等不可控因素,严重影响了产量和经济效益。近几年来有关蚂蟥适宜生长的温度、呼吸和消化等生理特性以及分子生物学都进行了相关研究 [38],但鲜见养殖密度和换水频率对蚂蟥生长影响的相关研究报道,本实验拟研究不同养殖密度和换水频率对蚂蟥生长和内在品质的影响,以期为蚂蟥室内养殖提供参考和依据。
1材料
蚂蟥由南京农业大学中药材研究所提供,经郭巧生教授鉴定为蚂蟥W pigra;螺蛳(采自南京前湖,野生)经郭巧生教授鉴定为梨形环棱螺Bellamya purificata Heude;曝气24 h的自来水。
电子天平(山海精密仪器厂)、5810R离心机(eppendorf)、756CRT紫外分光光度计(上海精密仪器有限公司)、FA1104分析天平(上海精科天平厂)、匀浆机(宁波新芝生物科技股份有限公司)、pH计(青岛昱昌科技有限公司)、FW100小型高速粉碎机(天津华鑫仪器厂)、KQ250B超声仪(昆山市超声仪器公司)、电热恒温鼓风干燥箱(上海精宏实验设备有限公司)、HHS型水浴锅(巩义市予华仪器有限责任公司)、MR210A溶氧测量仪(南京特安科贸有限公司)、YC07型水质分析仪(青岛昱昌科技有限公司)。
DNS试剂、ρNPP溶液、福林酚试剂、考马斯亮蓝G250、连苯三酚、324 mmol·L-1钼酸铵溶液、50 mmol·L-1对硝基苯磷酸二钠。
2方法
21实验设计实验在室内进行,容器为容积2 L的塑料瓶(瓶底面积133×10-2 m2,实际养殖用水1 L,水深12 cm),实验蚂蟥体重为(095±016) g。设5个养殖密度,分别为1(按照瓶底面积算,相当于5万条/亩),5,10,15,20条/瓶,分别标记为SD1,SD2,SD3,SD4,SD5组,每个处理重复10次,24 h换水1次。设置5个换水频率,分别为每隔12,24,48,72,96 h 换水1次,每次换水1 L,每瓶10条蚂蟥,每个处理重复10次,分别标记为H1,H2,H3,H4,H5组。实验期间其他管理方法相同,投喂经自来水暂养3 d后的新鲜螺蛳,实验时间40 d,期间保持室温(25±1) ℃。
22样品的采集和保存实验结束时,每个平行组随机取10条蚂蟥,将活蚂蟥于冰盘内解剖,取消化道,用预冷生理盐水冲洗,滤纸吸干表面水分,称重,冰浴中匀浆,用生理盐水稀释成含原浆20%的溶液,冷冻离心10 min(转速为1万r·min-1),取上清液为酶液,置于4 ℃冰箱中保存,并在24 h内测定完成。
每个平行组随机选取15条蚂蟥,在50 ℃条件下干燥24 h,粉碎后过40目筛,置于试剂瓶中干燥避光保存,用于测定内在品质。
23生长性能的测定分别在实验开始和结束时称量各瓶中蚂蟥的体重,计算出平均质量,由公式计算特定生长率(SGR)和增重率(WGR)。SGR=(lnWt-lnW0)/t×100%;WGR= (Wt-W0)/W0×100%,式中W0为实验开始时蚂蟥的平均质量(g),Wt为结束时蚂蟥的平均质量(g),t为实验天数(d)。
24消化酶活性的测定方法蛋白酶活性测定采用福林酚法[9]在37 ℃,pH分别为32,92时,每分钟水解干酪素产生1 μg酪氨酸定义为1个蛋白酶活力单位(U);淀粉酶的活力测定采用3,5二硝基水杨酸比色法[9]在37 ℃时,单位体积酶量,每分钟水解淀粉生成1 mg还原糖的产量为1个酶活力单位(U);脂肪酶活力测定采用对棕榈酸硝基苯酯(ρNPP)比色法[10]在37 ℃,pH 82时,每分钟催化释放1 μmol对硝基酚所需的酶量定义为一个酶活力单位(U)。
25超氧化物歧化酶、过氧化氢酶和碱性磷酸酶的活性测定方法SOD活性测定采用郑碧玉等[11]的方法,25 ℃下,1 mL反应液中每分钟抑制邻苯三酚自氧化速率达50%时的酶量定为1个活力单位(U)。CAT活性采用比色法测定[12],每分钟分解1 μmol的过氧化氢即为1个酶活力单位(U)。ALP活性测定参考芶琳等[13]的方法,30 ℃条件下,每分钟产生1 μmol的对硝基酚,为1个酶活力单位(U)。
组织匀浆液的蛋白含量以考马斯亮蓝比色法测定。
酶的比活力=酶活力/蛋白含量
26蚂蟥内在品质的测定方法参考《中国药典》[2]2015年版一部测定水蛭药材的水分、总灰分、酸不溶性灰分、pH、抗凝血酶活性。
27水体质量的测定每个处理组换水时测定水体质量。使用溶氧仪测定水中溶氧量;使用水质分析仪测定水中氨氮、亚硝酸盐和硫化氢的含量。
28数据分析采用Microsoft Excel 2013和SPSS 190(Oneway ANOVA,多重比较采用Duncan′s法)进行数据分析。
3结果与分析
31不同养殖密度和换水频率对蚂蟥生长性能的影响SD1特定生长率和增重率显著大于其他4组(P<005),SD2的特定生长率与SD3没有差异,与SD4和SD5相比有显著性差异(P<005)。换水频率与最终体重、特定生长率和增重率成反比,其中H5显著小于H1和H2(P<005),其他各组之间没有显著性差异,见表1。
32不同养殖密度和换水频率对蚂蟥消化酶活性的影响消化酶活性与密度基本成负相关。其中淀粉酶:SD1最高,与其他4组均有显著性差异(P<005),SD3,SD4和SD5之间没有显著性差异,但均与SD2有显著性差异(P<005);脂肪酶:除SD1和SD2,SD4和SD5之间无显著差异外,各组别之间均显著差异(P<005)。酸性蛋白酶:SD1,SD2,SD3组显著高于SD4和 SD5组(P<005),其他各组之间无显著性差异。碱性蛋白酶:SD1显著大于其他各组(P<005),其中SD2,SD3与SD4,SD5相比有显著性差异(P<005),见表2。消化酶活性与换水频率基本成正相关。其中淀粉酶:H1显著高于其他4组(P<005),其中H4,H5淀粉酶活性显著小于H2,H3(P<005);H1的脂肪酶活性和碱性蛋白酶活性显著高于其他各组(P<005);H5酸性蛋白酶活性显著小于H1,H2(P<005)。
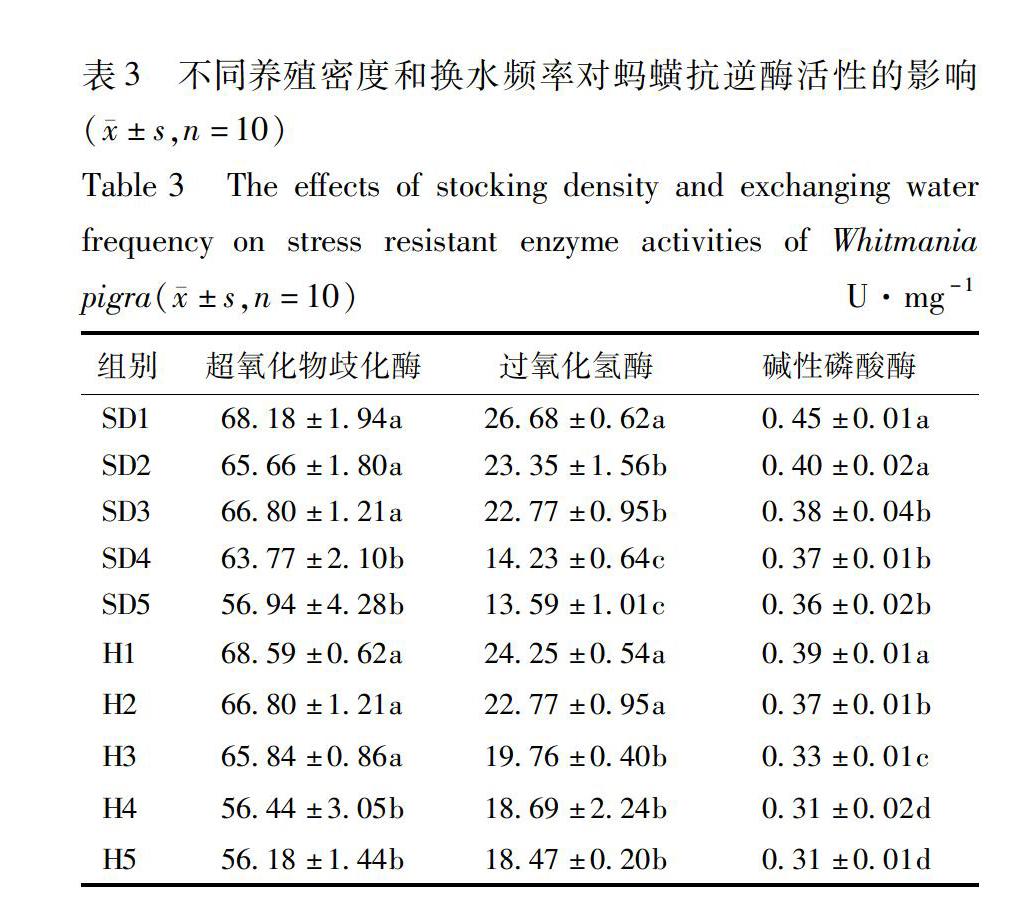
33不同养殖密度对蚂蟥抗逆酶活性的影响抗逆酶活性与密度基本成负相关。SD4,SD5的SOD活性,显著小于其他各组(P<005)。SD2,SD3的CAT活性显著小于SD1(P<005),显著大于SD4,SD5(P<005)。SD1,SD2的ALP活性显著高于其他各组(P<005),见表3。抗逆酶活性与换水频率基本成正相关。H4,H5组SOD活性显著小于其他各组(P<005);H1,H2组CAT显著高于其他各组(P<005);H1组ALP活性显著高于其他各组(P<005)。
34不同养殖密度和换水频率对水蛭内在品质的影响养殖密度和换水频率对水分、总灰分、酸不溶性灰分、pH和抗凝血酶活性影响不显著,见表4。
35不同换水频率对水体质量的影响换水频率与水中氨氮、亚硝酸盐和硫化氢呈负相关,与溶氧量呈正相关,各组之间呈显著性差异(P<005),见表5。
4讨论
41不同养殖密度对蚂蟥生长和消化酶活性的影响养殖密度是影响水生生物生长的一个重要因素[1415],研究发现随着养殖密度增大,群体内的竞争加剧,对个体摄食产生负面影响[16]。本研究结果显示,蚂蟥特定生长率与养殖密度成反比、与换水频率成正比,与孙学亮等[17]关于半滑舌鳎、张天时等[18]对中国对虾和肖鸣鹤等[19]关于克氏原螯虾的研究结果相似。在实验过程中发现,随着养殖密度的增加,蚂蟥种群间的个体差异度增大,Brett[20]认为这是由于种群内个体争夺有限的食物资源,使小个体不能够获得充足的食物,从而导致个体间的生长差异,此外高密度组蚂蟥由于组内个体之间竞争增大可能导致能量消耗增加,进而生长率下降。
Fendersen[21]等研究发现,高密度养殖会引起生物行为和生理变化,从而对养殖生物生长产生有害的影响。消化酶活性是衡量消化能力的重要指标[22],本实验结果显示密度与蚂蟥消化酶活性成反比,与肖鹤鸣等[19]的报道相似,因此可能高密度组蚂蟥组间个体竞争加剧导致消化酶活性降低从而使摄食量减少或消化不良,进而影响了生长。
42不同换水频率对蚂蟥生长、消化酶活性、水体质量的影响换水频率的增加能有效的增加水体中的氧含量,水体中溶解氧含量丰富会使氧化分解作用活跃,加速水中污染物的降解[23]。李健等[24]报道水体中氨氮、硫化氢等有害物质的含量与溶解氧有密切关系,水中溶氧量减小使NH4+N和NO2-N等积累 [2527]。吴垠等[28]发现水中溶氧量下降时虹鳟幼鱼生长下降,姚雪梅等[29]报道NO2-浓度大小与海参的生长呈负相关。本实验显示换水频率与水中溶氧量呈显著负相关,与氨氮、亚硝酸盐和硫化氢呈正相关,与以上实验结果相符合。虽然换水频率和水体质量的研究报道较多,但目前为止鲜见换水频率和消化酶的相关性研究,本实验显示换水频率与蚂蟥的SGR和消化酶呈正相关(P<005),推测换水频率在对水质造成影响的同时,抑制了蚂蟥消化酶活性,影响了蚂蟥的进食和消化,进而影响其生长。
43不同养殖密度和换水频率对蚂蟥抗逆酶活性的影响免疫系统被认为是一种帮助鱼类应对损伤的自适应和修复机制[30],过高的养殖密度会成为一种胁迫,影响鱼类的免疫系统和抗氧化能力[31]。活性氧通过影响细胞膜功能和酶活性使细胞加速老化和凋亡,活性氧增加时会诱导鱼类抗氧化酶分泌,包括SOD,CAT[3132],ALP在动物体内普遍存在,参与磷酸基团的代谢,也是溶酶体的组成部分,在免疫反应中具有重要作用[33]。本研究表明SOD,CAT和ALP随着养殖密度的增大和换水频率的减少呈现减小趋势,这与曹阳等[34]关于俄罗斯鲟幼鱼、彭士明等[35]关于银鲳鱼、吴宗凡等[36]关于鲫的报道相似,可能是蚂蟥在慢性胁迫过程中,蚂蟥免疫机制失调导致SOD,CAT,ALP活力降低,如王文博等[37]报道短期拥挤胁迫会使鲫鱼血液溶菌酶水平升高,长期胁迫则出现下降,至于短期胁迫对蚂蟥免疫机制的影响有待今后进一步研究。
44不同养殖密度和换水频率对蚂蟥内在品质的影响本研究的结果表明,养殖密度和换水频率对蚂蟥内在品质的影响都不显著,其中水分、总灰分、酸不溶性灰分含量都低于2015年版《中国药典》,说明杂质含量低。抗凝血酶活性均高于2015年版药典标准,表明所得水蛭品质优良。综上可知实验所得蚂蟥内在品质都能满足2015年版《中国药典》标准。
5小结
本实验结果显示密度为SD1时蚂蟥生长性能最高,但最终产量(413 kg/亩)小于SD3组(1 384 kg/亩),换水频率H4组对蚂蟥生长的影响与其他4组没有显著性差异,如果大规模养殖,从经济效益和成本控制来说,选择SD3密度、H4换水频率是最佳的组合。
[参考文献]
[1]杨潼.中国动物志·环节动物门蛭纲[M].北京:科学出版社,1996:136.
[2]中国药典.一部[S].2015:83.
[3]史红专,郭巧生,陆树松,等.不同月龄蚂蟥内在品质及最佳采收期研究[J].中国中药杂志,2009,34(23):3060.
[4]史红专,刘飞,郭巧生.温度对蚂蟥生长及摄食规律影响的初步研究[J].中国中药杂志,2006,31(23):1944.
[5]史红专,刘飞,郭巧生.温度和体重对蚂蟥人工繁殖影响的研究[J].中国中药杂志,2006,31(24):2030.
[6]史红专,郭巧生,朱再标,等.不同温度和pH对蚂蟥消化道酶活性影响的初步研究[J].中国中药杂志,2012,37(17):2538.
[7]Liu F,Shi H Z,Guo Q S,et al.Isolation and characterization of microsatellite loci for the analysis of genetic diversity in Whitmania pigra[J].Biochem Syst Ecol, 2013, 51:7
[8]Liu F, Guo Q S, Shi H Z, et al Genetic diversity and phylogenetic relationships among and within populations of Whitmania pigra and Hirudo nipponica based on ISSR and SRAP markers[J] Biochem Syst Ecol, 2013, 51(4):215
[9]胡琼英,汪瑾.生物化学与分子生物学实验[M].2版.北京:化学工业出版社,2010:28.
[10]郑小梅.脂肪酶产生菌的筛选及其脂肪酶基因的克隆[D].北京:中国农业科学院,2009.
[11]郑碧玉.改良的连苯三酚自氧化测定超氧化物歧化酶活性的方法[J] 生物化学与生物物理进展,1991,18(2):163.
[12]桂远明.水产养殖学专业实验实习教材水产动物机能学实验[M].北京:中国农业出版社,2004:124.
[13]芶琳,单志.生物化学实验[M] 成都:西南交通大学出版社,2010:103.
[14]Papoutsoglou S E, PapaparaskevaPapoutsoglou E, Alexis M N Effect of density on growth rate and production of rainbow trout (Salmo gairdneri Rich) over a full rearing period [J]. Aquaculture, 1987, 66:9
[15]Holm J C, Refstie T, BS The effect of fish density and feeding regimes on individual growth rate and mortality in rainbow trout (Oncorhynchus mykiss) [J] Aquaculture, 1990, 89:225
[16]Sawcer S J, Maranian M, Singlehurst S, et al Enhancing linkage analysis of complex disorders:an evaluation of highdensity genotyping [J] Hum Moecul Genet, 2004, 13(7): 1943
[17]孙学亮,杨树元,陈成勋,等.不同密度对半滑舌鳎生长和血液生化指标的影响[J].东北农业大学学报,2012,43(6):100.
[18]张天时,孔杰,刘萍,等.饵料和养殖密度对中国对虾幼虾生长及存活率的影响[J]. 海洋水产研究,2008,29(3):41.
[19]肖鸣鹤,肖英平,吴志强,等.养殖密度对克氏原螯虾幼虾生长、消化酶活力和生理生化指标的影响[J].水产学报,2012(7):1088.
[20]Brett J R Environmental factors and Growth [M]//Hoar W S, Randall D J, Brett J R Fish physiology Vol Ⅷ. Bioenergetics and growth New York: Academic Press, 1979:599
[21]Fendersen O C , Carpenter M R Effect of crowding on the behavior of juvenile hatchery and wild land locked Atlantic salmon (Salmo solar L)[J] Animal Behavior, 1971, 19:439
[22]Martinez I, Moyano F J, FernandezDiaz, C, et al Digestive enzyme activity during larval development of the Senegal sole (Solea senegalensis) [J] Fish Physiol Biochem, 1999, 21: 317
[23]何本茂,韦蔓新 北海湾水体自净能力的探讨[J] 海洋环境科学,2004(1):16
[24]李健,孙修涛,赵法箴.水温和溶解氧含量对中国对虾摄食影响的观察[J] 水产学报,1993(4):333
[25]贾治超,于刚,秦传新,等.微生态制剂对仿刺参室内育苗中换水频次的影响[J] 水产科学,2015,34(1):20
[26]李玉全,李健,王清印,等.溶解氧含量和养殖密度对中国对虾生长的影响[J].中国水产科学,2005,12(6):751.
[27]沈南南,李纯厚,贾晓平,等.小球藻与芽孢杆菌对对虾养殖水质调控作用的研究[J].海洋水产研究,2008,29(2):48.
[28]吴垠,张洪,赵慧慧,等.在循环养殖系统中不同溶氧量对虹鳟幼鱼代谢水平的影响[J].上海水产大学学报,2007(5):437.
[29]姚雪梅,王红勇,邢少雷,等.不同水温和水质理化因子对糙海参摄食、生长影响研究[J].水产科学,2007(5):292.
[30]Tim J B, Kim D T, Alison L M, et al Seasonal variation and the immune response: a fish perspective[J] Fish Shellfish Immunol, 2007, 22: 695
[31]Hegazi M M, Attia Z I, Ashour O A Oxidative stress and antioxidant enzymes in liver and white muscle of Nile tilapia juveniles in chronic ammonia exposure [J] Aquat Toxicoly, 2010, 99(2): 118
[32]Basha P S, Rani A U Cadmiuminduced antioxidant defense mechanism in freshwater teleost Oreochromis mossambicus (Tilapia) [J] Ecotox Environ Safe, 2003, 56:218
[33]Zhang R Q, Chen Q X, Xiao R, et al.Inhibition kinetics of green crab (Scylla serrata) alkaline phosphatase by zinc ions: a new type of complexing inhibition[J] Biochim Biophys Acta Protein Struct Mol Enzymol, 2001, 1545:6
[34]曹阳,李二超,陈立侨,等.养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响[J].水生生物学报,2014(5):968
[35]彭士明,施兆鸿,孙鹏,等.养殖密度对银鲳幼鱼生长及组织生化指标的影响[J].生态学杂志,2010,29(7):1371
[36]吴宗凡,时旭,程果锋,等.养殖密度对温室湿地循环水系统中鲫生长、生理及免疫指标的影响[J].南方水产科学,2014(5):39
[37]王文博,汪建国,李爱华,等.拥挤胁迫后鲫鱼血液皮质醇和溶菌酶水平的变化及对病原的敏感性[J] 中国水产科学,2004(5):408
[责任编辑吕冬梅]

