创建酿酒酵母细胞工厂发酵生产羽扇豆醇お
林庭庭 王冬 戴住波 张学礼 黄璐琦

[摘要]羽扇豆醇、桦木酸等羽扇豆型三萜化合物具有抗HIV、抗肿瘤等多种生物学活性,其中羽扇豆醇为这类化合物的基本前体。为了实现羽扇豆烷型三萜的异源发酵法生产,研究首先运用高通量同源重组法在酿酒酵母中进行萜类甲羟戊酸(MVA)途径的一步法调控,以提高三萜通用前体鲨烯的供给;在进一步工作中,拟南芥来源的羽扇豆醇合成酶基因(AtLUP)被整入三萜底盘菌株中实现羽扇豆醇酵母人工细胞工厂的创建。结果表明该实验能一次完成MVA途径的7个基因的整合,组装总长度达到20kb,同时多倍化MVA途径能显著提高鲨烯产量约500倍,达到35400 mg·L-1;AtLUP基因在染色体上整合后获得的工程菌NK2LUP在摇瓶中发酵能生产823 mg·L-1羽扇豆醇。该研究可为在酵母中实施大规模生物合成途径组装提供技术支持,同时为进一步获高产羽扇豆烷型三萜的人工酵母细胞提供了重要基础。
[关键词]三萜;羽扇豆醇;合成生物学;酿酒酵母
羽扇豆烷型(lupanetype)三萜是一类药用植物中微量合成的五环三萜类次生代谢物,主要包括羽扇豆醇(lupeol)、桦木酸(betulinic acid)和相应的衍生物[1]。其中,羽扇豆醇是这类化合物生物合成的基本前体物质。在植物细胞中,它可以在P450氧化酶的催化作用下发生C28位氧化,依次转化成桦木醇、桦木醛并最终氧化成桦木酸[24]。1995年Pisha等[5]发现了桦木酸具有较高选择性的抗黑色素瘤活性后,其出色的抗HIV活性也被人们发现[67]。目前,桦木酸和桦木酸衍生物Bevirimat已作为抗黑色素瘤药物或抗HIV的候选药物进入临床研究阶段[8],然而,桦木酸在桦木中的含量只有0025%[9],新的资源途径迫切需要解决。
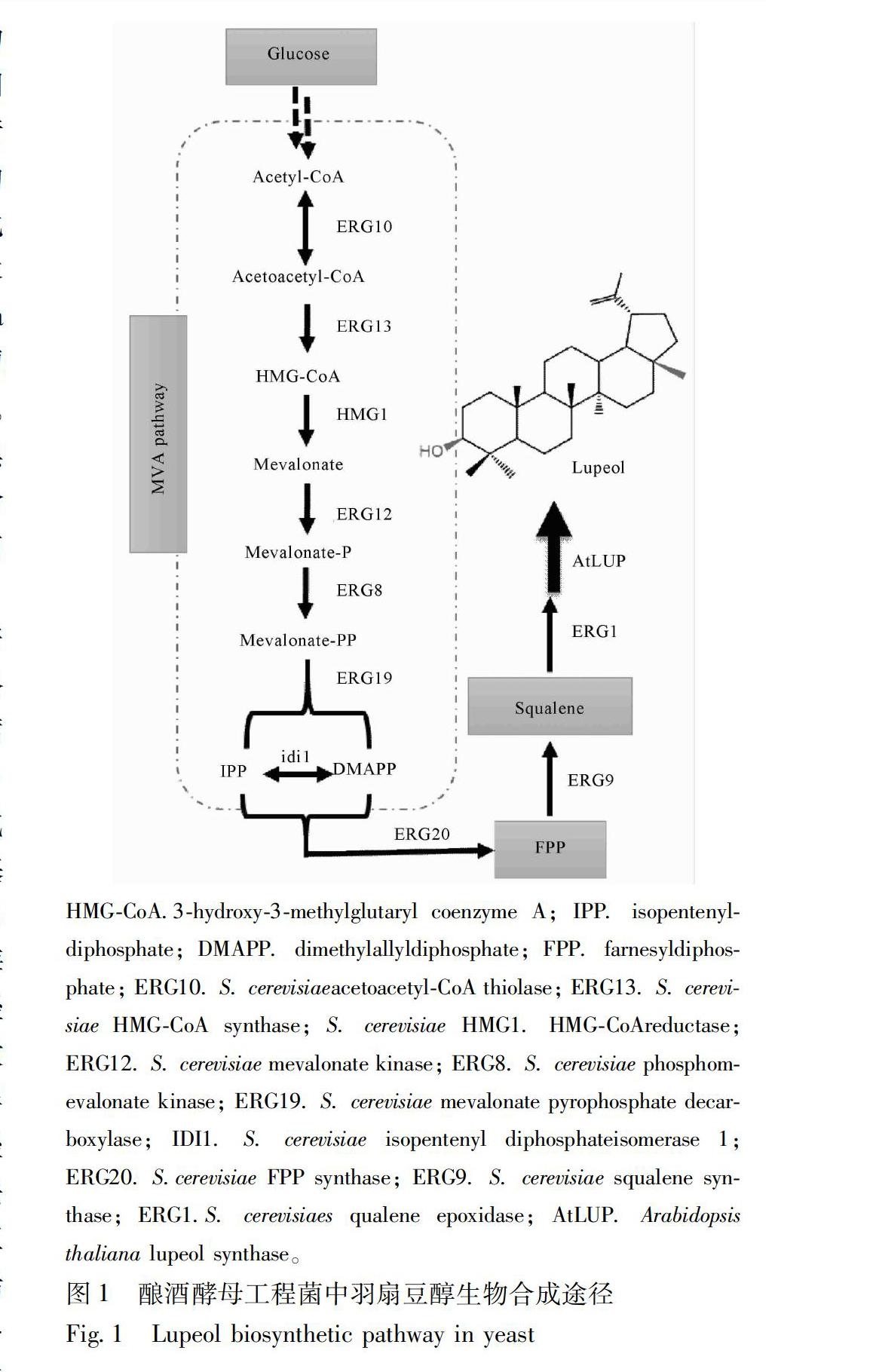
酿酒酵母Saccharomyces cerevisiae是一种生物安全的模式真核生物,其遗传背景清晰,遗传改造策略及发酵方法成熟,已被广泛应用于构建生产青蒿素[10],人参皂苷[1112],番茄红素[13]和β胡萝卜素[14]等天然萜类活性物质的底盘工程菌株。异戊烯焦磷酸(IPP,isopentenyl pyrophosphate)和二甲基烯丙基焦磷酸(DMAPP,dimethylallyl pyrophosphate)为萜类生物合成的基本单元,自然界可经乙酰辅酶A乙酰基转移酶、羟甲基戊二酰辅酶A合酶、3羟基3甲基戊二酸单酰辅酶A还原酶、甲羟戊酸激酶、磷酸甲羟戊酸激酶、焦磷酸甲羟戊酸脱羧酶和异戊烯焦磷酸异构酶等7个酶组成的甲羟戊酸途径(MVA pathway)合成。IPP和DMAPP可依次在法呢基焦磷酸合成酶和鲨烯合酶的催化作用下合成三萜通用前体鲨烯(squalene)。在酿酒酵母中,鲨烯可以继续被鲨烯环氧酶氧化为环氧鲨烯(2,3oxidosqualene),继而可以被羊毛甾醇环合酶等酶催化生成羊毛甾醇(lanosterol)和麦角固醇(ergosterol)等物质。在其他物种中,环氧鲨烯也可以被不同类型的环氧鲨烯环化酶催化生成各种类型的三萜母核,如β香树脂,葫芦二烯醇和羽扇豆醇等[1],见图1。其中,羽扇豆醇能被桦木酸合成酶催化生成桦木酸[24]。
在本研究中,首先运用高通量同源重组法在酿酒酵母CENPK21D中进行萜类甲羟戊酸(MVA)全途径基因的一步法整合调控,实现多基因、超长度、高精度的基因组定点整合,获得鲨烯(三萜通用前体)含量显著提高的底盘菌;在此基础上,通过整合拟南芥Arabidopsis thaliana来源的羽扇豆醇合成
酶基因(AtLUP),构建出羽扇豆醇的生物合成途径,为构建高产羽扇豆烷型三萜酿酒酵母细胞工厂提供基础,同时为酵母中实现大规模生物合成途径精确组装提供技术支持。
1材料
11工具酶与试剂PrimeSTAR HS DNA聚合酶购自于大连宝生物工程公司;酵母基因组DNA提取试剂盒购自北京康为世纪有限公司;质粒小量快速提取试剂盒购自美国Axygen公司;氨苄青霉素、DNA清洁试剂盒与DNA回收试剂盒购自生工生物工程(上海)股份有限公司;酵母选择培养基购自北京泛基诺科技有限公司;羊毛甾醇、麦角固醇、鲨烯和羽扇豆醇对照品购自美国SigmaAldrich公司;其他试剂均为分析纯。
12质粒,菌株及引物本次研究所用的质粒,菌株及引物信息见表1,2。
13培养基LB培养基:1%蛋白胨,05%酵母粉,1%氯化钠,100 mg·L-1氨苄青霉素;SM[Ura]筛选培养基:08%酵母选择培养基(三缺,UraTrpHis),2%葡萄糖,001%Trp,001%His;SM[UraTrp]筛选培养基:08%酵母选择培养基(三缺,UraTrpHis),2%葡萄糖,001%His;YPD培养基:2%蛋白胨,1%酵母粉,2%葡萄糖。上述液体培养基加2%的Agar可配成相应的固体培养基。
2方法
21NK2SQ系列菌株的构建构建NK2SQ系列工程菌株所采用的方法为多片段同源重组,见图2,表3。首先,Group A中模板和引物的搭配方案,用PrimeSTAR HS高保真聚合酶扩增和割胶回收得到用于同源重组的各个片段。用YPD培养基活化CENPK21D(以下简称NK2)后将各个片段利用醋酸锂法转入感受态中[11],并用SMUra固体培养基筛选转化子。转化子再分别用SacIIPGK1/HMG1Asc,PacPDC1p/ERG12Asc,PacENO2p/IDI1Asc,PacPYK1p/ERG19Asc,PacpFBA/ERG13Asc,PacpTDH3/ERG8Asc ,SacIIpTEF1/ERG10Asc,SexAHMG1/PDC1pSexA1,SexA1ERG12/ENO2pSexA1,SexA1IDI1/PYK1pSexA1,SexA1ERG19/pFBASexA1,SexA1ERG13/pTDH3SexA1,SexA1ERG8/pTEF1SexA1等13对引物对途径进行PCR验证和测序验证,得到工程菌NK2SQ。同时在NK2菌株的GAL7位点整合URA3筛选标记,获得对照菌NK2SQCK,见表1。
22NK2LUP系列菌株的构建构建NK2LUP工程菌株所采用的方法与21相同,见图3,表3。首先,Group B中模板和引物的搭配方案,用PrimeSTAR HS高保真聚合酶扩增和割胶回收得到用于同源重组的各个片段。然后用SMUra培养基活化NK2SQ菌株并利用醋酸锂方法制备成感受态细胞,将各个片段转入感受态中[11],用SMUraTrp固体培养基筛选转化子。转化子用引物SacIIPGK1/LUPAsc进行PCR验证和测序验证后,得到工程菌NK2LUP,见表1。
23摇瓶发酵方法及产物提取方法挑取平板上的单克隆于相应液体培养基中,30 ℃,250 r·min-1。将种子液接种于含15 mL YPD培养基的100 mL的三角瓶中,30 ℃,250 r·min-1振荡培养6 d后,进行产物的提取。产物提取的方法如下:取2 mL的发酵液于破碎管中,13×103 r·min-1离心3min,去培养基,无菌水清洗后,加入适量玻璃珠(直径为05 mm)和05 mL丙酮,震荡破碎5 min,
超声破碎30 min,13×103 r·min-1离心3 min,取上清。重复处理第2次,合并上清。上清过022 μL有机尼龙滤膜后备用。
24鲨烯及羽扇豆醇的检测方法GCMS测定:进样口温度300 ℃,进样体积1 μL,不分流,溶剂延时12 min;色谱柱HP5 ms(025 mm×30 m);色谱条件为80 ℃,1 min;20 ℃·min-1到300 ℃保温18 min;MS条件为SIM 69,109,135,363,411;羊毛甾醇,麦角固醇、鲨烯和羽扇豆醇标准品用于定性和定量分析。
3结果与分析
31一步法完成多倍化MVA生物合成途径植物天然产物的生物合成涉及到多步酶促反应,如从倍半萜共同前体FPP开始合成青蒿素前体青蒿酸就需要6条功能基因参与[10];另外,紫杉醇和吗啡等化合物的酶反应步骤均超过10步[1516]。因此,在微生物细胞工厂构建过程中实现基因的高通量重组显的十分重要。在本研究中,尝试对由7个功能基因组成的MVA合成途径进行一步法组装:首先将MVA途径中的ERG10,ERG13,tHMG1,ERG12,ERG8,ERG19和IDI1 7个基因进行PCR克隆,并分别与相应的强启动子TEF1,FBA1,PGK1,PDC1,TDH3,PYK1,ENO2和终止子连接后,利用同源重组一次整合到NK2基因组的GAL7位点(URA3为筛选标记)。转化子经过缺陷培养基的筛选后,分别用相应的引物对整合途径进行PCR和测序验证后得到工程菌NK2SQ。PCR和测序结果显示,该方法可在酿酒酵母中一次性完成9个基因片段,约20 kb总基因长度的整合,见图2,4。
MTrans2K plus marker;左图泳道1~77个基因及相应的启动子的PCR产物条带;左图泳道8~13验证7个基因是否串联在一起的PCR产物条带;右图泳道1URA3 marker整合到NK2SQCK菌株PCR验证结果。
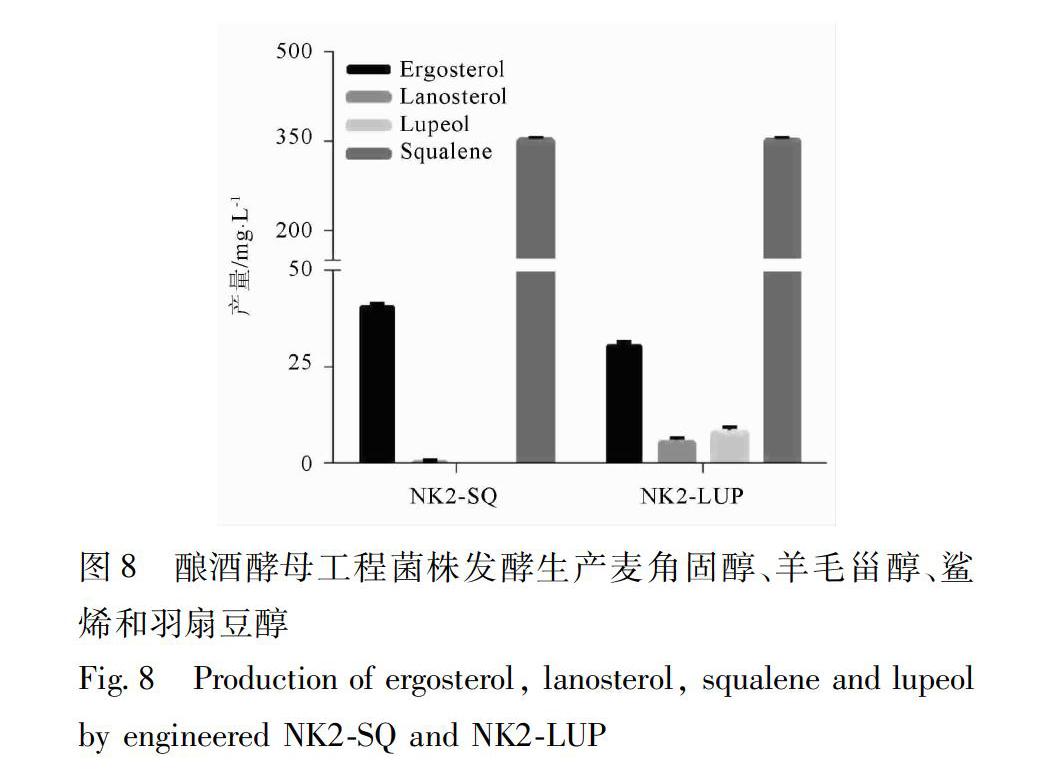
32MVA途径的优化对酿酒酵母萜类产量的影响MVA途径作为细胞中乙酰辅酶A转化为萜类化合物的第1个关键模块,其活性会直接影响到细胞中萜类产量[17]。经过对工程菌NK2SQ中鲨烯、羊毛甾醇和麦角固醇等萜类产量的分析发现:MVA途径的多倍化能显著提高菌株NK2SQ萜类的合成能力,其中三萜通用前体物质鲨烯的产量达到(35400±228)mg·L-1,较对照菌NK2SQCK提高了500倍,见图5。另外麦角固醇和羊毛甾醇等下游萜类含量变化不显著,可能是由于酿酒酵母内源的麦角固醇生物合成途径受到严格调控所致[18]。
33羽扇豆醇细胞工厂构建及产物分析鲨烯可在酵母内源的环氧鲨烯合酶催化下形成2,3环氧鲨烯,在酿酒酵母中引入拟南芥来源的羽扇豆醇合成酶可催化2,3环氧鲨烯环化形成羽扇豆醇[24]。首先,将通过密码子优化和全基因合成的AtLUP基因,与强启动子PGK1和终止子ADH1连接后,整合到三萜底盘菌株NK2SQ基因组的HIS3位点(TRP1为筛选标记),转化子经过缺陷培养基的筛选及PCR与测序验证后得到工程菌NK2LUP,见图
3,6。NK2LUP在YPD培养基中发酵6 d后,利用GCMS对发酵产物进行定性和定量分析发现工程菌株NK2LUP能发酵生产羽扇豆醇,见图7。其产量达到(823±118) mg·L-1见图8;与出发菌NK2SQ相比,三萜的通用前体鲨烯和其内源衍生物羊毛甾醇和麦角固醇的总量未见明显改变,分别为40726,41332 mg·L-1,但中间体鲨烯的积累依然很充足,产量为(35335±378) mg·L-1,见图8。
4讨论
目前,虽然人们发现桦木酸等羽扇豆烷型三萜具有很出色的抗癌、抗HIV等生物学活性[1920],但是此类化合物基本都是从植物中直接提取,对植物资源有很高的依赖性和破坏性。酿酒酵母为安全的模式真核生物,含有可供萜类合成的MVA途径,且利用酿酒酵母生产萜类化合物也已经有了很多成功的案例,如科学家们已构建了生产青蒿酸[10]、丹参酮[21]、人参苷元[1112]等萜类化合物的酿酒酵母细胞工厂。本研究中,首先通过一步法在酿酒酵母中实现了约20 kb基因长度的MVA途径精确重组,构建了高产鲨烯的三萜底盘酿酒酵母细胞工厂NK2SQ。然后,将拟南芥来源的AtLUP基因整合至底盘菌株NK2SQ基因组中,创建了可生产羽扇豆烷的酿酒酵母细胞工厂NK2LUP。然而,目前工程菌株中羽扇豆醇的转化率及产量均很低,这一现象可能是环氧鲨烯合酶(ERG1)是三萜合成途径中的一个限速酶[11],未过表达ERG1导致羽扇豆醇合酶AtLUP的底物2,3环氧鲨烯供给不足造成的;亦或是植物源蛋白AtLUP在酿酒酵母中进行异源表达且只有单个拷贝时,酶活及表达量不足造成的;亦或是二者兼而有之。下步工作将主要围绕鲨烯至羽扇豆醇的代谢途径进行优化。本研究完成了羽扇豆醇酿酒酵母人工细胞工厂的构建,为进一步获得羽扇豆烷型三萜细胞工厂提供了基础,同时为酵母中实现大规模生物合成途径精确组装提供技术支持。
[参考文献]
[1]姚庆生天然药物化学[M] 3版北京:人民卫生出版社,2002:257.
[2]Carelli M, Biazzi E, Panara F, et alMedicago truncatula CYP716A12 is a multifunctional oxidase involved in the biosynthesis of hemolytic saponins [J].Plant Cell,2011,23(8):3070.
[3]Fukushima E O, Seki H, Ohyama K, et al CYP716A subfamily members are multifunctional oxidases in triterpenoid biosynthesis [J].Plant Cell Physiol,2011,52(12):2050.
[4]Huang L L, LI J, Ye H C, et al Molecular characterization of the pentacyclic triterpenoid biosynthetic pathway in Catharanthus roseus [J].Planta,2012,236(5):1571.
[5]Pisha E, Chai H, Lee I S, et al Discovery of betulinic acid as a selective inhibitor of humanmelanoma that functions by induction of apoptosis [J].Nat Med,1995,1(10):1046.
[6]Qian K D, Kuo R Y, Chen C H, et al AntiAIDS agents 81 design, synthesis, and structureactivity relationship study of betulinic acid and moronic acid derivatives as potent HIV maturation inhibitors [J].J Membr Biol,2010,53(8):3133.
[7]Zhao H, Holmes S, Bose H, et al Preparing new betulinic acid derivatives for fighting HIV viruses [C].Abstr Pap Am Chem S,2011,242.
[8]Urano E, Ablan S D, Mandt R, et al Alkyl amine bevirimat derivatives are potent and broadly active HIV1 maturation inhibitors [J].Antimicrob Agents Chemother,2015,60(1):190.
[9]Gaudet D, PIchette A Process for preparing natural product derivatives from plants in a single step [P] WO200026174A,US6280778A,WO200026174A2,CA2250481A1 CA2288361A1,AU200010217A,US6280778B1,CA2288361C,2001
[10]Paddon C J, Westfall P J, Pitera D J, et al Highlevel semisynthetic production of the potent antimalarial artemisinin [J].Nature,2013,496(7446):528.
[11]Dai Z B, Liu Y, Zhang X A, et al Metabolic engineering of Saccharomyces cerevisiae for production of ginsenosides [J].Metab Eng,2013,20:146.
[12]Dai Z B, Wang B B, Liu Y, et al Producing aglycons of ginsenosides in bakers′ yeast [J].Sci Rep,2014,4:6.
[13]Xie W, Lv X, Ye L, et al Construction of lycopeneoverproducing Saccharomyces cerevisiae by combining directed evolution and metabolic engineering [J].Metab Eng,2015,30:69.
[14]Li Q, Sun Z, Li J, et al Enhancing betacarotene production in Saccharomyces cerevisiae by metabolic engineering [J].FEMS Microbiol Lett,2013,345(2):94.
[15]Galanie S, Thodey K, Trenchard I J, et al Complete biosynthesis of opioids in yeast [J].Science,2015,349(6252):1905.
[16]Ajikumar P K, Xiao W H, Tyo K E J, et al Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli [J].Science,2010,330(6000):70.
[17]Ghimire G P, Thuan N H, Koirala N, et al Advances in biochemistry and microbial production of squalene and its derivatives[J].J Microbiol Biotechnol,2015,25(10):100.
[18]Lorenz R T, Parks L W.Regulation of ergosterol biosynthesis and sterol uptake in a sterolauxotrophic yeast [J].J Bacteriol,1987,169(8):3707.
[19]Jonnalagadda S C, Corsello M A, Sleet C E.Betulinbetulinic acid natural product based analogs as anticancer agents [J].AntiCancer Agents Med Chem,2013,13(10):1477.
[20]Kashiwada Y, Hashimoto F, Cosentino L M, et al Betulinic acid and dihydrobetulinic acid derivatives as potent antiHIV agents [J].J Med Chem,1996,39(5):1016.
[21]Dai Z B, Liu Y, Huang L Q, et al Production of miltiradiene by metabolically engineered Saccharomyces cerevisiae [J].Biotechnol Bioeng,2012,109(11):2845.
[责任编辑吕冬梅]

