纳米金比色法测定多西环素和土霉素
曲 黎,魏燕丽,范淑敏
(河南科技学院 新科学院,河南 新乡 453003)
纳米金比色法测定多西环素和土霉素
曲黎,魏燕丽,范淑敏*
(河南科技学院 新科学院,河南 新乡 453003)
摘要:采用柠檬酸钠还原法合成粒径约13 nm的纳米金粒子. 采用紫外-可见分光光度计、荧光分光光度计研究了纳米金粒子与多西环素/土霉素分子的相互作用;通过改变缓冲溶液、纳米金粒子用量、反应时间确定了比色法测定的最优反应条件. 结果表明:在弱酸溶液中,多西环素/土霉素分子中的氨基官能团(-NH2)得到电子成为带电基团(-NH3+) 并通过静电引力与纳米金粒子结合,使得纳米金粒子发生聚集,导致纳米金吸收光谱发生红移和展宽,颜色由酒红色变成蓝色;在盐酸-柠檬酸钠的缓冲溶液中加入2 mL纳米金,反应时间为10 min的条件下测得多西环素和土霉素的线性范围分别为0.06~0.66 mg·L(-1)和0.59~8.85 mg·L(-1),检出限(3σ)分别为0.008 6、0.083 8 mg·L(-1). 该方法前处理简单、灵敏、可靠,有望应用于食品分析和临床分析等领域.
关键词:纳米金粒子;比色法;多西环素;土霉素
四环素类抗生素(tetracycline antibiotics)是含有并四苯基本骨架的一类广谱抗生素[1-3]. 土霉素和多西环素都可以促进畜禽的生长,预防和治疗畜禽、鱼类的疾病,并可以增加产奶量. 过量使用土霉素和多西环素造成动物产品中药物残留,影响人体健康,因此对动物源性食品中土霉素和多西环素的最高残留,各个国家都有相应的标准及检测方法[4-6]. 目前,我国对于土霉素和多西环素的测定,常用的方法有高效液相色谱法(HPLC)、紫外分光光度法[7]、电化学分析法[8-10]、荧光法[11-12]和细菌抑制法[13]等.
纳米金比色法灵敏度高,简单、快速,是目前研究比较热门的分析测定方法. 纳米金比色分析的主要优势是通过肉眼即可观察其颜色变化,简单快速,而且省去昂贵复杂的仪器,另外纳米金的消光系数高,灵敏度高,因而比色分析被用于蛋白质,DNA,金属离子和小分子等多种物质的检测,同时被用于蛋白质之间、DNA之间的相互作用研究[14-16]. 目前,纳米金比色法已成功用于三聚氰胺、瘦肉精等物质的检测[17]. 本文采用纳米金比色法测定土霉素和多西环素,测定结果与药典分析结果一致. 此方法简单,测定速度快,而且不需要昂贵的仪器及大量的分析试剂,在食品分析及环境监测方面有很好的应用前景.
1实验部分
1.1仪器与试剂
PHS-3C酸度计(上海仪电科学仪器有限公司);U-3010紫外-可见分光光度计(日本岛津公司);F-7000荧光分光光度计(日本日立); FA1204B电子分析天平(上海佑科仪器有限公司);CL-2恒温加热磁力搅拌器(郑州长城科工贸有限公司);Tecnai G2 20s-twin高分辨型透射电子显微镜(日本).
四氯金酸(Sigma-Aldrich 公司);多西环素,土霉素对照品(中国药品生物制品检定所);盐酸-乙酸钠缓冲溶液、盐酸-柠檬酸钠缓冲溶液;多西环素片剂(0.1 g,国药准字H13021945)和注射液(0.1 g,国药准字p0060405)为药店随机购买;二次蒸馏水、超纯水由实验室提供,所用试剂均为分析纯.
1.2纳米金的合成[5]
用新配制的王水浸泡所用玻璃器皿24 h,超纯水洗后烘干备用. 将氯金酸配成1%的溶液,精确量取1 mL于100 mL棕色容量瓶中稀释至0.01%. 将0.01%的氯金酸溶液搅拌加热至沸后加入2.75 mL 1%的柠檬酸钠溶液,12 min后颜色由紫红色变为酒红色,冷却至室温,用0.2 μm超滤膜过滤,滤液于棕色试剂瓶中4 ℃保存备用.
1.3测定吸光度
取2.5 mL新制纳米金于5 mL容量瓶中,加入盐酸-柠檬酸钠缓冲溶液,定容. 取2 mL纳米金,依次加入不同体积的多西环素标准溶液(1.50×10-4g·mL-1)/土霉素标准溶液(1.48×10-3g·mL-1),混合均匀,以水为参比分别测定吸光度.
2结果与讨论
2.1纳米金表征
纳米金呈酒红色,其表观颜色及粒径与文献报道一致. 球形纳米金粒子存在表面等离子吸收的特征峰,以水为空白,绘制纳米金吸收曲线,如图1所示,在518 nm处有最大吸收,据此可计算纳米金的粒径,约为13 nm[18]. 由纳米金的紫外可见吸收光谱图可以看出纳米金颗粒稳定,符合分析要求.

图1 纳米金的紫外-可见吸收光谱Fig.1 Absorption spectra of GNPs
纳米金的透射电镜分析(TEM)如图2所示,制备的纳米金为球形,粒径均匀,分散良好.

图2 纳米金的透射电镜图Fig.2 SEM of GNPs
2.2多西环素/土霉素测定原理
实验利用柠檬酸钠还原氯金酸制备纳米金,纳米金粒子表面包裹大量的柠檬酸根离子,由于静电排斥力纳米金不发生凝聚. 在弱酸溶液中,多西环素/土霉素分子中的氨基官能团(-NH2)可以得到电子(-NH3+),和纳米金粒子之间通过静电引力相互作用,引发纳米金凝聚. 凝聚后的纳米金透射电镜图如图3所示,纳米金凝聚在一起,证明了纳米金粒子与四环素类抗生素之间的相互作用. 凝聚后纳米金颜色由酒红色变为紫色最终变为蓝色,由于纳米金表面等离子共振,其吸收光谱发生红移和展宽,紫外-可见吸收光谱如图4,纳米金的最大吸收峰由原来的518 nm红移至640 nm. 纳米金的共振散射光谱如图5所示,纳米金凝聚后,共振散射光谱增强. 并且在一定范围内纳米金的聚集与多西环素/土霉素的浓度呈现良好的线性关系,据此可建立简单、快速测定多西环素/土霉素的比色分析.

多西环素0.54 mg·L-1图3 凝聚后的纳米金透射电镜图Fig.3 SEM of GNPs in the presence of doxycycline
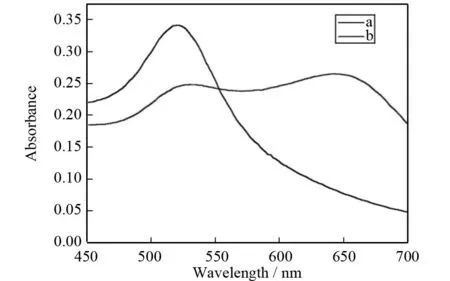
(a)不存在多西环素(b)存在0.54 mg·L-1多西环素图4 纳米金的紫外-可见吸收光谱图Fig.4 UV-Vis absorption spectra of GNPs
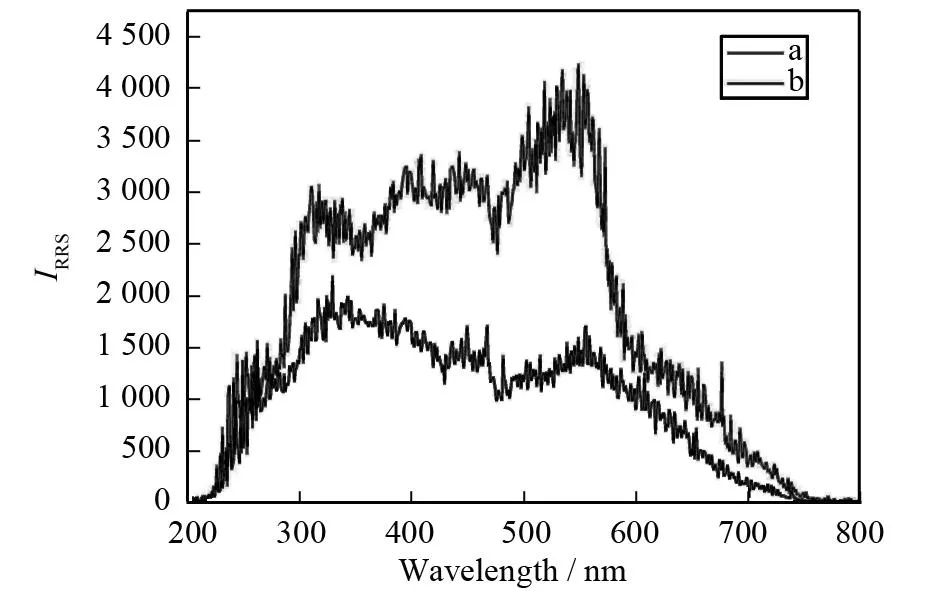
(a)不存在多西环素(b)存在0.48 mg·L-1多西环素图5 纳米金的共振散射光谱图Fig.5 RRS spectra of GNPs
2.3实验条件优化
将多西环素加入纳米金后,纳米金产生凝聚,其凝聚程度可用Δ(A640/A518)来表示. 在pp.0~7.0范围考查缓冲溶液对测定的影响. 图6显示不同缓冲溶液对测定的影响,结果表明使用盐酸-柠檬酸钠缓冲溶液的测定效果较好. 图7显示缓冲溶液加入量对测定的影响,700 μL pH为2.1的盐酸-柠檬酸钠缓冲溶液引起纳米金凝聚的Δ(A640/A518)值最大. 其原因是pH 过低时,纳米金粒子表面所带负电荷较少, 不利于结合多西环素, 而pH 过高, 多西环素中质子化的氢解离, 使正电荷减少,也不利于结合.


图6 缓冲溶液对Δ(A640/A518)的影响Fig.6 Effect of acidity on determination of doxycycline by using different buffer solutions
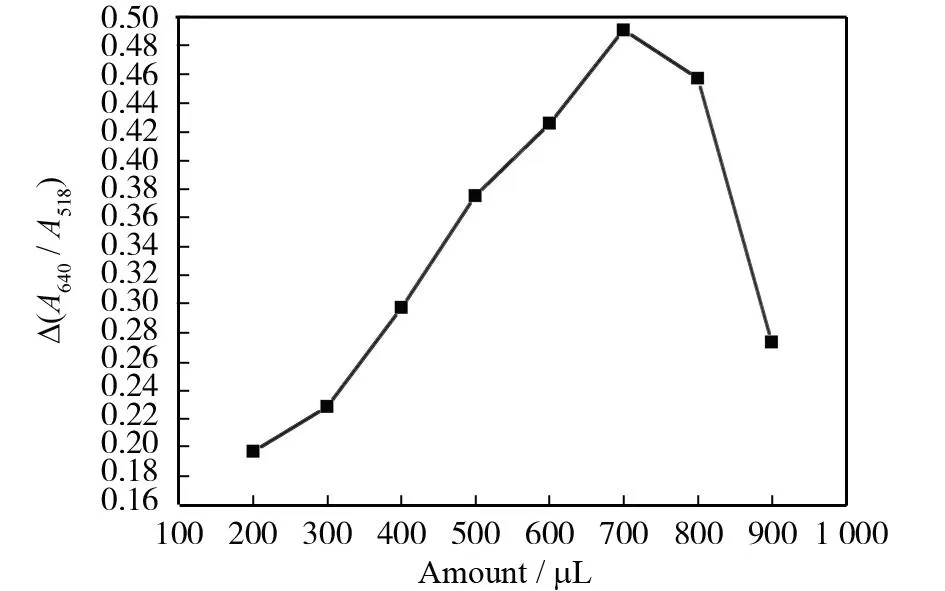
图7 盐酸-柠檬酸钠加入量对Δ(A640/A518)的影响Fig.7 Effect of addition of HCl-sodium citrate buffer solution
同时我们也考察了纳米金的用量对体系测定的影响. 改变纳米金的用量从1~3 mL,不同纳米金用量对应的Δ(A640/A518)值如图8所示,纳米金的浓度增大时,其最大吸收峰值降低,当纳米金浓度高时,对仪器的染色比较严重,且对低浓度的多西环素变化不灵敏,当纳米金浓度低时,颜色变化不灵敏,因此实验选择2 mL纳米金.
图9考察了反应时间对测定的影响,连续测定1 h,结果表明:加入多西环素,10 min凝聚程度最大,10 min后基本不再变化,反应时间设为10 min.
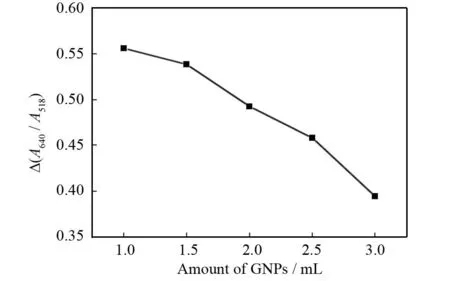
图8 不同纳米金用量对应的Δ(A640/A518)Fig.8 Effect of addition of GNPs on Δ(A640/A518)
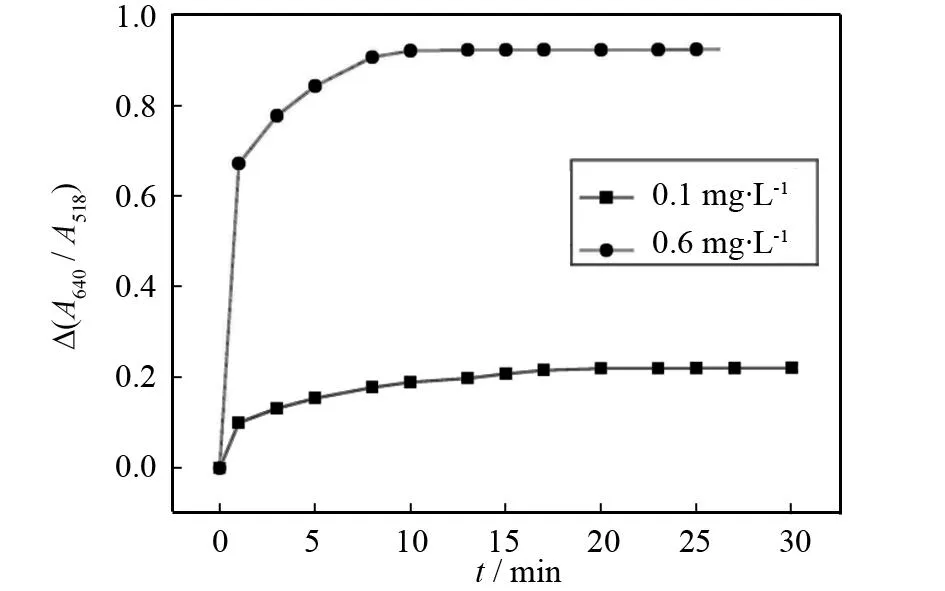
图9 反应时间对吸收光谱的影响Fig.9 Effect of reaction time on Δ(A640/A518)
2.4多西环素/土霉素的测定
在最优条件下,按照实验方法依次加入多西环素标准溶液并测定其吸收光谱(图10),由Δ(A640/A518)对多西环素的浓度作图(如图10所示),线性范围为0.06~0.66 mg·L-1,线性回归方程为Δ(A640/A518)= 0.042+ 1.480 4c(多西环素,mg·L-1),相关系数为0.998,检出限(3σ)为0.008 6 mg·L-1,纳米金比色法测定多西环素具有检出限低,灵敏度高,方法简单等优点,有望应用于食品分析领域.
最优条件下测定土霉素,测定其吸收光谱(图11),在0.59~8.85 mg·L-1范围内,线性回归方程为Δ(A630/A518) = 0.222 + 0.077c(土霉素,mg·L-1),相关系数0.999,检出限(3σ)0.083 8 mg·L-1.
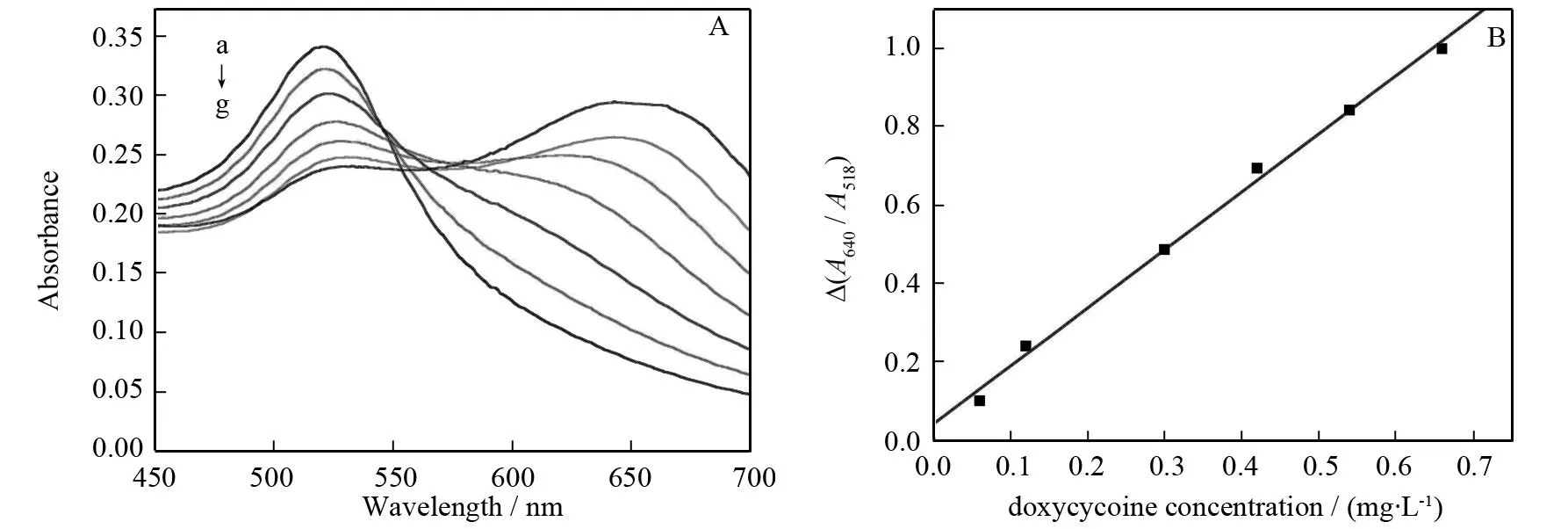
a→g: 0, 0.06, 0.12, 0.3, 0.42, 0.54, 0.66 mg·L-1.图10 不同浓度多西环素存在下纳米金的紫外-可见吸收光谱图及相应的标准曲线Fig.10 UV-Vis absorption spectra of GNPs in the absence and presence of doxycycline
2.5常见物质的干扰
表1考察了金属离子、氨基酸及结构类似药物的干扰. 结果表明,对于0.54 mg·L-1多西环素,该体系基本不受干扰,有较好选择性.
2.6回收率
取多西环素20片,研细, 精密称取约一片多西环素质量,盐酸溶解后过滤,移至容量瓶,定容. 进行标准加入回收实验,精密量取适量样品溶液,分别加入标准溶液0.06、0.54 mg·L-1,测定吸光度,计算回收率,实验重复3次.
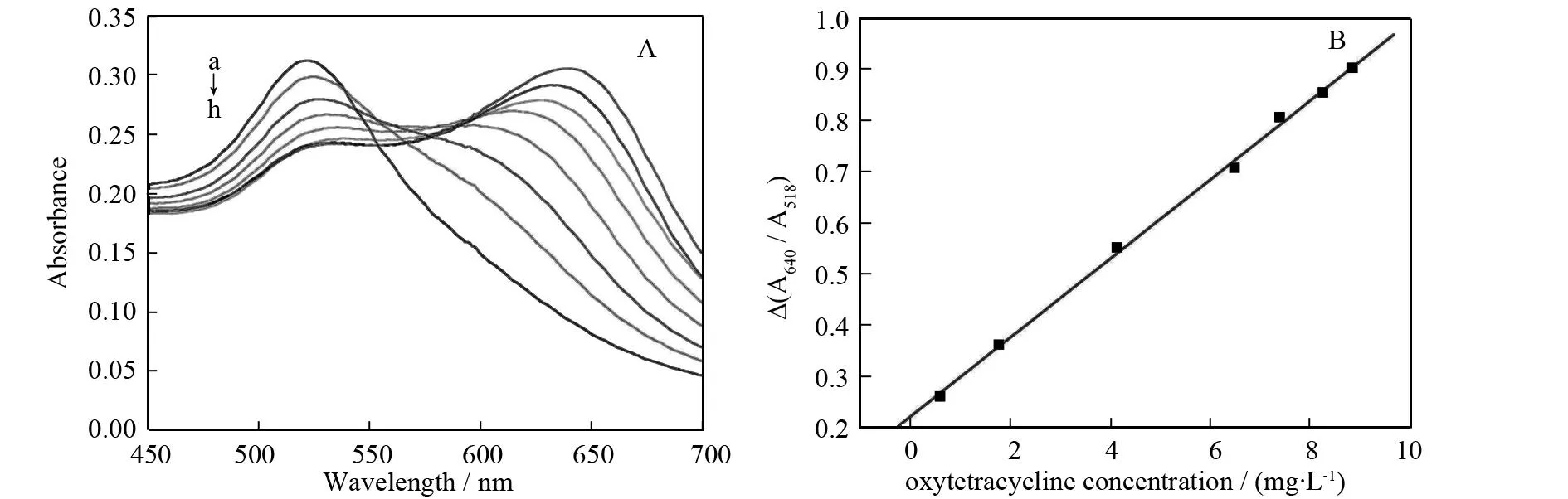
a→h: 0, 0.59, 1.77, 4.13, 6.49, 7.39, 8.26, 8.85 mg·L-1.图11 纳米金与土霉素相互作用的紫外-可见吸收光谱图及相应的标准曲线Fig.11 UV-Vis absorption spectra of GNPs in the absence and presence of oxytetracycline
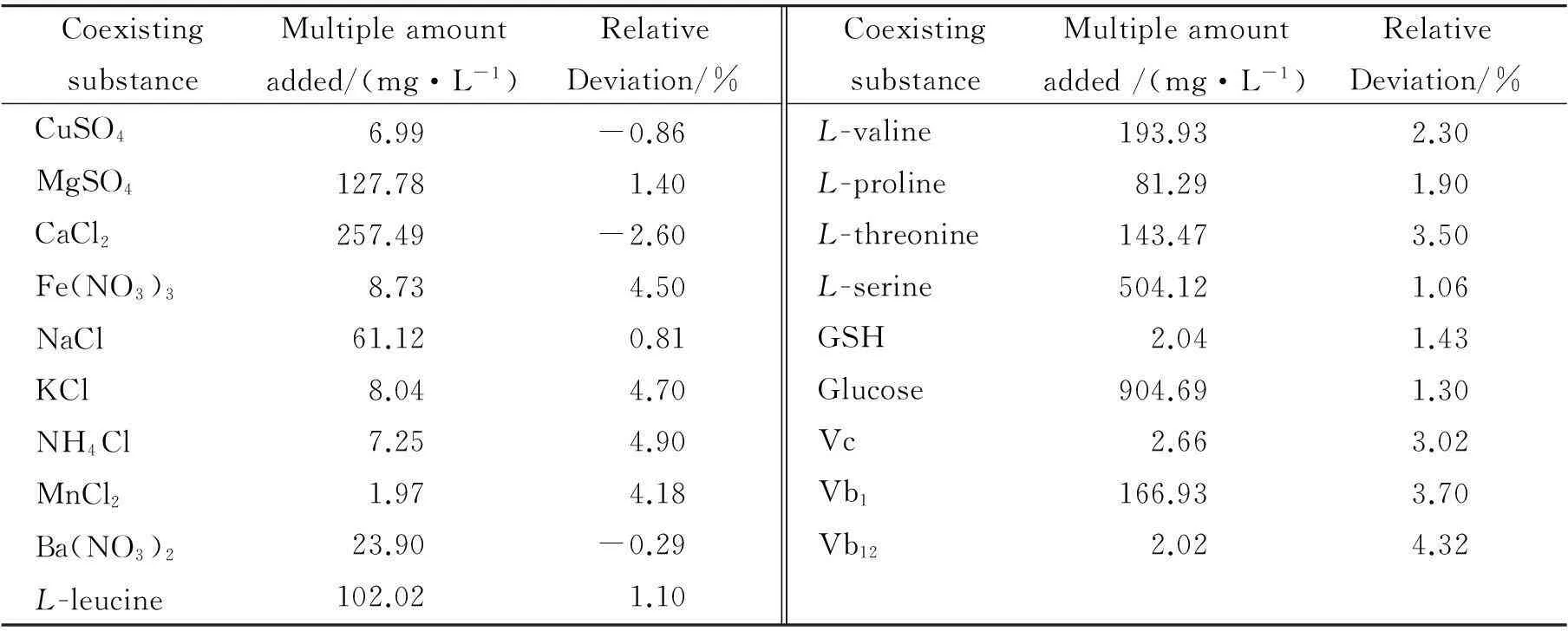
CoexistingsubstanceMultipleamountadded/(mg·L-1)RelativeDeviation/%CoexistingsubstanceMultipleamountadded/(mg·L-1)RelativeDeviation/%CuSO4MgSO4CaCl2Fe(NO3)3NaClKClNH4ClMnCl2Ba(NO3)2L-leucine6.99127.78257.498.7361.128.047.251.9723.90102.02-0.861.40-2.604.500.814.704.904.18-0.291.10L-valineL-prolineL-threonineL-serineGSHGlucoseVcVb1Vb12193.9381.29143.47504.122.04904.692.66166.932.022.301.903.501.061.431.303.023.704.32
精密量取1 mL多西环素注射液于棕色容量瓶中,进行标准加入回收实验,精密量取适量样品溶液,分别加入标准溶液0.12、0.42 mg·L-1,测定吸光度,计算回收率,结果见表2.
2.7含量测定
精密量取多西环素片剂及注射液样品,按实验方法测定,结果见表3. 测定结果表明所购多西环素片剂及注射液含量在标示范围95.0%~105%内,RSD较小, 符合药品质量管理规定.
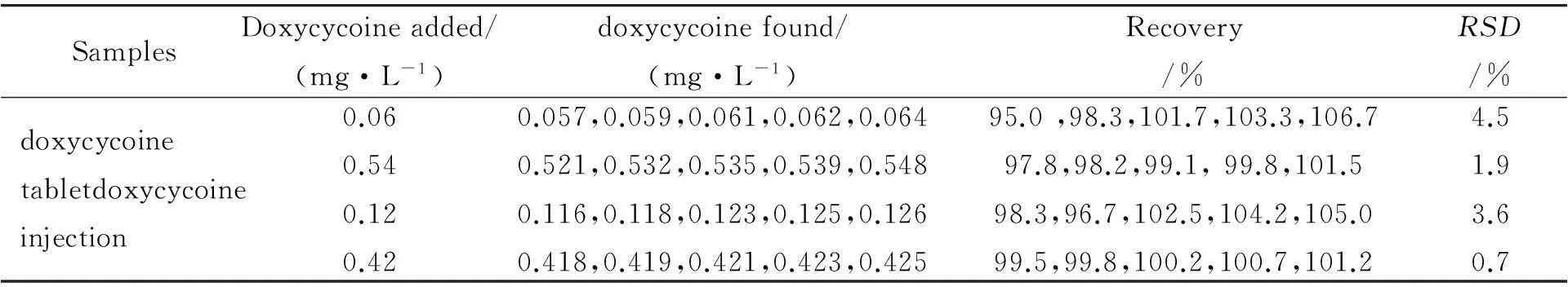
表2 多西环素片剂及注射液中多西环素的回收率测定(n=5)
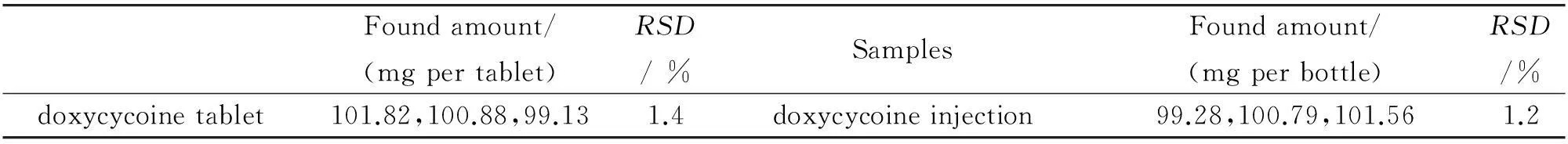
表3 多西环素片剂及注射液中多西环素的测定(n=3)
3结论
采用柠檬酸钠还原氯金酸方法得到纳米金. 在弱酸环境中纳米金可与多西环素、土霉素相互作用,产生凝聚,其吸收光谱发生红移,据此测定多西环素、土霉素. 优化了缓冲溶液、纳米金用量及反应时间等反应条件;在最佳条件下,测定结果令人满意. 同时分析了多西环素片剂及注射液,结果与药典方法结果一致. 该方法简单快速,且不需昂贵仪器及大量分析试剂,在食品及环境分析方面前景广泛.
参考文献:
[1] CHOPRA I, ROBERTS M. Tetracycline antibiotics: mode of action, applications, molecular biology, and epidemiology of bacterial resistance [J]. Microbiol Mol Biol Rev, 2001, 65(2): 232-260.
[2] LUO Y l, XU J Y , LI Y, et al. A novel colorimetric aptasensor using cystramine-stabilized gold nanoparticles as probe for rapid and specific detection of trtracycline in raw milk [J]. Food Control, 2015, 54: 7-15.
[3] NICOLAOU K G, CHEN J S, EDMONDS D J. Recent advances in the chemistry and biology of naturally occurring antibiotics [J]. Angew Chem Int Ed, 2009, 48(4): 660-719.
[4] SHEN L, CHEN J, LI N, et al. Rapid colorimetric sensing of tetracycline antibiotics with in situ growth of gold nanoparticles [J]. Anal Chim Acta, 2014, 839: 83-90.
[5] WANG R Y, FAN S M, WANG R Q, et al. Determination of aninoglycoside antibiotics by a colorimetric method based on the aggregation of gold nanopatricles [J]. Nano, 2013, 8(4): 37-45.
[6] WANG S, LIU J H, YONG W, et al. A direct competitive assay-based aptasensor for sensitive determination of tetracycline residue in honey [J]. Tnlanta, 2015, 131: 562-569.
[7] 斯琴,敖登高娃,李虎东. 偏最小二乘紫外分光光度法同时测定四环素、土霉素和甲稀土霉素 [J]. 内蒙古大学学报: 自然科学版, 2007,38(1): 28-30.
[8] 潘丹梅,胡荣宗,韦冬萍. Ni电极电化学流通池检测四环素类药品的研究 [J]. 电化学, 2007,13(2): 122-125.
[9] 邢晓平.鸡蛋中残留四环素类抗生素的快速测定研究 [J]. 盐城工学院学报: 自然科学版, 2006, 19(4): 16-19.
[10] 刘美华,田芹,任丽萍. 动物食品中土霉素残留检测方法的研究进展 [J]. 化学工程师, 2005, 4: 50-52.
[11] 高红,赵一兵,郭祥群. 一种测定四环素类抗生素的光谱新方法 [J]. 光谱学与光谱分析, 2006, 26(3): 488-490.
[12] 顾运琼,梁伟江,罗旭键,等. 白花丹素镧(Ⅲ)配合物与牛血清白蛋白相互作用的光谱学研究 [J]. 化学研究, 2013, 24(6): 605-610.
[13] 朱金国,刘红霞. 发光细菌检测四环素族抗生素体系的建立 [J]. 中国食品卫生杂志, 2005, 17(2): 150-153.
[14] MINSEON C, MIN S H, CHANGILL B, et al. A simple and direct electrochemical detection of interferon-γ using its RNA and DNA aptamers [J]. Chem Commun, 2008, 45: 73-75.
[15] ELHAM N, AMIR M, AYYOOB A. Colorimetric DNA detection of transgenic plants using gold nanoparticles functionalized withL-shaped DNA probes [J]. Physica E: Low-dimensional Systems and Nanostructures, 2016, 75: 188-195.
[16] CHANG C C, CHEN C Y, CHUANG T L, et al. Aptamer-based colorimetric detection of proteins using a branched DNA cascade amplification strategy and unmodified gold nanoparticles [J]. Biosensors and Bioelectronics, 2016, 78(15): 200-205.
[17] NAVEEN K, RAMAN S, HARISH K. Colorimetric detection of melamine in milk by citrate-stabilized gold nanoparticles [J]. Anal Biochem, 2014, 456: 43-49.
[18] WOLFGANG H, NGUYEN T K T, JENNY A. Determination of size and concentration of gold nanoparticles from UV-Vis spectra [J]. Anal Chem, 2007,79: 4215-4221.
[责任编辑:吴文鹏]
Highly sensitive colorimetric detection on doxycycline and oxytetracycline based on gold nanoparticles
QU Li, WEI Yanli, FAN Shumin*
(XinkeCollege,HenanInstituteofScienceandTechnology,Xinxiang453003,Henan,China)
Abstract:The well-dispersed gold nanoparticles (GNPs) were synthesized through sodium citrate reduction method. UV-Vis spectrometer and fluorescence spectrophotometer were used to investigate the mutual effect between GNPs and doxycycline/oxytetracycline. The experimental parameters were optimized with regard to pH, incubation time and concentration of the GNPs. The amino group, which is positively charged in weakly acidic medium (namely, -NH3+), integrates with the negative charge on the surface of gold nanoparticles to form a bigger binding product through electrostatic binding, resulting the aggregation of GNPs with a red-to-purple-to-blue color change. The absorption band of GNPs had a red shift and broadened. Under optimal experimental conditions, the linear ranges of the colorimetric sensor were 0.06-0.66 mg·L(-1) and 0.59-8.85 mg·L(-1) with the corresponding limit of detection (3σ) of 0.008 6 and 0.083 8 mg·L(-1) for doxycycline and oxytetracycline respectively. This method is promising for foods and clinical analysis owing to to its simple, reliable, convenient and low-cost.
Keywords:GNPs; colorimetric method; doxycycline; oxytetracycline
文章编号:1008-1011(2016)02-0189-06
中图分类号:O652.7
文献标志码:A
作者简介:曲黎(1981-),女,讲师,研究方向分析化学. 通讯联系人,E-mail: fsmhn@aliyun.com.
基金项目:国家自然科学基金(51304064).
收稿日期:2016-01-22.

