骨化三醇通过上调中性粒细胞弹性蛋白酶抑制剂表达抑制角质形成细胞增殖的研究
李慧+郭志丽+顾军
摘 要 目的:探讨骨化三醇和中性粒细胞弹性蛋白酶抑制剂serpin B1对人角质形成细胞株HaCaT细胞增殖的影响。方法:骨化三醇组在常规培养的HaCaT细胞中加入骨化三醇,对照组加入等量的无血清培养基,避光培养48 h后采用反复冻融法提取细胞全蛋白,采用固相pH梯度双向凝胶电泳法进行分离,并用ImageMaster 2D Platinum 5.0软件分析蛋白表达的差异,同时采用基质辅助激光解吸飞行时间质谱仪进行蛋白鉴定。serpin B1的表达上调通过反转录聚合酶链式反应法和Western-blotting法予以验证。通过RNA干扰实验、噻唑蓝实验和流式细胞法分析serpin B1对HaCaT细胞增殖的影响。结果:骨化三醇组的serpin B1表达上调。骨化三醇在1×10-9 ~ 1×10-6 mol/L浓度时能抑制HaCaT细胞增殖。干扰serpin B1可促进HaCaT细胞增殖,且使骨化三醇的抑制作用消失。结论:骨化三醇可上调HaCaT细胞中的serpin B1表达,这可能在骨化三醇抑制HaCaT细胞增殖的过程中起着重要作用。
关键词 骨化三醇 角质形成细胞 中性粒细胞弹性蛋白酶抑制剂 serpin B1 银屑病
中图分类号:R977.24; R758.63 文献标识码:A 文章编号:1006-1533(2016)09-0028-07
Calcitriol inhibits keratinocyte proliferation by upregulating the expression of leukocyte elastase inhibitor serpin B1
LI Hui1,2*, GUO Zhili2, GU Jun2**
(1. Department of Dermatology, General Hospital of Urumuqi Military Region, Urumuqi 830000, China;
2. Department of Dermatology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China)
ABSTRACT Objective: To evaluate the role of calcitriol and serpin B1 in human keratinocyte cell line HaCaT proliferation. Methods: Calcitriol was added at 1×10-8 mol/L into the culture of HaCaT cell in a calcitriol group while only serum-free Dulbeccos modified Eagles medium instead in a control group. Whole proteins were extracted by freeze-thawing method after cells were incubated in the dark for 48 h and were separated by two-dimensional differential gel electrophoresis. The differences for protein expression were analyzed by ImageMaster 2D Platinum 5.0 and the identification of proteins was performed by matrix-assisted laser desorption/ionization time of flight mass spectrometry. The overexpression of serpin B1 was confirmed by reverse transcription polymerase chain reaction and Western-blotting assay. The effect of serpin B1 on HaCaT proliferation was analyzed by RNA interference experiments, methyl thiazole tetrazolium assay and flow cytometry. Results: The expression of serpin B1 was upregulated in the calcitriol group. Calcitriol could inhibit HaCaT proliferation at 1×10-9 ~ 1×10-6 mol/L. HaCaT proliferation could be promoted and its inhibitory effect could be offset by interfering serpin B1. Conclusion: The expression of serpin B1 can be upregulated when calcitriol is added into the culture of HaCaT cells, which may play an important role in the inhibition of calcitriol to the proliferation of HaCaT cells.
KEY WORDS calcitriol; keratinocytes; leukocyte elastase inhibitor; serpin B1; psoriasis
胞增殖和表皮内的中性粒细胞浸润[1-2]。骨化三醇及其类似物已被证实可有效治疗轻、中度寻常型银屑病[3-4],其机制被认为是骨化三醇能抑制角质形成细胞的增殖并促进角质形成细胞的分化[5]。
银屑病患者的活动性皮损及外周血中的中性粒细胞数常增多,且随之产生的氧化压力与银屑病的严重程度相关[2,6]。中性粒细胞颗粒蛋白酶虽能直接杀伤吞噬的病原体,但在慢性炎症性疾病中,其之过度释放也可导致组织损伤以及凋亡细胞的清除障碍[7-9]。蛋白激酶的调节在表皮的屏障功能及炎症性皮肤病的发病过程中起着重要作用[10]。作为蛋白激酶家族成员,中性粒细胞弹性蛋白酶(neutrophil elastase, NE)是活化的中性粒细胞释放的主要物质,在银屑病引起的组织破坏中起着重要作用。NE在银屑病患者的组织和血清中表达过度并在银屑病的发病中起着重要作用[11]。NE的水平与银屑病的活动性相关,且被认为是诊断银屑病和随访其严重程度的一种很好的监测指标[12]。此外,既往研究显示,NE在银屑病皮损中高表达,且可刺激角质形成细胞的增殖[13]。NE也可促进人角质形成细胞株HaCaT细胞的增殖及银屑病器官培养模型的transwell迁移[14]。NE和内源性蛋白酶抑制剂间的失衡已被公认为是银屑病的病因之一。一些NE的抑制剂、包括源自皮肤的抗白细胞蛋白酶[15]和α1-抗胰蛋白酶[16]都已被证实与银屑病相关。蛋白水解失衡与银屑病的进展相关[2]。
丝氨酸蛋白酶抑制剂是一类具有独特的三级结构并通过自杀式底物抑制机制中和靶蛋白酶的蛋白家族[17],其成员serpin B1又被称为多形核中性粒细胞弹性蛋白酶抑制剂和胞浆丝氨酸蛋白酶抑制剂[18]。serpin B1是中性粒细胞颗粒内的一种以自杀式底物抑制机制作用的快反应型NE、蛋白激酶3和组织蛋白酶G的抑制剂[10]。丝氨酸蛋白酶抑制剂已被认为与银屑病和其他常见的炎症性皮肤病相关[13,19-20],但serpin B1与银屑病的相关性尚未见有报告。
本研究的目的是证实骨化三醇能上调HaCaT细胞中的serpin B1表达且其有抑制HaCaT细胞增殖的作用。
1 实验方法
1.1 细胞培养
实验组:将永生化的HaCaT细胞(上海生化和细胞生物研究所产品)用添加了10%胎牛血清(法国Biowest公司产品)的Dulbecco改良的Eagle培养基(Dulbeccos modified Eagles medium, DMEM)(法国Biowest公司产品)于5% CO2、37 ℃下常规培养。待80%的细胞融合后,再加入1×10-8 mol/L的骨化三醇(美国Sigma公司产品)。
阴性对照组:将HaCaT细胞于未添加胎牛血清的DMEM中培养。
1.2 双向凝胶电泳(two-dimensional electrophoresis, 2DE)法和质谱分析
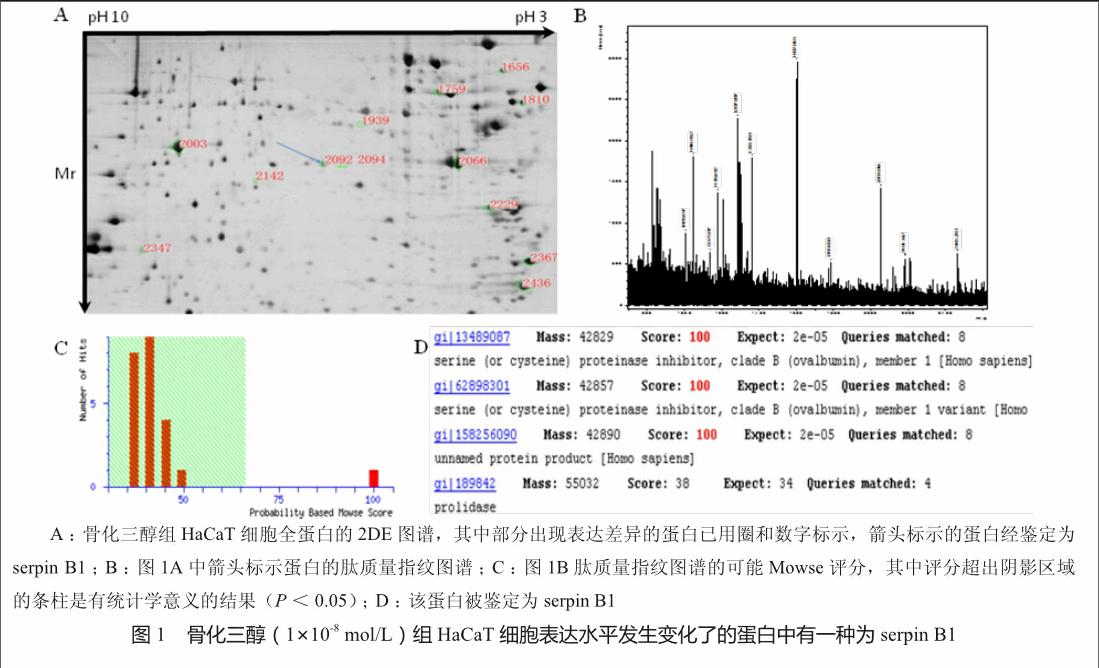
采用反复冻融法提取骨化三醇组和阴性对照组中的HaCaT细胞全蛋白,用Bradford法测定蛋白浓度,然后通过2DE法分离蛋白。总上样量为100 μg,第一向固相等电聚焦电泳采用17 cm长的pH为3 ~ 10的非线性固相pH梯度凝集胶条、按程序化的电压梯度进行电泳。主动水化50 V、14 h,温度为17 ℃,依次经250 V、30 min,500 V、1 h,1 000 V、1 h,升压至10 000 V、5 h,聚焦10 000 V达总量60 000 Vh。聚焦结束后,胶条先后经2%二硫苏糖醇和2.5%碘乙酰胺平衡,然后进行第二向电泳,采用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)法,10 mA、50 V、50 min,50 mA、250 V、至溴酚蓝指示剂到底部边缘。电泳结束后,采用快速银染法染色蛋白点位。
银染后的凝胶用UMAX PowerLook 2100XL扫描仪进行图像扫描光密度分析。使用ImageMaster 2D Platinum 5.0软件对2DE图谱进行匹配分析,筛选出存在差异的蛋白质点。切取符合质谱分析法浓度要求的10个有差异的蛋白质点并进行胶内酶解,然后通过基质辅助激光解吸飞行时间质谱仪对蛋白质点进行氨基酸序列分析,依据酶解肽片断的质量,通过Mascot软件查询SWISS-PROT蛋白数据库,经软件自动运算得出Mascot得分,进而确定被测蛋白的可能属性及名称。数据分析及蛋白鉴定由中科院上海生物研究所蛋白质组学研究中心完成。
1.3 反转录聚合酶链式反应(reverse transcription polymerase chain reaction, RT-PCR)法
用Trizol试剂(美国Invitrogen公司产品)抽提预处理后的HaCaT细胞的总RNA,然后按照操作试剂盒(立陶宛MBI Fermentas公司产品)反转录合成cDNA。serpin B1引物的序列如下:前向引物,5′-AGGAACAGTTGACTTTGGAA-3′;反向引物,5′-AAAGAGATCCTGCACACCTA-3′。RT-PCR法采用标准的SYBR Green PCR试剂盒(日本TOYOBO公司产品)进行,聚合酶链式反应的特异性扩增在ABI 7300仪器(德国Applied Biosystem公司产品)中进行。serpin B1、磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH)的相对量采用2-ΔΔCt法计算。
1.4 Western-blotting法
提取的HaCaT细胞全蛋白经SDS-PAGE法分离后转移到硝酸纤维素膜(德国Millipore公司产品)上,用serpin B1抗体(美国Santa Cruz公司产品)和GAPDH抗体(美国Bioworld公司产品)孵育,之后孵育羊抗兔二抗,最后用化学发光法(美国Pierce公司产品)显影。
1.5 细胞转染
设计并合成3对serpin B1的siRNA(委托上海吉玛制药技术有限公司完成),序列分别为:serpin B1-homo-491 sense为5′-CGGGCAUGGUUGAUAACAUTT-3′,antisense为5′- A U G U U A U C A A C C A U G C C C G T T- 3′;s e r p i n B 1 - h o m o - 9 3 s e n s e为5′-GGCGUUGAGUGAGAACAAUTT-3′,antisense为5′- A U U G U U C U C A C U C A A C G C C T T- 3′;s e r p i n B 1 - h o m o - 8 1 3 s e n s e为5′-GUGGACUAAACCUGAGAAUTT-3′,antisense为5′-AUUCUCAGGUUUAGUCCACTT-3′。采用Lipofectamin 2000(美国Gibco公司产品)转染法转染HaCaT细胞,阴性对照siRNA作为空白对照。以RTPCR法验证转染及干扰效率。
1.6 噻唑蓝实验分析细胞增殖
铺96孔板,使HaCaT细胞在24 h内融合达70%左右,然后分为3组,分别加入骨化三醇、NE和无胎牛血清的DMEM,培养48 h后,再每孔加5 mg/ml噻唑蓝20μl,37 ℃、5% CO2下孵育4 h。吸弃每孔内培养基上清液,再每孔中加入二甲基亚砜150 μl,振荡10 min。用酶联免疫检测仪测定550 nm下的各孔光吸收值。
1.7 流式细胞仪检测细胞周期
用6孔板培养HaCaT细胞,然后分别用阴性对照siRNA、空白对照、serpin B1 siRNA、阴性对照联合骨化三醇(1×10-8 mol/L)和空白对照联合骨化三醇(1×10-8 mol/L)处理细胞。48 h后收集细胞,加入70%乙醇,30 min后再用冰磷酸盐缓冲液(phosphate buffer solution, PBS)清洗。在冰上加入含RNase(1∶100)的PBS重悬细胞,然后用碘化丙啶染色,用流式细胞仪(美国BD Biosciences公司产品)进行分析。
1.8 统计分析方法
本研究计量资料以(均数±标准差)表述。两组样本间的均数比较用两样本均数的t检验。P<0.05为有统计学显著差异。统计分析采用SPSS 18.0软件。
2 结果
2.1 骨化三醇上调serpin B1表达
建立了HaCaT细胞全蛋白的2DE图谱,发现重复性好,并共检测出3 000余个蛋白位点,见图1A。与对照组相比,骨化三醇组共有22种蛋白出现表达差异,其中一些蛋白的位点已在图1A中用圈和数字标示。22种蛋白中有5种表达下调,17种表达上调。共鉴定出4种有表达差异的蛋白,分别为serpin B1、fascin同系物-1、干扰素调控因子-4和gi 158256364。在图1A中用箭头标示的即是serpin B1,其在骨化三醇组表达上调。图1B、1C和1D展示了serpin B1的鉴定过程。
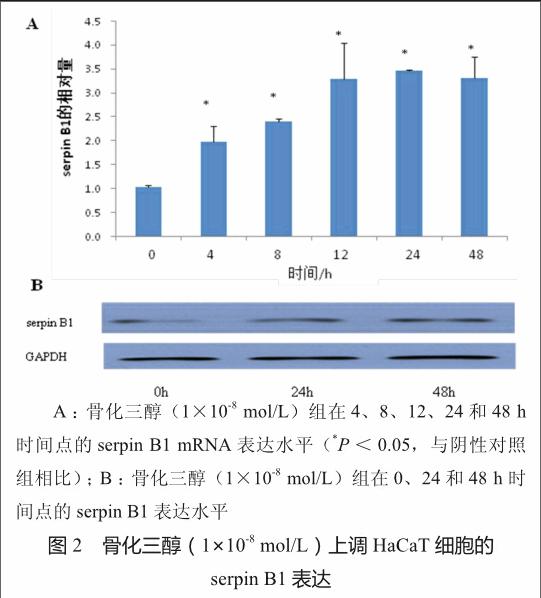
如图2A所示,RT-PCR法结果显示,与对照组相比,骨化三醇组在4、8、12、24和48 h时间点,serpin B1的表达分别上调了1.99、2.41、3.28、3.46和3.31倍(均P<0.05)。如图 2B所示,Western-blotting法结果显示,与对照组相比,骨化三醇组在24和48 h时间点,serpin B1的表达均上调(均P<0.05),且24和48 h时间点的表达有显著差异(P<0.05)。
2.2 serpin B1抑制HaCaT细胞增殖
如图3所示,骨化三醇在1×10-9 ~ 1×10-6 mol/L浓度时能抑制HaCaT细胞的增殖。为明确serpin B1对HaCaT细胞增殖的影响,对HaCaT细胞转染serpin B1 siRNA并设阴性对照。用RT-PCR法验证serpin B1的干扰效率,发现如图4A所示,serpin B1-homo-93可显著降低serpin B1的表达,抑制率达83%;如图4B所示,serpin B1 siRNA可较阴性对照和空白对照显著促进HaCaT细胞的增殖(均P<0.05),且serpin B1 siRNA联合骨化三醇组与阴性对照联合骨化三醇组间比较的结果亦相同(P<0.05)。这些结果提示,serpin B1可抑制HaCaT细胞增殖。
此外,如图4B所示,与阴性对照组相比,阴性对照联合骨化三醇组的HaCaT细胞增殖受到抑制,提示骨化三醇可抑制HaCaT细胞增殖。而当干扰serpin B1后,骨化三醇对HaCaT细胞增殖的抑制作用消失,提示serpin B1在骨化三醇抑制HaCaT细胞增殖过程中起着至关重要的作用。


如图5A、5C和5F所示,对细胞周期的研究结果也证实了serpin B1 siRNA的细胞增殖促进作用:serpin B1 siRNA组和阴性对照组的G1期细胞占比分别为(40.36±3.07)%和(47.04±2.15)%、S期细胞占比分别为(50.41±4.33)%和(35.49±4.30)%(均P<0.05),提示serpin B1 siRNA可促进细胞周期由G1期向S期转化。如图5A、5E和5F所示,骨化三醇的细胞增殖抑制作用也已为细胞周期研究结果所证实:阴性对照联合骨化三醇组的G1和S期细胞占比分别为(61.32±5.59)%和(18.85±2.90)%,提示骨化三醇可使细胞周期阻滞在G1期。此外,分析处于各细胞周期的细胞比例,如图5A、5B和5F所示,阴性对照组和空白对照组间的差异无统计学意义;如图5C、5D和5F所示,serpin B1 siRNA组和serpin B1 siRNA联合骨化三醇组间的差异也无统计学意义。
3 讨论
骨化三醇及其类似物已被证实可有效治疗轻、中度寻常型银屑病,其作用机制也已被证实是骨化三醇可抑制角质形成细胞增殖并促进其分化[3-4]。然而,骨化三醇促使角质形成细胞分化正常化的分子机制尚未被完全阐明。一项研究采用基因表达组学方法研究了1, 25-二羟维生素D3对角质形成细胞基因表达的影响,结果发现可诱导角质形成细胞serpin B1的表达[21]。同时,该研究还展示了一个包括维生素D受体配体在内的维生素D相关的细胞分化调控网络。本研究通过蛋白组学方法研究发现,骨化三醇可改变包括serpin B1在内的HaCaT细胞的多种蛋白表达。尤其是serpin B1,其表达的改变已为进一步的实验所证实,且其抑制HaCaT细胞增殖的作用也得到了进一步的研究。本研究揭示,骨化三醇可改变HaCaT细胞中的一些蛋白表达,这为银屑病治疗提供了新的作用靶点。本研究还显示,serpin B1在角质形成细胞中有表达,且其表达会在骨化三醇存在时上调。
serpin B1在中性粒细胞胞浆中高表达[22]。近来发现,除中性粒细胞、巨噬细胞和肥大细胞外,serpin B1在支气管和腺上皮细胞中也有表达[23]。serpin B1调控初始免疫,可在慢性炎症中通过中和蛋白激酶而减少组织损伤。在小鼠细菌感染模型中,serpin B1也与中性粒细胞的内稳定相关[24-26]。有研究显示,在小鼠慢性铜绿假单胞菌感染模型中,serpin B1可降低细菌数和减少炎性细胞的浸润[27]。对多种感染模型的研究还显示,serpin B1与病原菌清除及维持免疫功能所必需的正常中性粒细胞的储备有关[28-29]。因此,serpin B1被认为是最有效的NE抑制剂之一[29-31]。通过抑制NE,serpin B1可能在银屑病、慢性阻塞性肺疾病、纤维囊性病和溃疡性结肠炎等慢性炎症性疾病以及感染性疾病的发病过程中发挥至关重要的作用。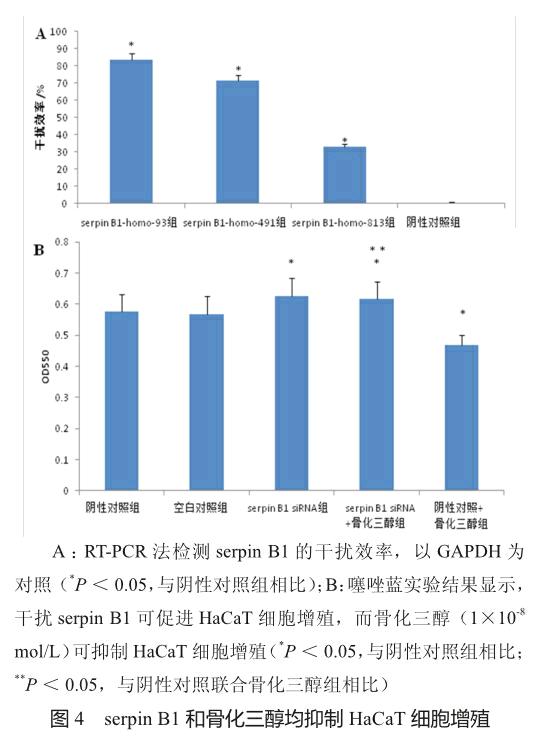

本研究也发现,serpin B1和骨化三醇均可抑制HaCaT细胞的增殖。serpin B1 siRNA可促进细胞周期由G1期向S期转化,而骨化三醇则抑制由G1期向S期转化。如果骨化三醇诱导的serpin B1对其产生细胞增殖抑制作用至关重要,那么干扰serpin B1将使骨化三醇对细胞增殖的影响消失。为验证该假设,对阴性对照联合骨化三醇组和serpin B1 siRNA联合骨化三醇组进行了比较研究,发现在serpin B1被干扰后,骨化三醇也不能产生细胞增殖抑制作用了。即:骨化三醇是通过上调serpin B1的表达而产生抑制HaCaT细胞增殖作用的。serpin B1可能是骨化三醇治疗银屑病的有效作用靶点。
本研究仍存在不足,尚需进一步研究serpin B1对HaCaT细胞分化和凋亡的影响。此外,需进行serpin B1与银屑病相关性的体内研究。
总之,本研究显示,serpin B1在角质形成细胞中有表达,且其表达会在骨化三醇存在时上调。serpin B1可抑制角质形成细胞增殖,在骨化三醇治疗寻常型银屑病中起着重要作用。
参考文献
[1] Lowes MA, Bowcock AM, Krueger JG. Pathogenesis and therapy of psoriasis [J]. Nature, 2007, 445(7130): 866-873.
[2] Rocha-Pereira P, Santos-Silva A, Rebelo I, et al. The inflammatory response in mild and in severe psoriasis [J]. Br J Dermatol, 2004, 150(5): 917-928.
[3] Murphy G, Reich K. In touch with psoriasis: topical treatments and current guidelines [J]. J Eur Acad Dermatol Venereol, 2011, 25(Suppl 4): 3-8.
[4] Sch?n M, Denzer D, Kubitza RC, et al. Critical role of neutrophils for the generation of psoriasiform skin lesions in flaky skin mice [J]. J Invest Dermatol, 2000, 114(5): 976-983.
[5] Rizova E, Corroller M. Topical calcitriol — studies on local tolerance and systemic safety [J]. Br J Dermatol, 2001, 144(Suppl 58): 3-10.
[6] Wiedow O, Wiese F, Christophers E. Lesional elastase activity in psoriasis. Diagnostic and prognostic significance [J]. Arch Dermatol Res, 1995, 287(7): 632-635.
[7] Reeves EP, Lu H, Jacobs HL, et al. Killing activity of neutrophils is mediated through activation of proteases by K+ flux [J]. Nature, 2002, 416(6878): 291-297.
[8] Birrer P. Proteases and antiproteases in cystic fibrosis: pathogenetic considerations and therapeutic strategies [J]. Respiration, 1995, 62(Suppl 1): 25-28.
[9] Vandivier RW, Fadok VA, Hoffmann PR, et al. Elastasemediated phosphatidylserine receptor cleavage impairs apoptotic cell clearance in cystic fibrosis and bronchiectasis[J]. J Clin Invest, 2002, 109(5): 661-670.
[10] Benarafa C, Remold-ODonnell E. The ovalbumin serpins revisited: perspective from the chicken genome of clade B serpin evolution in vertebrates [J]. Proc Natl Acad Sci U S A, 2005, 102(32): 11367-11372.
[11] Terui T, Ozawa M, Tagami H. Role of neutrophils in induction of acute inflammation in T-cell-mediated immune dermatosis, psoriasis: a neutrophil-associated inflammation-boosting loop[J]. Exp Dermatol, 2000, 9(1): 1-10.
[12] Orem A, De?er O, ?imsit G, et al. Plasma polymorphonuclear leukocyte elastase levels and its relation to disease activity in psoriasis [J]. Clin Chim Acta, 1997, 264(1): 49-56.
[13] Meyer-Hoffert U, Wingertszahn J, Wiedow O. Human leukocyte elastase induces keratinocyte proliferation by epidermal growth factor receptor activation [J]. J Invest Dermatol, 2004, 123(2): 338-345.
[14] Yang X, Yan H, Zhai Z, et al. Neutrophil elastase promotes proliferation of HaCaT cell line and transwell psoriasis organ culture model [J]. Int J Dermatol, 2010, 49(9): 1068-1074.
[15] Kuijpers AL, Zeeuwen PL, de Jongh GJ, et al. Skin-derived antileukoproteinase (SKALP) is decreased in pustular forms of psoriasis. A clue to the pathogenesis of pustule formation?[J]. Arch Dermatol Res, 1996, 288(11): 641-647.
[16] Barszcz D, Zarebska Z, Glińska-Ferenz M, et al. Alpha1-proteinase inhibitor in psoriasis: reduced activity in symptomfree patients and during flare [J]. Arch Dermatol Res, 1988, 280(4): 198-206.
[17] Gettins PG. Serpin structure, mechanism, function [J]. Chem Rev, 2002, 102(12): 4751-4804.
[18] Remold-ODonnell E. The ovalbumin family of serpin proteins [J]. FEBS Lett, 1993, 315(2): 105-108.
[19] Meyer-Hoffert U. Reddish, scaly, and itchy: how proteases and their inhibitors contribute to inflammatory skin diseases[J]. Arch Immunol Ther Exp (Warsz), 2009, 57(5): 345-354.
[20] Sun LD, Cheng H, Wang ZX, et al. Association analyses identify six new psoriasis susceptibility loci in the Chinese population [J]. Nat Genet, 2010, 42(11): 1005-1009.
[21] Lu J, Goldstein KM, Chen P, et al. Transcriptional profiling of keratinocytes reveals a vitamin D-regulated epidermal differentiation network [J]. J Invest Dermatol, 2005, 124(4): 778-785.
[22] Benarafa C, Cooley J, Zeng W, et al. Characterization of four murine homologs of the human ov-serpin monocyte neutrophil elastase inhibitor MNEI (SERPINB1) [J/OL]. J Biol Chem, 2002, 277(44): 42028-42033 [2016-02-15]. http:// www.jbc.org/content/277/44/42028.full.pdf+html.
[23] Yasumatsu R, Altiok O, Benarafa C, et al. SERPINB1 upregulation is associated with in vivo complex formation with neutrophil elastase and cathepsin G in a baboon model of bronchopulmonary dysplasia [J]. Am J Physiol Lung Cell Mol Physiol, 2006, 291(4): L619-L627.
[24] Gong D, Farley K, White M, et al. Critical role of serpinB1 in regulating inflammatory responses in pulmonary influenza infection [J]. J Infect Dis, 2011, 204(4): 592-600.
[25] Benarafa C, LeCuyer TE, Baumann M, et al. SerpinB1 protects the mature neutrophil reserve in the bone marrow [J]. J Leukoc Biol, 2011, 90(1): 21-29.
[26] Benarafa C, Priebe GP, Remold-ODonnell E. The neutrophil serine protease inhibitor serpinb1 preserves lung defense functions in Pseudomonas aeruginosa infection [J]. J Exp Med, 2007, 204(8): 1901-1909.
[27] Woods DE, Cantin A, Cooley J, et al. Aerosol treatment with MNEI suppresses bacterial proliferation in a model of chronic Pseudomonas aeruginosa lung infection [J]. Pediatr Pulmonol, 2005, 39(2): 141-149.
[28] Rees DD, Rogers RA, Cooley J, et al. Recombinant human Monocyte/Neutrophil elastase inhibitor protects rat lungs against injury from cystic fibrosis airway secretions [J]. Am J Respir Cell Mol Biol, 1999, 20(1): 69-78.
[29] Uchiyama K, Naito Y, Takagi T, et al. Serpin B1 protects colonic epithelial cell via blockage of neutrophil elastase activity and its expression is enhanced in patients with ulcerative colitis [J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(10): G1163-G1170.
[30] Cooley J, Sontag MK, Accurso FJ, et al. SerpinB1 in cystic fibrosis airway fluids: quantity, molecular form and mechanism of elastase inhibition [J]. Eur Respir J, 2011, 37(5): 1083-1090.
[31] Remold-ODonnell E, Chin J, Alberts M. Sequence and molecular characterization of human monocyte/neutrophil elastase inhibitor [J]. Proc Natl Acad Sci U S A, 1992, 89(12): 5635-5639.

