3,5-二硝基水杨酸法测定樟芝中多糖的含量
王鹏亭,赵宗杰,,周荣灵,张向阳,谢海涛,*(.深圳市仁泰生物科技有限公司,广东深圳58047;.香港中医科学院,香港999077)
3,5-二硝基水杨酸法测定樟芝中多糖的含量
王鹏亭1,赵宗杰1,2,周荣灵2,张向阳2,谢海涛1,*
(1.深圳市仁泰生物科技有限公司,广东深圳518047;2.香港中医科学院,香港999077)
摘要:建立樟芝粗多糖的含量测定方法。以葡萄糖为对照品,采用3,5-二硝基水杨酸比色法,测定樟芝中还原糖和总糖的含量,并计算出总多糖的含量。研究结果表明多糖含量在0.25 mg/mL~1.00 mg/mL范围内标准曲线具有良好的线性关系,测得回归方程y=0.5979x-0.0378(R2=0.9996)。还原糖和总糖的平均加样回收率分别为101.65%(RSD=1.89%)和100.92%(RSD=2.45%)。樟芝中总多糖含量为129.5mg/g~148.1mg/g。本方法灵敏、稳定、重复性好,有助于樟芝质量控制方法的研究。
关键词:樟芝;多糖;3,5-二硝基水杨酸比色法
樟芝(Antrodia cinnamonea)为原产于台湾的珍贵药用真菌[1],樟芝含有多种生物活性物质,具有保肝、抗肿瘤、抗氧化、免疫调节、解毒、抗炎等功效[2-4],有很高的药用价值,因其子实体的生长只依赖于台湾保护树种——牛樟树,故野生采集的樟芝数量远不能满足人们对樟芝的需求,从而限制了其发展,近年来,樟芝深层液体发酵的研究进展迅速[5],逐渐成为国内外研究和开发的热点。
樟芝的生理活性物质以多糖类和三萜类化合物为主[6-7]。多糖类一般的测定方法是运用苯酚-浓硫酸法、蒽酮-硫酸法和3,5-二硝基水杨酸比色法(简称DNS法)[8-10]。比色法中,前两种方法只能测定总糖含量而不能分别测出单糖与多糖的含量。与之相比,DNS法的特点是在偏碱性条件下可以分别与初始还原糖及多糖水解后的总还原糖发生显色反应,故可以准确测定初始还原糖与总还原糖的含量从而计算出多糖类成分的含量[11]。目前为止,鲜见关于采用DNS法测定樟芝中多糖含量的文献报道。本研究首次建立DNS法测定樟芝中水溶性多糖的含量,并做了相应的方法学考察研究。
1 材料与仪器
1.1仪器
BSA224S分析天平:赛多利斯;H2050R台式高速冷冻离心机:湖南湘仪;HWS24电热恒温水浴锅:上海一恒;T6新世纪紫外可见分光光度计:北京普析通用。
1.2试剂与材料
DNS试剂的配制:将6.3 g DNS和2 mol/L氢氧化钠溶液262 mL加到500 mL含有182 g酒石酸钾钠的热水溶液中,加5 g重蒸苯酚和5 g无水亚硫酸钠,搅拌溶解,冷却后移入1 000 mL容量瓶,用蒸馏水定容至刻度,混匀,贮于棕色瓶中,于暗处放置7 d后使用。
1 mg/mL葡萄糖标准溶液:精密称取在105℃干燥至恒重的葡萄糖对照品100 mg,置100 mL容量瓶中,加蒸馏水使溶解,定容至刻度,摇匀备用。
材料:樟芝菌丝体(深圳市仁泰生物科技有限公司发酵所得),使用前50℃~60℃烘至恒重,粉碎至粉末,置干燥器中备用。
1.3方法
1.3.1DNS法的原理[11]
DNS法的原理是3,5-二硝基水杨酸在中性或偏碱性条件下与多糖水解的还原糖共热后被还原成棕红色的3-氨基-5-硝基水杨酸,在一定范围内,还原糖的量和反应液的颜色呈正比。
1.3.2检测波长的确定
精密量取葡萄糖标准溶液和蒸馏水各1.0 mL,分别加入到25 mL具塞试管中,各加入DNS试剂2 mL,混合均匀后沸水浴加热5min,迅速流水冷却,加水定容至25mL,将葡萄糖显色液+蒸馏水(空白)、DNS试剂+蒸馏水(空白)、葡萄糖显色液+DNS试剂(空白)3组溶液分别在波长为360 nm~600 nm范围内进行扫描。
1.3.3显色剂用量的确定
精密量取1 mL葡萄糖标准溶液分别加入到编号为1~7的25 mL具塞试管中,补水至2 mL,分别加入1、1.5、2、2.5、3、3.5、4 mL DNS试剂,沸水浴加热5 min,迅速流水冷却,定容至25 mL,在540 nm波长下测定吸光度值。
1.3.4显色时间的确定
精密量取1 mL葡萄糖标准液分别加入到编号为1~9的25 mL具塞试管中,补水至2 mL,各加入2 mL DNS试剂,分别在沸水浴中加热2、3、4、5、6、7、8、10、12、15、20 min,迅速流水冷却,定容至25 mL,在540 nm波长下测定吸光度值。
1.3.5标准曲线绘制
精密量取葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL,分别置于25 mL具塞试管中,补水至2 mL,加入DNS试剂2 mL,混合均匀后,沸水浴5 min,迅速流水冷却,加水至刻度线。空白调零,以葡萄糖含量为横坐标,吸收度为纵坐标,绘制标准曲线。
1.3.6供试品溶液的制备
精密称取樟芝菌丝体粉2.0 g,置250 mL蒸馏瓶中,加蒸馏水60 mL,90℃热水浸提2 h,4 000 r/min离心10 min,取上清,加入200 mL 95%乙醇,充分振摇混匀,置冰箱中冷藏放置过夜。将冷藏过夜后的溶液移至离心管中4 000 r/min离心10 min,残渣用95%乙醇洗涤3次,每次20 mL。将酒精洗涤后的残渣用蒸馏水溶解,移入100 mL容量瓶中,加蒸馏水定容至刻度,摇匀,备用。
1.3.7还原糖供试品溶液的制备
按1.3.6方法制备,即得牛樟芝菌丝体还原糖供试品溶液。
1.3.8总糖供试品溶液的制备
精密量取步骤1.3.6所制备的供试品溶液10 mL,置锥形瓶中,加10 mL 6 mol/L HCl溶液,封口,于沸水浴中加热30 min,流水冷却至室温,加一滴酚酞指示剂,用6 mol/L NaOH溶液滴定至溶液初呈淡红色,将溶液移入50 mL容量瓶中,加蒸馏水定容至刻度,摇匀,即得牛樟芝菌丝体总糖供试品溶液。
1.3.9样品测定
精密量取步骤1.3.7和1.3.8所制备的还原糖、总糖供试品溶液各2 mL,分别置于25 mL的具塞试管中,将对照组补水至2 mL,各加入DNS试剂2 mL,混合均匀后,沸水浴5 min,迅速流水冷却,加水至刻度,摇匀,按照分光光度法[2005年版《中华人民共和国药典》(一部)附录VA]在540 nm波长处分别测定吸光度值,计算出样品中总糖及还原糖的质量。按下式计算样品中多糖的百分含量(用0.9的系数校正)[12]。

2 结果与分析
2.1检测波长的选择
关于DNS法测定波长的选择一直存在着争论,众多文献选定的最佳波长及其确定依据也各不相同,为了确定DNS法在测定牛樟芝多糖过程中的最佳波长,将相关因素进行波谱扫描结果见图1。
由图1中葡萄糖显色液+DNS试剂曲线可以看出,最大吸光度值处的波长为490 nm,为了提高检测灵敏度,通常情况下应该选择吸光度值最大处的波长,但是由于DNS试剂在490 nm处有较大的吸收,且显色期间由于部分DNS试剂与待测液中还原糖相结合,消耗了部分DNS试剂,从而造成测定吸光度时,作为空白参照的溶液中DNS试剂含量大于葡萄糖显色液中DNS试剂含量,致使检测结果比真实值偏低,因此检测波长不选490 nm。所以最大吸收波长并非最佳工作波长,根据“吸收最大,干扰最小”原则从图1还可以看出,DNS显色剂+蒸馏水在波长≤520 nm时,都有一定的吸光度值,而在530 nm以后,DNS试剂+蒸馏水的吸光值接近于0,故本试验最终确定的测定波长选为540 nm。
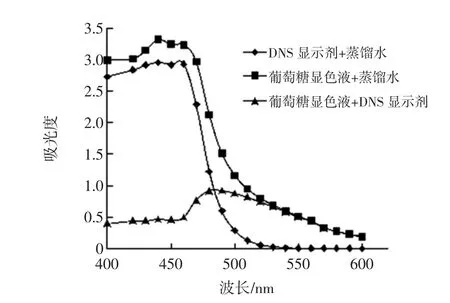
图1 葡萄糖溶液吸收光谱图Fig.1 The absorption spectrum with glucose solution
2.2显色剂用量的确定
DNS显色剂用量的确定应在不影响吸光度值的前提下取最小体积为最优选,取不同体积DNS显色剂进行试验结果见图2。
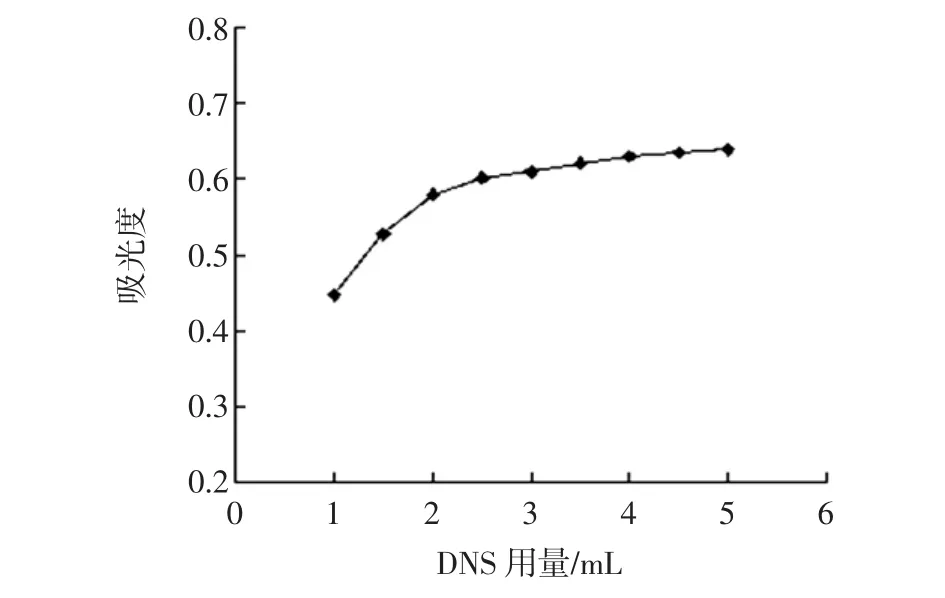
图2 不同显色剂用量的吸光度值Fig.2 The absorption determination with different DNS dosage
由图2可以看出,当DNS显色剂用量在2 mL以内时,随着DNS试剂用量的增加,吸光度值增大,且浮动较大,当DNS用量在2 mL~5 mL时,吸光度值比较稳,增长缓慢,浮动较小。因此,为了减小DNS试剂对吸光度值测定的影响,DNS试剂的用量不应该小于2.0 mL,故本试验DNS试剂用量选择2.0 mL。
2.3显色时间的确定
最佳显色时间的确定,应在满足吸光度值处于稳定期后最短用时为最优选,这样既可以提高检测效率又可以降低能耗,取不同加热时间进行试验结果见图3。

图3 不同沸水浴加热时间的吸光度值Fig.3 The absorption determination with different boiling water bath time
由图3可以明显看出,当沸水浴加热时间在5 min内时,随着水浴时间的增长,吸光度值增大。当沸水浴加热时间增加到5 min后,吸光度值变化趋于稳定,说明显色反应在沸水浴加热5 min时既已全部完成,故选择5 min作为最佳显色反应时间。
2.4标准曲线的制备
用葡萄糖标准溶液制备标准曲线,以葡萄糖含量为横坐标,吸光度为纵坐标,绘制出标准曲线,结果见图4。

图4 葡萄糖标准曲线Fig.4 The standard curve of glucose
从图4中可以看出,葡萄糖的含量和相应的吸光度值之间有一定的线性关系,其回归方程为:y=0.597 9x-0.037 8,R2=0.999 6,线性关系良好。为了提高反应的显色灵敏度和稳定性,DNS显色剂中加有酒石酸钾钠,但酒石酸钾钠却减弱了亚硫酸钠对还原糖的保护作用,从而造成部分葡萄糖的破坏而不显色,故当葡萄糖浓度≤0.2 mg/mL时,其吸光度值要低于真实数值。该标准曲线表明,葡萄糖浓度在0.25 mg/mL~1.00 mg/mL之间显色灵敏、稳定且线性良好。
2.5方法学考察
2.5.1精确度试验
取同一组还原糖供试品溶液连续测定10次,其吸光度值分别为0.172、0.172、0.173、0.172、0.174、0.173、0.173、0.174、0.172、0.173,其数值相对标准偏差RSD= 0.456%,说明仪器精确度良好。
取同一组总糖供试品溶液连续测定10次,其吸光度值分别为0.772、0.772、0.775、0.773、0.772、0.773、0.773、0.773、0.774、0.773,其数值相对标准偏差RSD= 0.122%,说明仪器精确度良好。
2.5.2重复性试验
取同一批样品5份,按1.3.7制备还原糖供试品溶液,依法测定,计算还原糖含量分别为0.96%、0.88%、 0.92%、0.93%、0.92%,还原糖平均含量为0.92%,RSD=3.11%(n=5),说明本方法测定还原糖的重复性好。
取同一批样品5份,按1.3.8制备总糖供试品溶液,依法测定,计算总糖含量分别为15.70%、16.85%、16.12%、15.96%、16.43%,总糖平均含量为16.21%,RSD=2.74%(n=5),说明本方法测定总糖的重复性好。
2.5.3稳定性试验
分别精密量取还原糖、总糖供试品溶液2 mL,按样品测定方法测定,显色反应完成后0~2 h内每隔10 min测定1次,结果见表1。
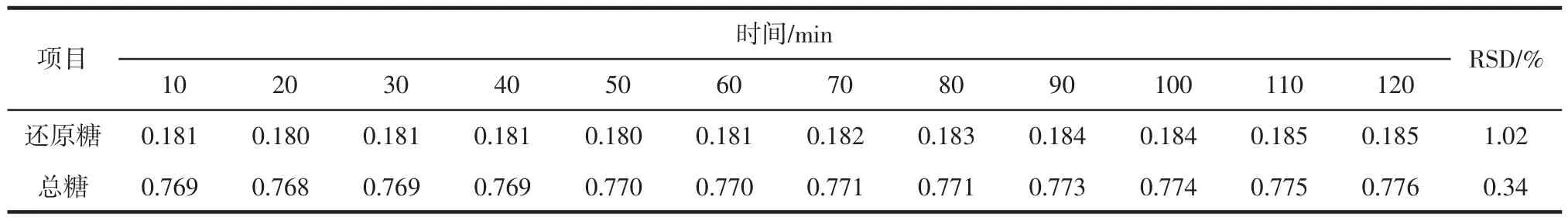
表1 稳定性试验结果Table 1 The results of the stability test
由表1可知,还原糖及总糖供试品在0~2 h内吸光度值基本稳定不变,说明还原糖、总糖供试品溶液经显色反应后在2 h内都是稳定的。
2.5.4加样回收率试验
5批樟芝菌丝体粉样品各取一份,每份约2.0 g,精密称定,按供试品溶液制备方法制备供试品溶液,分别取还原糖、总糖供试品溶液2 mL,分别准确加入无水葡萄糖对照品适量。分别测定各组样品溶液加样前后还原糖含量及总糖含量,计算回收率,见表2。

表2 样品加样回收率试验结果Table 2 The results of recovery test(n=5)
由表2可知,还原糖供试液和总糖供试液的平均加样回收率分别为101.65%和100.92%,它们的RSD分别为1.89%和2.45%。这说明,该方法中还原糖和总糖的回收性良好。
2.5.5样品含量测定
5批樟芝菌丝体粉测定结果见表3。

表3 5批樟芝样品含量测定结果Table 3 The results of 5 batches of AC sample content test
经5批样品含量测定结果表明,樟芝菌丝体粉中多糖含量为129.5 mg/g~148.1 mg/g。5个批次的樟芝菌丝体为深圳市仁泰生物科技有限公司樟芝联合实验室发酵所得。
3 讨论
通常选用苯酚-硫酸法或硫酸-蒽酮比色法进行总糖测定。由于这两种方法只能测定样品中的总糖含量,对多糖的纯度要求较高,若样品纯化不彻底,单糖去除不完全,则会使测定结果偏高。而DNS法测定多糖含量可排除单糖带来的误差,目前为止,鲜见关于采用DNS法测定樟芝多糖含量的相关报道。本试验为首次建立DNS法测定樟芝中水溶性多糖的含量,所建立的方法经方法学考察结果表明,具有重复性好、安全简便、准确灵敏等特点。
参考文献:
[1]Chang T T,Chou W N. Antrodia cinnamomea sp.nov. on Cinnamomum kanehirai in Taiwan[J]. Mycol.Res,1995,99(6):756-758
[2]浦跃武,熊冬生.樟芝的研究及其应用现状[J].中国医院药学杂志,2005,25(2):171-173
[3]Fa K N,Yang C M,Chen P C,et al. Anti-metastatic effects of antrodan,the Antrodia cinnamomea mycelia glycoprotein,in lung carcinoma cells[J]. International Journal of Biological Macromolecules,2015(74):476-482
[4]Tsai T C,Tung Y T,Kuo Y H,et al. Anti-inflammat- ory effects of Antrodia camphorata,a herbal medicine,in a mouse skin ischemia model[J]. Journal of Ethno-pharmacology,2015(159):113-121
[5]Zhang H,Xia Y J,Wang Y L,et al. Coupling use of surfactant and in situ extractant for enhanced producti-on of Antrodin C by submerged fermentation of Antr-odia camphorata[J]. Biochemical Engineering Journal,2013,79(2):194-199
[6]Lu M C,Mohamed El-Shazly,Wu T Y,et al. Recent research and development of Antrodia cinnamomea[J]. Ph-armacology & Therapeutics,2013,139(2):124-156
[7]陈菲,刘训红,杨念云,等.樟芝的研究概述[J].中药材,2011,34 (11):1804-1808
[8]郭晓蕾,朱思潮,翟旭峰,等.硫酸蒽酮法与硫酸苯酚法测定灵芝多糖含量比较[J].中华中医药学刊,2010,28(9):2000-2002
[9]李强,唐微,石园园,等.蒽酮-硫酸法和3,5-二硝基水杨酸法测定杜仲提液多糖含量[J].食品工业科技,2010,31(10):370-374
[10]刘华,周堃,贾薇,等.药用真菌樟芝菌丝体多糖提取工艺及活性的研究[J].食品科学,2007,28(6):243-245
[11]宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1998:9
[12]张维杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994:10-12
Determination of Polysaccharide in Antrodia cinnamonea by 3,5- Dinitrosalicylic Acid Colorimeitry
WANG Peng-ting1,ZHAO Zong-jie1,2,ZHOU Rong-ling2,ZHANG Xiang-yang2,XIE Hai-tao1,*
(1. Shenzhen Rentai Biological Technology Co.,Ltd,Shenzhen 518047,Guangdong,China;2. Hong Kong Chinese Medical Science Academy,Hongkong 999077,China)
Abstract:A method for the determination of polysaccharide in Antrodia cinnamonea(AC)was developed.To calculate the total polysaccharide content with the reducing sugar and total sugar content that was detemined by 3,5- dinitrosalicylic acid colorimeitry with glucose as the standard substance. The results showed that:The calibration curve of polysaccharide was in good linearity over the range of 0.25 mg/mL-1.00 mg/mL,the regression equation was y=0.597 9x-0.037 8(R2=0.999 6).The average recovery of reducing sugar solution and total sugar solution in the test were 101.65%with RSD,1.89%and 100.92%with RSD,2.45%respectively.The polysaccharide content of AC was 129.5 mg/g-148.1 mg/g.The method which can be used for the quality control of AC is convenient,accurate and sensitive with good reproducibility.
Key words:Antrodia cinnamonea;polysaccharide;3,5-dinitrosalicylic acid colorimeitry
DOI:10.3969/j.issn.1005-6521.2016.09.038
基金项目:深圳市战略新兴产业发展专项资金项目(CYZZ2013041 6170923767)
作者简介:王鹏亭(1984—),男(汉),工程师,硕士,主要从事药用真菌有效成分的提取及药效学研究。
*通信作者:谢海涛,男(汉),硕士,主要从事樟芝的现代化研究。
收稿日期:2015-03-16

