发菜细胞培养的研究进展
韩培培,贾士儒
(工业发酵微生物教育部重点实验室,天津食品安全低碳制造协同创新中心,天津科技大学生物工程学院,天津 300457)
发菜细胞培养的研究进展
韩培培,贾士儒
(工业发酵微生物教育部重点实验室,天津食品安全低碳制造协同创新中心,天津科技大学生物工程学院,天津 300457)
摘 要:传统食材发菜是一种受国家一级保护的珍稀陆生蓝细菌,具有较高的营养价值、药用价值和重要的生态学作用,为了实现发菜生物资源的可持续利用,发菜的人工培养研究已广泛开展.本文对近年来发菜细胞培养的研究,从发菜细胞的分离、不同模式的液体培养、发菜细胞的规模化培养以及发菜细胞的固态培养等方面进行了综述,并提出了进一步的研究思路.
关键词:发菜;细胞培养;液体培养
数字出版日期:2016-03-02;数字出版网址:http://www.cnki.net/kcms/detail/12.1355.N.20160302.1746.006.html.
发菜,学名发状念珠蓝细菌(Nostoc flagelliforme),又名发状念珠藻,是一种生长在荒漠、半荒漠地带的陆生性蓝细菌(蓝藻),其分布具有很强的地域性,在我国主要分布在宁夏、内蒙古及甘肃部分地区.其藻体呈黑色,贴附于地表,缠绕成团,因其外观与人的头发相似,故人们将其称为“发菜”.发菜具有很强的固氮能力,对于光胁迫具有很强的抗性,对高温、低温、变温条件均表现出了惊人的适应能力.发菜在生长过程中分泌的胞外多糖可黏结土壤颗粒形成结皮,对于干旱荒漠带土壤的水土保持具有重要的意义,被列为国家一级重点保护植物[1].食用发菜已有上千年历史,由于发菜与“发财”谐音,并具有一定的营养价值和药用价值而备受关注.近年来发菜多糖已被证明具有广泛的生理活性,从野生发菜中提取的酸性多糖(nostoflan)对流感病毒、人巨细胞病毒和单疱疹病毒等多种具有封套的病毒有很强的抗性[2-3].发菜中所含的多糖具有增强机体免疫力的能力,实验证明发菜水抽提物具有抗肿瘤活性和能够增加唾液中分泌型免疫球蛋白A(secretory immunoglobulin A,S-IgA)浓度,进而能够改善花粉敏感症状[4].研究还发现发菜多糖具有抑制癌细胞和增强免疫功能作用[1].
由于发菜在野生状态下生长缓慢,部分地区对发菜进行掠夺性采挖导致大量草场退化和土地荒漠化.从2000年7月起,我国禁止采集发菜,取缔发菜贸易.因此,发菜的人工培养不仅具有补充和保护发菜资源的生态价值,而且具有满足消费者需求的经济价值.自1982年起,为高效获得发菜这一生物资源,人们开始对发菜人工培养方法进行探索.
1 发菜原植体的人工培养
为高效率获取发菜,人们尝试了多种方法,早期的研究主要以原植体为研究对象(图1),将其复水活化后切成合适长度进行培养,模拟自然条件培养发菜原植体.在人工培养过程中外界水分是影响其繁殖的主要生态因子[5],但浸泡原植体会造成藻体结构由于附生微生物的分解作用而遭到破坏,而节律性供水能有效抑制野生发菜原植体附生微生物的活动[6].

图1 发菜原植体形态图Fig.1 The morphology of Nostoc flagelliforme thallus
在野生发菜室内人工培养的基础上,通过对种植地土壤状态、喷水量、水滴直径、空气湿度、蒸发量等指标和发菜耗水规律进行研究,并结合发菜对节律性供水的要求,目前大面积发菜原植体的人工培养已经实施,其流程为:制种—播种—供水—营养液喷施—采收,培养周期6~7个月.可选择与野生发菜生长地土壤相似的西北荒漠、半荒漠地区作为试验地,采用固定式微喷灌方式供水,选择合适的供水周期,以达到既有利于发菜生长,又可以节约水资源的目的,预计藻体的净产量可达到播种量的1倍以上[1].但此方法仍存在发菜生长缓慢、成本高、供水难、易受自然环境变化影响等问题.因此,野外条件下发菜的大规模培养仍然有许多困难需要克服.
2 发菜细胞的分离与培养
2.1发菜细胞的分离
虽然从1982年就已经开始对发菜原植体人工培养进行研究,但结果都不理想,并未真正意义上达到发菜人工培养的目的.这是因为发菜原植体的生长要求控制其干燥程度和无菌程度,否则原植体极易被细菌分解,并且原植体增重缓慢,而发菜的人工培养的目的不仅仅意味着原植体的增重和增长,更重要的是使藻丝体数量的增殖.发菜的胶质鞘结构在一定程度上限制了发菜细胞的生长.虽然可将发菜藻体作为培养对象进行栽培式试验,但仍无法摆脱自然环境的限制,难以实现商业化生产.为了提高发菜的生长速率,研究者尝试采用去除胶质鞘、从发菜藻体中分离出细胞或单体藻丝进行培养的方法[1].发菜藻细胞或单体藻丝的获得也使得利用已有的微藻产业化培养技术实现发菜细胞和代谢产物的工厂化生产成为可能.
获得和培养发菜细胞种是对发菜进行液体人工培养的前提.获得发菜单体细胞主要的方法是将原植体消毒后复水活化进行匀浆.野生发菜存在附生微生物[7],单一的纯化方法很难获得理想效果,需要多种方法联合使用.采用单细胞分离与抗生素法结合能实现发菜细胞纯培养,如图2和图3所示.抗生素法是藻种纯化过程中一种制备无菌藻种的有效方法[1],因为不同微生物对抗生素的敏感性存在差异,所以可以通过添加不同种类抗生素组合来去除细菌和杂藻.根据敏感性试验结果,纯化发菜单体细胞所用抗生素种类和剂量为氨苄青霉素(10,mg/L)、硫酸庆大霉素(1,mg/L)、硫酸卡那霉素(1,mg/L)、壮观霉素(1,mg/L)[8].

图2 发菜单体细胞的分离Fig.2 Isolation of Nostoc flagelliforme single cell
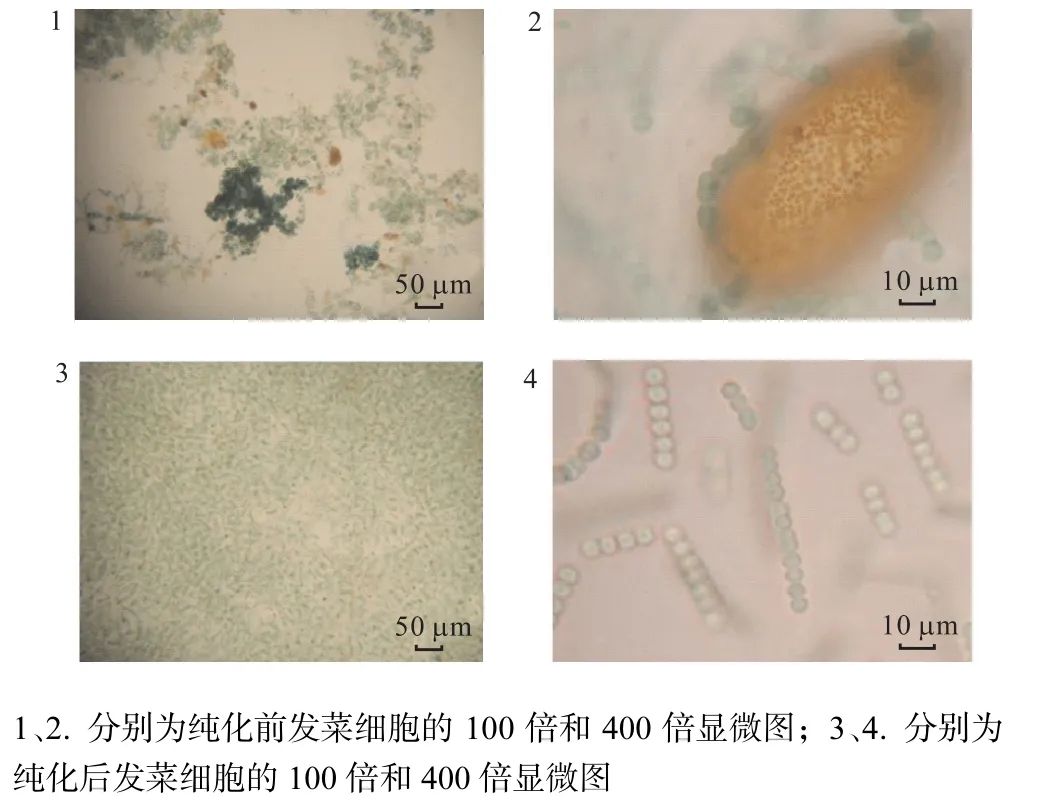
图3 发菜细胞纯化前后的显微镜观察Fig.3 Microscope observation of Nostoc flagelliforme culture before and after purification
2.2液体培养
发菜是典型的光合自养生物,可以在光照条件下固定CO2或碳酸盐,除此之外还可以以异养模式和混养模式生长.研究者对光合自养模式下发菜细胞形态、生长及产物进行了大量的研究工作[1],对发菜细胞的液体培养基成分[1]和培养条件如光照[9-10]、CO2浓度[11-12]、pH[13]等进行了优化,为发菜细胞液体培养提供了有价值的信息.虽然与野生发菜相比,自养模式下细胞生长速率提高了上千倍.但是,培养周期长、细胞密度低等导致的经济可行性低仍是阻碍发菜商业化生产的关键因素.为此,有必要探讨新的发菜细胞培养模式.
异养培养过程为在无光照的条件下,发菜利用培养基中添加葡萄糖等有机物作为碳源和能源,可达到高细胞密度,旨在降低下游成本.当BG-11培养基中添加葡萄糖、蔗糖、果糖、木糖时发菜均可以生长并产胞外多糖,通过比较4种有机物对于发菜细胞生物量和多糖产量的影响[1,14-15]可以发现,葡萄糖是发菜较为适宜的碳源.但当初始葡萄糖质量浓度达到4.0,g/L时,发菜生长速率反而下降,造成细胞生物量的降低.一种解决方法是使用混合碳源,可以将葡萄糖(4.0,g/L)和醋酸(2.0,g/L)作为混合碳源添加到BG-11培养基中,培养7,d时的细胞生物量最高可达到1.79,g/L,与仅用葡萄糖作碳源相比,细胞生物量有所提高.另一种方法是采用异养流加培养方法[1],即采用与分批培养相同的初始条件,在葡萄糖浓度接近系统效率最高时,开始流加葡萄糖,使得异养培养条件下获得高产量的发菜细胞和胞外多糖.
与异养培养相比,混合营养培养过程在添加有机物作为碳源的同时,还需要光照,所以混合营养培养又可以称为光异养培养.分别对发菜进行光合自养、异养和混养培养,在光合自养培养基中添加葡萄糖作为异养和混养培养基,在其他培养条件相同的情况下培养7,d,混养培养得到的最高细胞生物量明显高于光合自养和异养培养(见表1)[16].虽然混合培养的方法可以理解为光合自养和异养培养两种方法的综合,但在培养过程中可以发现,混合营养培养得到的细胞生物量并不等于两种情况下获得的细胞生物量的总和(表1),说明在发菜生长过程中光合作用和葡萄糖的氧化代谢间存在相互影响.
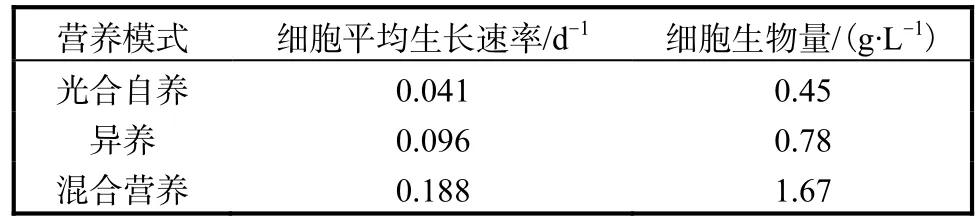
表1 不同营养模式下发菜细胞的生长速率及细胞生物量Tab.1 Growth rate and cell biomass of Nostoc flagelliforme in different nutritional mode
不同营养模式液体悬浮培养发菜细胞的基本生化组成、金属元素和胞外多糖组成等与野生发菜基本相似,只是各组分的相对含量有差异.混养培养虽然可以得到较高的细胞生物量,但由于其添加了有机物作为碳源,也增添了杂菌污染的风险.因此,为了进一步得到高浓度的发菜细胞生物量和胞外产物的同时防止杂菌污染,可采用两阶段培养法[1]:第一阶段采用光合自养培养,抑制杂菌生长,获得具有生长优势的高浓度发菜细胞生物量;第二阶段采用混养培养,在较高细胞生物量的基础上获得高产量胞外多糖.采用此方法培养发菜细胞16,d,多糖和发菜细胞产量分别为单一光合自养阶段结果的30倍和5.6 倍.发菜细胞具有异养和混合营养生长能力的证实,为发菜细胞高密度培养提供了基础数据,并为发菜细胞工业化生产提供了新思路.
3 发菜细胞的扩大培养
光合自养微藻的大规模培养一般可分为开放式培养系统和封闭式培养系统两大类.
开放式培养技术简单、应用广泛.在室内条件下,可在发菜细胞液体悬浮培养的基础上逐步放大发菜培养,进行开放培养.何茜[17]进行了25,L容积的开放式培养池实验,初步探究了培养发菜细胞所需要的光照周期、液位及通气量等实验条件.郭伟[18]则在不同放大培养规模和培养方式方面综合地对发菜细胞扩大培养进行了研究,采用5,L光生物反应器对发菜进行开放式和封闭式培养实验,结果表明增加光强并连续光照有利于发菜细胞生长和多糖积累,且封闭式培养效果较好.在25,L开放式培养池培养过程中,通过阶段性流加新鲜培养基和逐步提高光强的方法提高了发菜细胞生物量和多糖积累量.在室外条件下,藻类应用最多的为开放式跑道培养池培养方式(图4).通常跑道培养池中附有CO2补充系统,促进藻类对CO2的固定和生长.目前已在小规模跑道培养池中实现了发菜细胞的开放式培养[1].但与封闭式培养系统相比,开放式培养系统虽然结构较为简单、造价较低,但存在受环境影响大、易被杂菌或害虫污染、耗水量大等不足,对于种群竞争力弱的发菜来说需要综合考虑.

图4 开放式跑道培养池结构示意图Fig.4 Schematic diagram of open raceway pond
封闭式光生物培养系统(图5)克服了开放式培养系统的一些弊端,可以用于培养大多数生长条件温和、生长速率不快的藻种,但也存在着成本高等缺点.对于光合自养培养来说,在20,L光生物反应器进行循环培养会使营养元素不断消耗从而出现黄化现象,需要在循环培养过程中不断补加营养盐来维持发菜细胞生物量和多糖积累量在较高的水平.因此在室内进行大规模液体光合自养培养时,可以进行半连续培养,其中适时取出一定量的细胞并补充合适量的营养元素是此培养方法的关键.在培养过程中,搅拌通气为发菜细胞生长提供碳源CO2,有利于细胞生长,但是搅拌也会对发菜的链状形态产生影响,还影响荚膜多糖(形成胶囊或黏液层多糖)和胞外多糖(释放到液体培养基中多糖)的比例[19],因此搅拌的控制对细胞大规模培养及多糖的生产提供了新思路.
对于混养培养来说,两阶段培养同样适用于发菜细胞培养及其多糖制备工艺的放大[1].在80,L气升式光反应器中,与单阶段培养相比,两阶段培养不仅减少了染菌的隐患,而且显著地提高了细胞的生长速率及多糖的合成效率.户外条件下,采用液体悬浮培养方式,通过控制培养液pH、流量、温度等条件,实现了在160,L和300,L管式光生物反应器(外径分别为50,mm和110,mm)中发菜细胞的扩大培养[20].实验结果与室内80,L气升式光生物反应器相比较, 细胞生物量、藻粉中蛋白质含量和荚膜多糖含量均高于室内气升式光生物反应器,证明管式光生物反应器适宜于培养发菜细胞,具有可行性,为发菜户外大规模培养的实现提供了基础数据;但同时受自然条件如光照、温度等影响较大,培养条件需要进一步探索.

图5 管式光生物反应器结构示意图Fig.5 Schematic diagram of tubular photobioreactor
4 发菜细胞的固态培养
发菜为陆生固氮蓝藻,人工培养的最理想结果是实现在干旱荒漠地区实现发菜的低成本大规模种植.液态培养的发菜在一定失水条件下仍具有较高的光合速率,对干旱环境仍有较高的耐受力,使得其仍然可以作为陆地培养的“种子”.因此对其固态培养的研究有利于未来进行野外种植,对改良荒漠化生态环境具有重要意义.光强、固体基质种类和湿润程度等因素都会对发菜细胞的发育形态和聚集状态有重要影响.Chen等[21-22]选取粗沙、PA6和玻璃渣作为固态培养基质,对比发菜细胞的固态培养基及其生长状态,结果表明:虽然玻璃碎渣和PA6湿润性较好,但粗沙更利于发菜细胞的生长.进一步研究结果表明:沙粒粒度大小也对发菜生长速度有影响,细沙增速高于粗沙,并能形成生物结皮(图6).但在实验条件下,发菜细胞在固体培养基上形成团状群落而不像自然条件下形成丝状[1],形成的生物结皮具有一定的透水性和保水性,说明发菜对提高土壤质量、固定沙粒、减缓沙漠化有着重要作用,为发菜的人工培养实现野外种植提供了基础数据.

图6 接种发菜细胞的沙粒与对照比较Fig.6 Comparison of sand inoculated with and without Nostoc flagelliforme
5 展 望
综上所述,对于发菜细胞人工培养,无论实验室规模的研究还是室外大规模实践都已取得了一定的进展,对发菜细胞的生长状态、生长条件、产物生产条件等方面都有了进一步的认识,这些都为未来发菜工业化培养提供了宝贵的数据.但是,许多问题依然存在并需要解决,如发菜的抗逆性机理、高密度快速培养发菜细胞条件优化以及固体培养天然丝状结构的重建等都还需要进行深入研究.可借助现代生物技术加强对发菜生长中关键代谢途径、关键酶以及关键产物生产机理等的研究,以期望推动发菜工业化生产,保护生态环境,满足消费者需求.
参考文献:
[1] 贾士儒,韩培培,戴玉杰,等. 发菜细胞培养[M]. 北京:科学出版社,2014.
[2] Kanekiyo K,Lee J B,Hayashi K,et al. Isolation of an antiviral polysaccharide,nostoflan,from a terrestrial cyanobacterium,Nostoc flagelliforme[J]. Journal of Natural Products,2005,68(7):1037-1041.
[3] Kanekiyo K,Hayashi K,Takenaka H,et al. Anti-herpes simplex virus target of an acidic polysaccharide,nostoflan,from the edible blue-green alga Nostoc flagelliforme[J]. Biological & Pharmaceutical Bulletin,2007,30(8):1573-1575.
[4] 竹中裕行,木神節子,山口裕司,等. 食用蓝藻·髮菜(Nostoc flagelliforme)熱水エキスのの粘膜免疫(唾液分泌型IgA)に及ぼす影響[J]. 医学と生物学,2010,154(5):258-260.
[5] 华振基,王俊,孙建芸,等. 发菜生物学特性及其人工栽培途径的的研究:Ⅲ. 发菜繁殖机制的初步研究(形态学部份)[J]. 宁夏农学院学报,1994,15(2):19-22.
[6] 梅俊学,程子俊. 供水和光照对发菜生理活性的影响[J]. 西北师范大学学报:自然科学版,1989(1):63-68.
[7] Han Peipei,Shen Shigang,Jia Shiru,et al. Comparison of bacterial community structures of terrestrial cyanobacterium Nostoc flagelliforme in three different regions of China using PCR-DGGE analysis[J]. World Journal of Microbiololy & Biotechnology,2015,31(7):1061-1069.
[8] Han Peipei,Jia Shiru,Sun Ying,et al. Metabolomic approach to optimizing and evaluating antibiotic treatment in the axenic culture of cyanobacterium Nostoc flagelliforme[J]. World Journal of Microbiology & Biotechnology,2014,30(9):2407-2418.
[9] 苏建宇,何茜,贾士儒. 液体悬浮培养条件下发菜细胞的光合速率和呼吸速率[J]. 植物生理学通讯,2006,42(3):417-420.
[10] Gao Kunshan,Yu Aijun. Influence of CO2,light and watering on growth of Nostoc flagelliforme mats[J]. Journal of Applied Phycology,2000,12(2):185-189.
[11] Qiu Baosheng,Gao Kunshan. Daily production and photosynthetic characteristics of Nostoc flagelliforme grown under ambient and elevated CO2conditions[J]. Journal of Applied Phycology,2002,14(2):77-83.
[12] Lü Hexin,Jia Shiru,Xiao Yupeng. Growth characteristics of Nostoc flagelliforme at intermittent elevated CO2concentrations[J]. Phycological Research,2014,62(4):250-256.
[13] 雍华伟. 发状念珠藻在不同pH生长状态下的蛋白质组学分析[D]. 上海:上海师范大学,2014.
[14] Yu Haifeng,Jia Shiru,Dai Yujie. Accumulation of exopolysaccharides in liquid suspension culture of Nostoc flagelliforme cells[J]. Applied Biochemistry and Biotechnology,2010,160(2):552-560.
[15] Yu Haifeng. Effect of mixed carbon substrate on exopolysaccharide production of cyanobacterium Nostoc flagelliforme in mixotrophic cultures[J]. Journal of Applied Phycology,2012,24(4):669-673.
[16] Yu Haifeng,Jia Shiru,Dai Yujie. Growth characteristics of the cyanobacterium Nostoc flagelliforme in photoautotrophic,mixotrophic and heterotrophic cultivation[J]. Journal of Applied Phycology,2009,21(1):127-133.
[17] 何茜. 发菜细胞开放式培养技术的初步研究[D]. 天津:天津科技大学,2006.
[18] 郭伟. 发状念珠藻不同培养方式及多糖分离纯化研究[D]. 天津:天津科技大学,2010.
[19] Su Jianyu,Jia Shiru,Chen Xuefeng,et al. Morphology,cell growth,and polysaccharide production of Nostoc flagelliforme in liquid suspension culture at different agitation rates[J]. Journal of Applied Phycology,2008,20(3):213-217.
[20] 肖玉朋,戴玉杰,申世刚,等. 户外管式光生物反应器培养发状念珠藻细胞[J]. 食品科技,2014,39(3):2-6.
[21] Chen Xuefeng,Jia Shiru,Yue Sijun,et al. Effect of solid bed-materials on vegetative cells of Nostoc flagelliforme [J]. Journal of Applied Phycology,2010,22(3):341-347.
[22] Chen Xuefeng,Jia Shiru,Wang Yue,et al. Biological crust of Nostoc flagelliforme(cyanobacteria)on sand bed materials[J]. Journal of Applied Phycology,2011,23(1):67-71.
责任编辑:郎婧
Research Progress in Cell Culture of Nostoc flagelliforme
HAN Peipei,JIA Shiru
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,Tianjin Food Safety & Low Carbon Manufacturing Collaborative Innovation Center,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Abstract:The traditional food Nostoc flagelliforme,a national level protected plant,is a valuable terrestrial cyanobacteria,which has high nutritional,medicinal and ecological values.To realize the sustainable use of biological resources,extensive research on artificial culture of N.flagelliforme has been carried out.The recent research progress in cell culture of N.flagelliforme,including isolation of N.flagelliforme cells,different modes of liquid culture,large-scale cultivation of N.flagelliforme cells,and solid culture,was reviewed in this paper,and further research suggestions were also put forward.
Key words:Nostoc flagelliforme;cell culture;liquid culture
中图分类号:Q93
文献标志码:A
文章编号:1672-6510(2016)02-0001-05
收稿日期:2015-11-05;修回日期:2015-12-24
基金项目:国家自然科学基金资助项目(31201405)
作者简介:韩培培(1983—),女,山东人,副教授;通信作者:贾士儒,教授,jiashiru@tust.edu.cn.
DOI:10.13364/j.issn.1672-6510.20150193

