一管法MLPA荧光探针溶解曲线分析技术检测15种高危型HPV方法的建立*
张肄鹏, 张惠玲, 张 青, 黄 珍, 刘卫东, 周丽英
(深圳市龙华新区中心医院, 深圳 广东 518110)
一管法MLPA荧光探针溶解曲线分析技术检测15种高危型HPV方法的建立*
张肄鹏, 张惠玲, 张青, 黄珍, 刘卫东, 周丽英
(深圳市龙华新区中心医院, 深圳 广东518110)
[摘要]目的: 结合多重连接依赖探针扩增(MLPA)和荧光探针溶解曲线分析技术,建立一种一管法同时检测并分辨15种高危型HPV的方法。方法: 根据各HPV亚型的特异性序列设计MLPA探针,并在各亚型的MLPA探针中加入溶解温度(Tm)不同的人工核酸序列作为识别标志;使用特殊的耐高温连接酶和热启动Taq酶,通过温度控制使探针杂交、连接、PCR在一管反应中顺序进行;以各HPV亚型102拷贝至106拷贝的标准品质粒作为模版进行敏感度实验;将102~106拷贝的HPV亚型标准品进行两两混合作为模版,检测本方法对混合样本的检测能力;使用本方法和HPV分型试剂盒(导流杂交法)对临床样本进行平行检测,比较2种方法的差异。结果: 本方法可在一次反应内顺序完成MLPA探针杂交、连接、扩增3个步骤,扩增结果可通过不同荧光通道不同Tm值的溶解峰分辨不同的HPV亚型;本方法对标准品的检测灵敏度比经典的MLPA 3步法反应下降约一个数量级;本方法可同时检测至少2种HPV亚型的混合感染;对临床阳性标本的检出率与导流杂交法结果基本一致。结论: 本研究成功建立了一种利用一管法MLPA荧光探针溶解曲线技术检测15种高危型HPV的方法。
[关键词]乳头状瘤病毒,人; DNA探针,HPV; 溶解曲线分析; 多重连接依赖探针扩增
人乳头瘤病毒(human papillomaviruses, HPV)高危亚型的持续感染是宫颈癌及其癌前病变的主要病因[1]。宫颈癌患者、高度病变(CIN2或CIN3)患者及低度病变(CIN1)中的高危型HPV感染率分别为100%、97%与61.4%[2]。目前临床主要使用RNA探针杂交+化学发光【HC2,德国Qiagen)、PCR扩增+膜杂交(潮州凯普等)】、或定量PCR(广州达安等)技术对高危型HPV感染进行检测,但这些方法难以同时实现高通量闭管操作和多靶点同时检测的要求。多重连接依赖探针扩增(multiplex ligation-dependent probe amplification ,MLPA)是一种DNA定性和半定量分析技术,可同时检测40~50个核苷酸序列,通过毛细管电泳分离特定长度的扩增片段来判断目标基因的有无及相对含量[3],包括染色体非整倍体改变,单核苷酸多态性(single nucleotide polymorphism,SNP)和病原体检测等[4-5]。但传统的MLPA产物分析需要进行毛细管电泳或琼脂糖电泳,不仅费时且有PCR产物气溶胶污染的风险。本课题组前期在传统MLPA技术基础上建立了一种简单方便、能通过荧光探针溶解曲线分析来进行HPV分型的方法[6],本研究在此基础上加以改进,通过使用特殊的耐高温连接酶和热启动Taq酶,使一步闭管法检测得以实现,同时将检测位点扩充至15个HPV亚型,并以此方法对深圳地区收集的宫颈拭子标本中常见的15种高危型HPV进行筛查。
1材料和方法
1.1材料
1.1.1主要仪器和试剂MLPA探针及荧光探针由上海生工合成,质粒标准品由上海生工合成或本实验室自制,其它试剂主要由HPV分型检测试剂盒(潮州凯普)、细菌基因组DNA提取试剂盒(北京天根)、9N Taq连接酶(北京NEB)、热启动Taq酶(北京康为)及荧光定量PCR仪(德国Qiagen Rotorgene Q)等。
1.1.2临床标本人宫颈拭子脱落细胞临床标本由深圳市龙华新区中心医院检验科收集,经生理盐水洗脱后置-20 ℃保存。
1.2方法
1.2.1探针及引物设计从NCBI数据库中获得各HPV亚型的基因组序列,在HPV病毒E6、E7基因区域选取各亚型的特异性识别序列,使用AlleleID 6.0软件设计对应的MLPA探针对,并在各条MLPA右探针的尾部上加入一段不同Tm值的人工序列作为识别序列,该识别序列在PCR扩增完成后可与反向互补的荧光探针结合,在溶解曲线分析中形成不同荧光通道和Tm值的溶解峰用以分辨不同HPV亚型(表1)。
1.2.2样本提取用细菌基因组DNA提取试剂盒提取阴道拭子标本中的脱落核酸,按照试剂盒说明进行操作。洗脱的核酸在PCR仪上先进行98 ℃裂解5 min,置-20 ℃保存。
1.2.3一管法MLPA实验流程取5 μL高温裂解后的DNA作为模版,反应体系为每对MLPA探针10 fmol/L,每条荧光探针5 nmol/L,正向通用引物 1 nmol/L,反向通用引物10 nmol/L,10×反应缓冲液2.5 μL,连接酶 5 IU,PCR酶2.5 IU,去离子水补齐至25 μL。反应条件为:95 ℃ 1 min 模版变性,56 ℃ 30 min MLPA探针杂交并连接,95 ℃ 10 min激活热启动酶,然后95 ℃ 15 s,60 ℃ 20 s,72 ℃ 20 s 共35个循环,最后75 ℃延伸10 min。溶解曲线分析条件为:95 ℃变性3 min,45℃~85 ℃溶解曲线分析,检测FAM、ROX、Cy5 等3个通道(图1)。
1.2.4敏感度实验将各HPV亚型的探针结合序列插入到PET-19载体中制备质粒,定量后取各亚型102拷贝至106拷贝的标准品质粒作为模版进行敏感度实验,实验条件同1.2.3项。
1.2.5混合样本检测将102拷贝至106拷贝的亚型标准品进行两两混合作为模版,检测本方法对混合样本的检测能力,实验条件同1.2.3项。
1.2.6HPV分型对照实验用HPV分型试剂盒(导流杂交法)对提取的样本核酸进行平行检测,操作方法及判读标准均按照试剂盒说明书。
1.3统计学分析
使用SPSS 13.0统计软件分析MLPA方法和导流杂交法的结果差异,使用交叉表检验计算Kappa值。
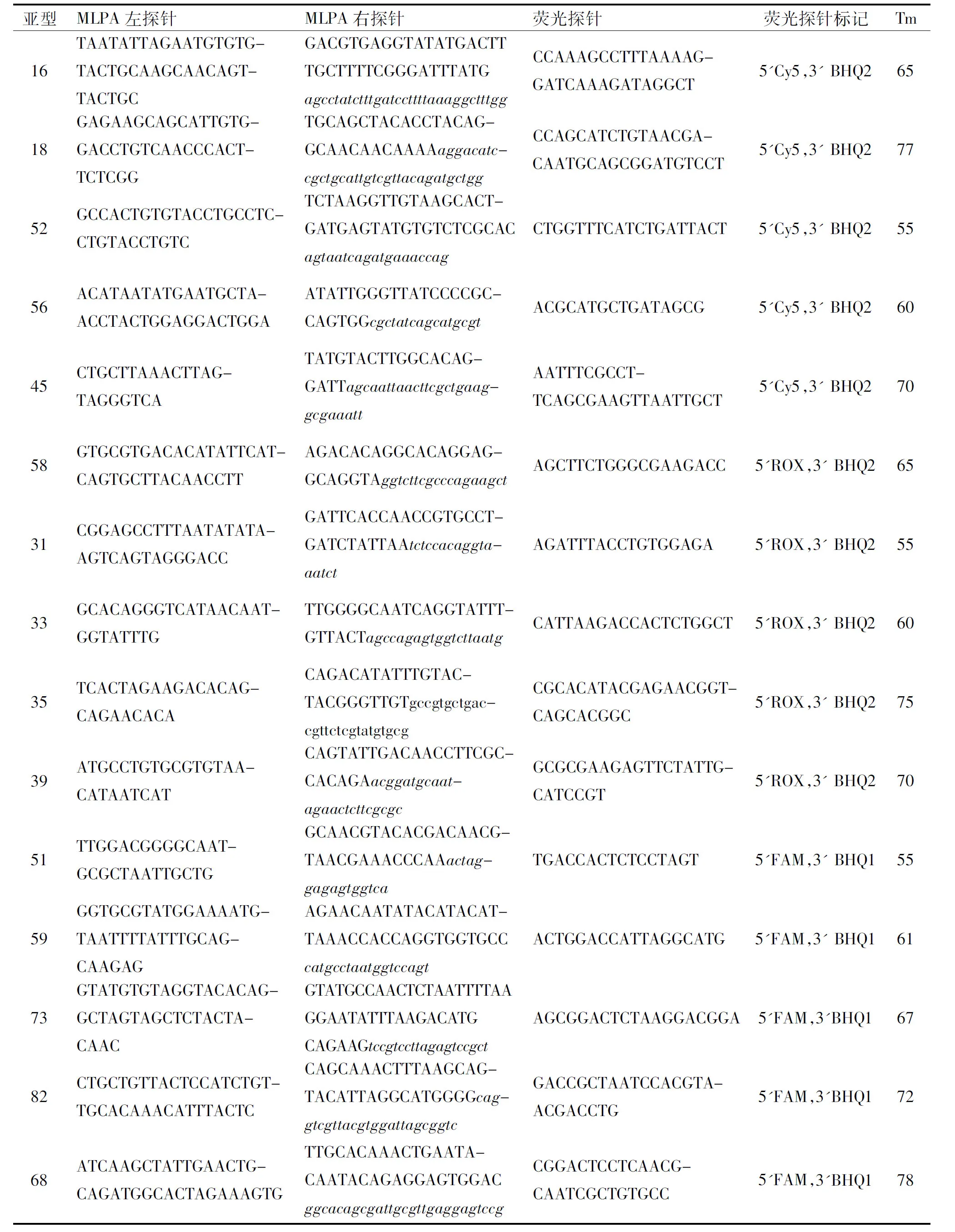
表1 MLPA探针杂交序列和荧光探针溶解温度
注:大写字母部分为MLPA探针杂交序列,小写斜体部分为人工识别序列
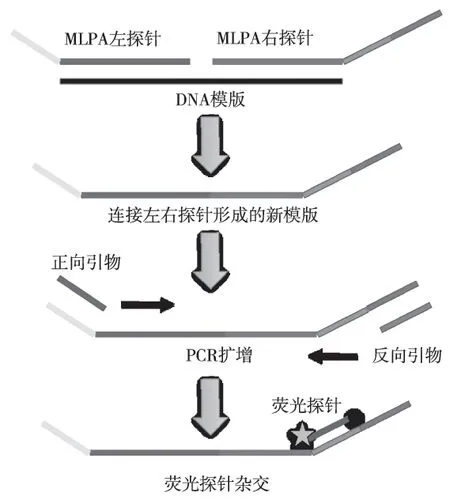
图1 MLPA溶解曲线分析流程Fig.1 Procedure of MLPA melting curve analysis
2结果
2.1一管法MLPA实验
取106拷贝各HPV亚型质粒标准品作为模板进行一管法MLPA实验,实验方法同1.2.3项,在溶解曲线分析中可得到与各MLPA探针上标记序列相对应的不同Tm值的溶解峰,不同HPV亚型的阳性结果可根据荧光通道和Tm值进行判读(图2)。
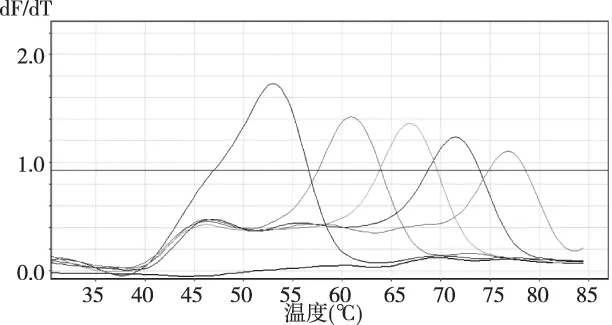
注:从左到右55 ℃、61 ℃、67 ℃、72 ℃、78 ℃处溶解峰分别对应51、59、72、83、68亚型HPV标准品模板图2 一管法MLPA实验FAM通道溶解曲线Fig.2 Melting curve result in FAM channel of one tube MLPA experiment
2.2敏感度实验
取102~106拷贝数各亚型的标准品质粒为模版进行敏感度实验,当模版拷贝量≥104拷贝数时可见明显的溶解峰,当模版拷贝量≤103拷贝数时溶解峰不明显或无溶解峰,说明该方法的检测下限为≥104拷贝(图3)。
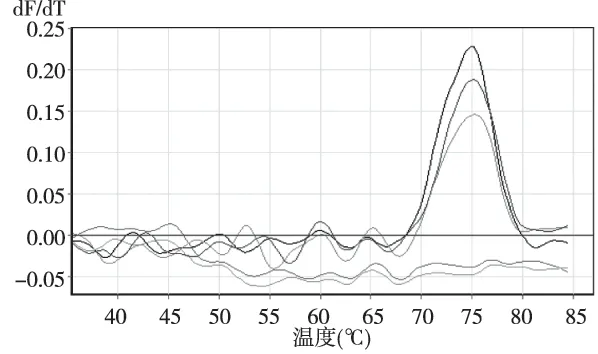
注:75℃处的3个溶解峰从高到低为106~104拷贝模板反应形成溶解峰,102和103拷贝模板的反应无溶解峰图3 HPV35亚型质粒标准品102~106拷贝作为模版溶解曲线Fig.3 Melting curve of qPCR of HPV-35 template in plasmid with 102~106 copies
2.3混合样本实验
将102拷贝至106拷贝的亚型标准品两两混合作为模版,当两种亚型模版量均≥104拷贝时可见两个独立的溶解峰,但峰的高度较单一模版时有所降低,说明混合模版之间存在竞争性抑制的关系,对临界值的判读有一定影响。其中部分亚型如HPV73受竞争性抑制影响较大,峰高度较单独模版时明显降低(图4)。
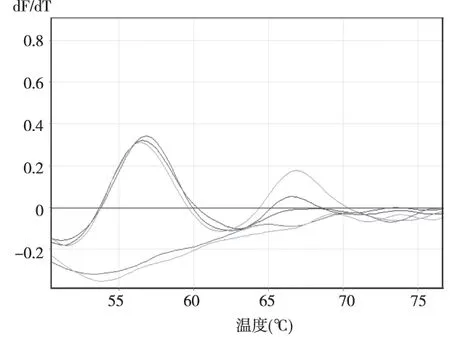
注:浅紫色线为106拷贝数模板,深紫色线为105拷贝数模板,深蓝色线为104拷贝数模板,浅蓝色线为103拷贝数模板,蓝绿色线为102拷贝数模板图4 HPV51 和HPV73(拷贝数102~106)混合质粒作为模版的qPCR溶解曲线Fig.4 Melting curve of qPCR of HPV-51 and -73 templatesin plasmid with 102~106 copies respectively
2.4不同检测方法的HPV分型结果
使用导流杂交法与溶解曲线分析法同时检测250例临床标本,见表2。
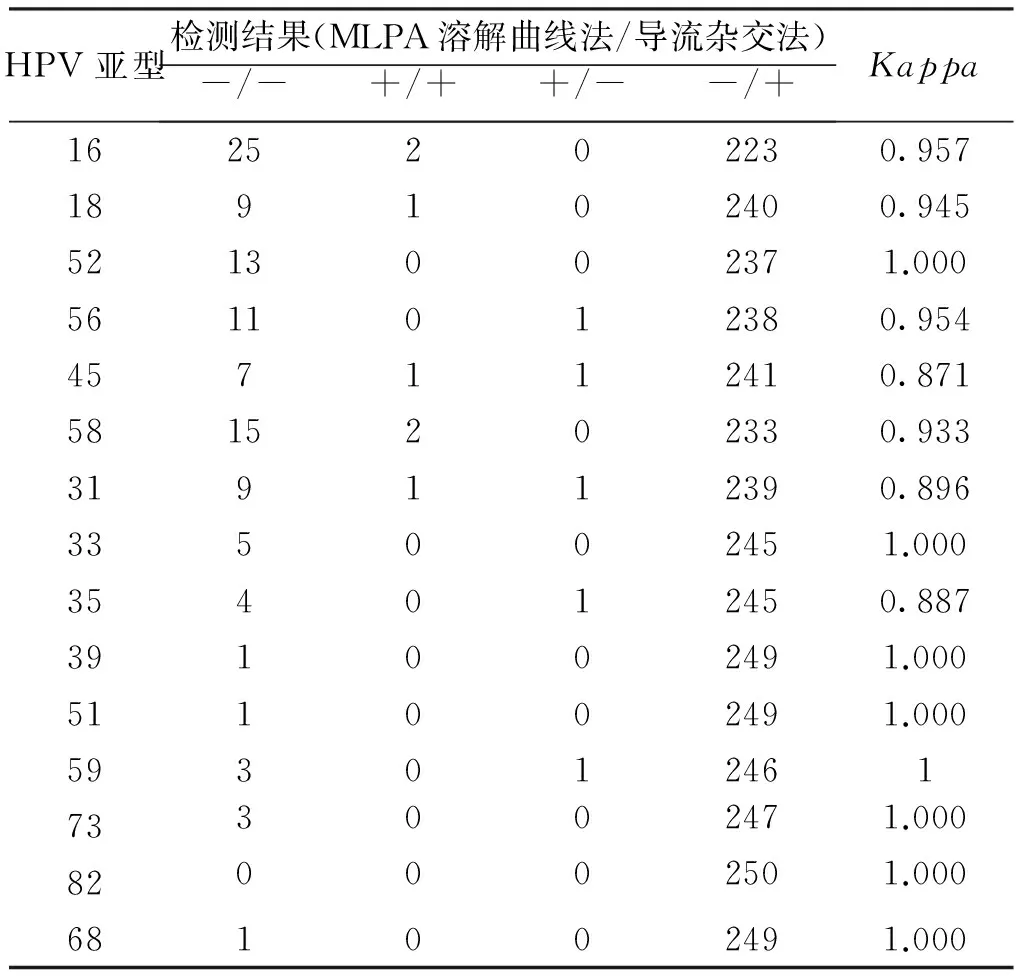
表2 MLPA溶解曲线分析法与导流杂交法检测250例临床标本结果
3讨论
MLPA技术已在遗传学、肿瘤检测中得到广泛应用,但该技术操作需要杂交、连接、扩增、电泳多个步骤,不仅繁琐耗时,而且反复开盖操作增加了核酸样本气溶胶交叉污染的风险。溶解曲线分析技术可通过不同荧光探针Tm值来分辨不同产物,当溶解曲线分析过程中温度升至荧光探针的Tm值时,荧光探针从结合的PCR产物上脱落速度达到最大值,荧光值降低,形成一个溶解峰,可通过溶解峰出现的温度值来区分不同Tm值的荧光探针,就对相应的病原体DNA进行定性[6-7]。本研究组前期工作通过在MLPA探针上加入荧光探针结合序列标签,使在定量PCR仪器上直接读取MLPA定性结果得以实现,并成功建立能检测10种HPV亚型的实验方法,但当时该方法尚不能实现如普通定量PCR一样的闭管操作,而需要前期的杂交、连接步骤,增加了实验的复杂性和污染风险。Qiu等[8]人使用先连接酶链式反应(ligation chain reactin,LCR)再PCR扩增的方法检测HPV,该方法同样需要先进行连接然后开盖取连接产物进行PCR,且前期的LCR对模版有指数扩增作用,进一步增加了气溶胶污染的风险。
传统MLPA需要进行多个步骤分步实验的原因在于探针杂交和PCR扩增不能同步进行,一是两者所需的缓冲液不同,Taq连接酶需要高Mg2+(10 mM左右)浓度,低pH值(7.4左右)的缓冲液,而Taq DNA聚合酶酶需要低Mg离子(2 mM左右)浓度,高pH值(9.0左右)的缓冲液;二是Taq DNA聚合酶在延伸过程中会使未连接的MLPA左侧探针延伸而切割掉MLPA右侧探针,使MLPA探针连接失败。9N连接酶是NEB公司推出的耐高温连接酶,其反应缓冲液与传统的Taq连接酶相比,对Mg2+和pH值的要求与普通Taq DNA聚合酶接近[9]。本实验通过引入9N连接酶取代传统的Taq连接酶使连接反应能与PCR缓冲液兼容,同时使用化学修饰(95 ℃激活时间>10 min)的热启动Taq酶,使MLPA探针连接时Taq酶不发挥作用,通过温度变化调控不同酶的反应次序来实现连接反应和PCR反应在同一个反应管中分步完成。实验证明,虽然一步法由于杂交时K+离子浓度较低使杂交效率下降导致检测灵敏度低于分步法约一个数量级,但灵敏度仍可达到104拷贝/反应左右,与HPV检测金标准之一的HC2阈值(5 000拷贝/反应)相当,可满足临床HPV检测对灵敏度的要求。
本研究使用临床常用的导流杂交法对250例临床标本进行了平行试验对比,发现两种方法匹配度比较一致,7例溶解曲线法阳性而导流杂交法阴性标本中经测序验证有5例为假阳性,可能为杂交探针误扩增导致;5例溶解曲线法阴性而导流杂交法阳性标本中有3例为假阴性,其中2例为混合感染,可能由于检测灵敏度不足或混合感染造成的竞争性抑制有关。
综上所述,本研究成功建立了一种可同时检测15种不同HPV亚型的实验方法,该方法可在目前临床常见的荧光定量PCR仪上进行闭管操作,减少了过去MLPA检测方法开盖操作造成的污染风险,检测结果与导流杂交方法基本一致,可用于临床HPV检测,该方法并可推广到对其它多重病原体的检测中,显示出广阔的应用前景。
4参考文献
Jemal A, Bray F, Center MM,et al. Global cancer statistics[J]. CA Cancer J Clin, 2011(2): 69-90.
Li LK, Dai M, Clifford GM, et al. Human papillomavirus infection in Shenyang city, People’s Republic of China: A population-based study[J]. Br J Cancer, 2006(11): 1593-1597.
Piotr K, Anna JJ, David JK. New applications and developments in the use of multiplex ligation-dependent probe amplification[J]. Electrophoresis, 2008(23): 4627-4636.
Lijuan W, Xiao MY, Lei Z, et al. Practical prediction of ten common streptococcus pneumoniae serotypes/serogroups in one PCR reaction by multiplex ligation-dependent probe amplification and melting curve (MLPA-MC) assay in shenzhen, China[J]. Plos One, 2015(7): e0130664.
Donahue AC, Abdool AK, Gaur R, et al. Multiplex ligation-dependent probe amplification for detection of chromosomal abnormalities in myelodysplastic syndrome and acute myeloid leukemia[J].Leuk Res, 2011(11):1477-83.
张肄鹏, 张惠玲, 张青,等. 一种结合MLPA和荧光探针溶解曲线分析的HPV分型检测方法的建立[C]. 中国转化医学和整合医学研讨会(广州站)论文综合刊, 2015.
Yi QL, Xiao BW, Chao S, et al. Combination of fluorescence color and melting temperature as a two-dimensional label for homogeneous multiplex PCR detection[J]. Nucleic Acids Res, 2013(7): e76.
Qiu YH, Zan ZL, Yi QL, et al. Multiplex fluorescence melting curve analysis for mutation detection with dual-labeled, self-quenched probes[J]. Plos One, 2011(4): e19206.
Lohman GJ, Bauer RJ, Nichols NM, et al. A high-throughput assay for the comprehensive profiling of DNA ligase fidelity[J].Nucleic Acids Res, 2016(2):e14.
(2016-03-06收稿,2016-05-27修回)
中文编辑: 潘娅; 英文编辑: 赵毅
Establishment of A Method to Detect 15 High Risk HPV Based on One Tube MLPA Melting Curve Analysis Technique
ZHANG Yipeng, ZHANG Huiling, ZHANG Qing, HUANG Zhen, LIU Weidong, ZHOU Liying
(CenterHospitalofLonghuaNewDistrictofShenzhen,Shenzhen518110,Guangdong,China)
[Abstract]Objective: To establish an one-tube method to detect and distinguish 15 high risk HPV based on multiplex ligation dependent probe amplification and fluorescent probe melting curve analysis technique. Methods: Design MLPA probes targeting specific sequences of 15 high risk HPV subtypes and adding artificial nucleic sequences with different melting temperatures to each MLPA probes as identification. Special high temperature tolerant ligase and hot-start PCR enzyme were used to hold hybridization, ligation and PCR process to run sequentially in one tube. Coping HPV subtype 102 to 106 copies standard plasmids as templates to detect the sensitivity of this method. Using 102 to 106 copies mixed standard plasmids to find the detection capability of mixed samples. Parallel detection of clinical samples was used to compare the difference of these two methods. Results: This method could detect at least 3 MLPA subtypes simultaneously. Different HPV subtypes can be distinguished by melting curves of fluorescent probes. The sensitivity of this method is lower an order of magnitude than classical 3 step method. This method had similar accuracy of flow-through hybridization method. Conclusions: Successfully established a 15-high risk HPV detecting method based on one tube MLPA fluorescent probe melting curve analysis technique.
[Key words]human papillomaviruses; multiplex ligation-dependent probe amplification; melting curve analysis
[中图分类号]R446.52
[文献标识码]A
[文章编号]1000-2707(2016)06-0675-06
DOI:10.19367/j.cnki.1000-2707.2016.06.013
网络出版时间:2016-06-16网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160616.1700.028.html

