不同衬底上生物膜与 Aβ 蛋白的相互作用的研究
胡智萍,王肖丽,张振龙,程秀英*,毛艳丽
(1.河南大学物理与电子学院,开封 475004;2.河南大学计算材料科学研究所,开封 475004)
不同衬底上生物膜与 Aβ 蛋白的相互作用的研究
胡智萍1,2,王肖丽1,2,张振龙1,2,程秀英1,2*,毛艳丽1,2
(1.河南大学物理与电子学院,开封475004;2.河南大学计算材料科学研究所,开封475004)
摘要:固体支撑脂质双层膜能很好的模拟生物膜系统,固体衬底的表面结构和性质会影响双层膜的成膜过程、流动性、微区形成以及化学活性,进而影响蛋白的特性。本文,我们在两种衬底云母和二氧化硅表面,构建了包含神经节苷脂GM1的固体支撑脂质双层膜,用拉曼光谱研究了两种衬底表面脂质膜的分子构象。并且,在脂质膜表面加入淀粉样-beta蛋白,分析两种衬底上淀粉样-beta蛋白的构象差异。
关键词:固体支撑脂质双层膜;Aβ蛋白;拉曼光谱;云母;二氧化硅
1引言
神经节甘脂GM1(GM1)对于许多神经系统中的细胞功能都有重要价值,如信号转导、神经元分化和轴突、树突和突触的形成。GM1由酰基链和一个复杂的头基端组成[1-2]。研究表明,GM1会与淀粉样-beta(Aβ)蛋白形成种子,可以促进Aβ蛋白的构象转变,从无规卷曲到α-helix和β-sheet结构,导致Aβ蛋白形成寡聚体和纤维化,并且具有毒性。这种具有毒性的Aβ蛋白在阿尔茨海默症(AD)中会引起神经元细胞的死亡[3-11]。
固体支撑脂质双层膜(SPBs)是很好的模拟生物膜系统,但固体衬底的表面结构和性质会影响双层膜的成膜过程、流动性、微区形成以及化学活性。不同衬底上的脂质膜对Aβ蛋白构象的影响有很大差异,特别是含有GM1的脂质体双分子层。有报道研究了云母和二氧化硅(SiO2)表面包含GM1的脂质膜与Aβ蛋白的相互作用。该研究通过原子力显微镜(AFM)观察,在云母和SiO2表面SPBs的构象有所差异,并且,在同等条件下云母表面Aβ 蛋白聚集和纤维化的速度要大于SiO2表面的[12]。
拉曼光谱可以提供有效的分子结构信息。因为液体环境下水的拉曼散射比较弱,所以用拉曼光谱研究液体环境下的分子结构更方便。但是拉曼散射效应是很弱的,很容易被溶剂的荧光淹没。最近,拉曼光谱在解决生物问题方面得到广泛关注,已经被成功运用于检测细胞成分和代谢活动。但是,因为脂质双层膜的厚度只有4~6 nm,所以拉曼光谱很难被探测到。因此,一种复杂的结合拉曼光谱仪,显微镜和共聚焦系统的拉曼光谱系统被研发,该系统可以提高分辨率和信号采集效率,从而,可用于研究脂质膜的拉曼光谱[13]。
本文主要运用拉曼光谱对比分析了两种衬底云母和SiO2表面的GM1/SM/Chol SPBs 的分子构象,以及加入Aβ蛋白后构象变化的差异,从分子水平分析了衬底材料对脂质双层膜构象的影响,以及对Aβ蛋白聚集速率的影响。
2实验方法
2.1材料和试剂
单唾液酸四己糖神经节苷脂(GM1),胆固醇(Chol)和Amyloid beta 1-40(Aβ(1-40)购买自Sigma-Aldrich公司,鞘磷脂(SM)和C6-NBD-鞘磷脂(NBD-SM)购买自Avanti公司,其它试剂均为国产分析纯。
2.2亲水性基底的处理
亲水性基底SiO2是通过对Si(100)做湿氧化处理得到的,将Si(100)经过一系列处理:H2SO4+H2O2(30%)(容量比4∶1),HF(5%),进而HCl+H2O2(30%)+H2O(1∶1∶4)。
2.3SPBs,单体Aβ(1-40)溶液的制备
GM1、SM和Chol的摩尔比例为5/55/40和20/40/40。首先,取适量的GM1,SM和Chol分别溶于氯仿/甲醇(1∶1,v/v)混合溶液中,利用氮气使溶液蒸发,并在真空干燥箱中放置整夜,以形成干燥的膜,将干燥的混合磷脂溶于超纯水中,达到最终浓度0.12 mg/mL。将该混合溶液进行冷冻-融化三次,后在60℃下超声,最终得到磷脂囊泡溶液(SUVs)。制备用于观察荧光的SUVs时,需要用NBD-SM对SUVs进行荧光标记,NBD-SM的浓度为1%(mol/mol)。制备好SUVs后,取200μL SUVs溶液滴到直径10 mm的新鲜固体衬底表面,在室温下放置30分钟,70℃放置15分钟后冷却到室温。最后,用超纯水清洗四遍移除未破裂的囊泡,所有的样品都是在聚四氟乙烯的样品池里制备。
将Aβ(1-40)蛋白溶于0.02%的氨水溶液中,将溶液在14,000 rpm,4℃下离心3 h(Beckman Instruments),得到单体的Aβ(1-40)蛋白,浓度为600μM,在-20℃下分装储存。使用时,将Aβ(1-40)溶液用缓冲液稀释至100μM。
2.4荧光显微镜和拉曼光谱仪
SPBs表面形貌的荧光图像是在荧光显微镜(Olympus)上观察,经CCD(Nikon DS-2MBW)处理得到的。拉曼光谱是在WITEC RSA300+上测得,激发光源是632.8 nm,光谱范围是0~4000 cm-1,累计时间是5 s,物镜放大倍数为100,光源功率低于0.5 mW,从而避免激光对样品造成破坏。
3结果和讨论
3.120GM1/40SM/40Chol-SPBs在云母和SiO2上的表面形貌
我们用比例为20GM1/40SM/40Chol 的SUVs溶液通过囊泡融合法在云母和SiO2表面形成平坦的SPBs。为了确认形成了磷脂膜双层的膜,我们用荧光显微镜对其形貌进行观察。图 1是云母和SiO2表面形成的SPBs的一系列荧光漂白恢复图像(FRAP),a为云母表面的FRAP图像,b为SiO2表面的FRAP图像,进行漂白后荧光还能恢复是因为NBD-SM的横向扩散。可以看到在SiO2表面和云母表面都形成了非常平坦完整的SPBs,未破裂的囊泡量很少。如图 1所示,两种基底上的SPBs都能实现荧光恢复。表明在两种衬底表面,SPBs都处于液相状态。这是因为液相状态的扩散系数比凝胶状态大几个数量级,液相的SPBs荧光恢复时间比凝胶状态快得多[14-15]。但是在5 min时和10 min时云母表面比SiO2表面荧光恢复较快,表明云母表面SPBs的流动性更好。
3.2GM1/SM/Chol-SPBs在云母和SiO2上的拉曼光谱
在云母和SiO2表面形成SPBs(20GM1/40SM/40Chol)后,直接对其进行拉曼测试。图2是云母和SiO2表面的SPBs的拉曼光谱,光谱a为云母表面的SPBs,b为SiO2表面。表1给出了拉曼光谱的峰值频率和归属。

Fig.1Sequential fluorescence images after photobleaching.GM1/SM/Chol SPBs formed on the mica(a)SiO2(b)The observed time is 5 and 10 min
C-C振动(1000~1200 cm-1),如图 2A所示,光谱a和b的C-C伸缩振动区域1000~1150 cm-1都相应出现了几个峰,这个区域有利于观察磷脂双层膜中酰基链的变化。对于酰基链的拉曼振动,已经通过对磷脂膜的简正坐标分析和推论进行过研究[16-18]。C-C振动对亚甲基链的的偏转和全反式构象很敏感,并且受亚甲基旋转和变形影响很小。如果酰基链是全反式链,拉曼光谱将会出现1060 cm-1(反对称C-C伸缩)和1125 cm-1(对称C-C伸缩)两个峰[18-19]。而1085 cm-1谱带归属于有偏转缺陷的全反式[19],光谱a,b中这个峰的出现表明在云母和SiO2基底表面形成的SPBs具有偏转构象,而不是“全反式”。
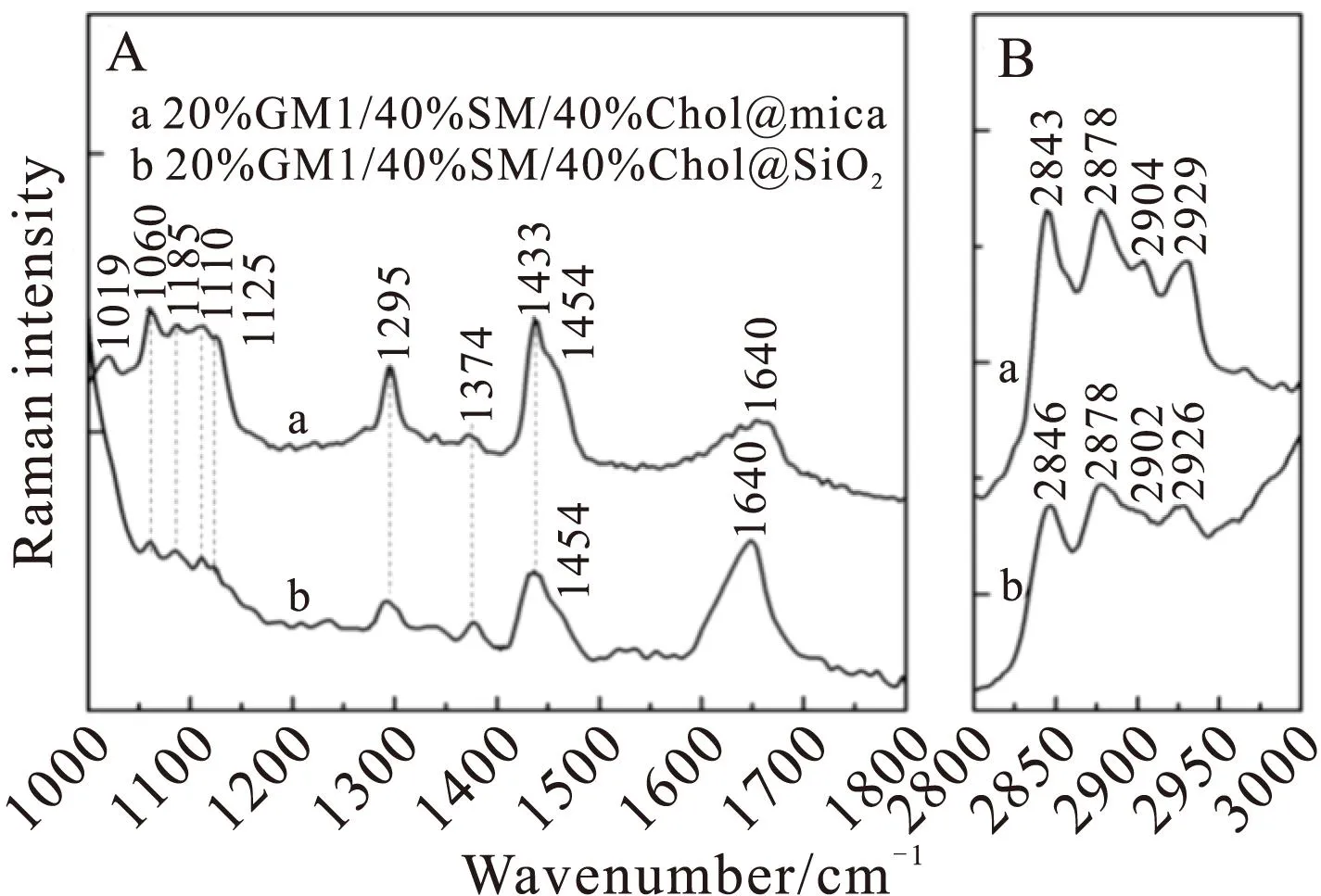
Fig.2Raman spectra of SPBs on mica and SiO2:(a)mica,(b)SiO2,(A)1000~1800 cm-1,(B)2800~3000 cm-1

Tab.1 Peak frequencies and assignments of Raman spectra of SPBs on mica and SiO2surface
在光谱图 2A光谱a中,1019 cm-1来自于GM1中N-乙酰神经氨酸(Neu5Ac)的C-C振动。GM1是含有唾液酸的糖脂,而Neu5Ac是唾液酸的主要形式,在GM1的头端有Neu5Ac结构[20]。而在光谱b中,因为SiO2在~970 cm-1处有很强的特征峰,从而将Neu5Ac的特征峰1019 cm-1遮盖,无法观测到Neu5Ac的特征振动。我们在图3中列出了云母和SiO2的拉曼光谱,其中图3A对应于云母的拉曼峰,图3B对应于SiO2。
对于图2A光谱a的特征峰1110 cm-1,它既来自于磷脂分子C-C振动,也有来自云母基底的贡献。因为云母在500~1110 cm-1有丰富的振动峰(图3A),在这个区域,我们也无法分析SPBs的构象信息。另外,Si基底在~520 cm-1和~970 cm-1都有很强烈的特征峰(图 3B),将SPBs在该部分的分子振动特征掩盖。因此,在SiO2表面的SPBs拉曼谱1060 cm-1之前的区域,我们也无法分析SPBs的构象。
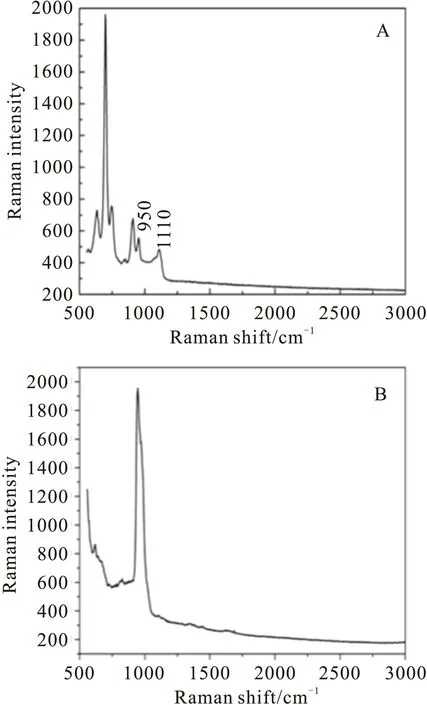
Fig.3 Raman spectra of mica(A)and SiO2(B)
CH2扭转/摇摆/弯曲(1200~1600 cm-1)。这个区域来自于CH2的扭动/摇摆/弯曲模式。在图2中,1295 cm-1来自于CH2的扭转,1374 cm-1来自于CH2的摇摆[21-22]。另外,CH2弯曲的拉曼特征在光谱a和b中分别出现在1433 cm-1和1454 cm-1,这两个峰只在六方晶相结构中出现[23],表明磷脂分子是晶体结构。并且,这个区域受分子内和分子间费米共振相互作用。对全反式酰基链的相关研究表明,摇摆的基本面(723~735 cm-1)和未受扰动的弯曲的基本面(1442 cm-1)之间的费米共振,会在1433 cm-1处产生一个很强的,在1454 cm-1有一个弱的拉曼峰。然而,如果酰基链是单斜或斜方晶系,在1418 cm-1处还会出现拉曼峰[23-24]。因此,从SPBs的拉曼特征振动可知在云母和SiO2表面形成的SPBs(20GM1/40SM/40Chol)都处于六方晶相。
CH2和CH3伸缩区域(2800~3000 cm-1)。CH2和CH3伸缩振动的拉曼特征都出现在2800~3000 cm-1。如图 3所示,谱带2904 cm-1(光谱a)和2902 cm-1(光谱b)来自于νsFR(CH2)振动,2929 cm-1(光谱a)和2926 cm-1(光谱b)与νs(CH3)相关[14,25],这两个谱带在光谱a和b中几乎相同。另外,光谱a中,亚甲基的对称和不对称伸缩出现在2843和2878 cm-1,光谱b中出现在2846和2878 cm-1。从拉曼谱带强度得出的参数可以用于估计脂质双层的分子间相互作用,2843 cm-1和2880 cm-1的峰强比,表示为I2878/I2843,反应了链间横向相互作用[14,25]。光谱b中I2878/I2846比值比光谱a中I2878/I2843略大,这表明SiO2表面的SPBs横向链间相互作用比云母表面的略大,SPBs流动性较小,这与FRAP结果相一致。
3.3云母和SiO2上SPBs加入Aβ(1-40)后的拉曼光谱
为了研究不同基底材料对Aβ(1-40)和SPBs相互作用的影响,我们在云母和SiO2上形成GM1/SM/Chol SPBs后,直接在其表面加入100 μM的单体Aβ(1-40)溶液,Aβ(1-40)的最终浓度为1μM,将样品池37℃下恒温放置12 h,之后进行拉曼测试。如图 4所示,光谱a代表云母表面的拉曼光谱,光谱b代表SiO2表面的拉曼光谱,图 4A是1000~1800 cm-1区域的拉曼光谱,图 4B对应于2800~3000 cm-1区域。
如图 4A光谱a所示,相比于云母上的SPBs的拉曼谱(图 2A光谱a),加入Aβ(1-40)后,SPBs的拉曼光谱1019 cm-1几乎消失,我们将这个变化归因氨基酸和GM1头端的Neu5Ac可能发生了直接相互作用。另外光谱a和b都出现了新的峰1260 cm-1,它对应于Aβ(1-40)蛋白amide III的α-螺旋结构。这个峰的出现表明,此时在两种基底上Aβ(1-40)都发生了无规卷曲结构到α-螺旋结构的转变。另外,光谱a中,1374 cm-1发生轻微偏移至1381 cm-1,它既代表磷脂分子CH2摆动,又与多肽的amide S结构有关(amide S的出现与β-折叠结构相关)[26]。在1410 cm-1出现新的谱带,可以归属于Aβ(1-40)的酪氨酸残基[27]。这两个峰的变化在光谱b中都没有表现。光谱a和b的差别表明,在两种基底上,Aβ(1-40)都表现出了α-螺旋结构,云母表面Aβ(1-40)已经聚集并出现了β-折叠结构和氨基酸残基的信号峰,而在SiO2表面却还没有表现出来。
从图 4B中2800~3000 cm-1光谱区域分析发现,在云母表面的拉曼光谱发生了很大变化,而在SiO2表面这个区域的拉曼峰与图 2中几乎一样。与图 2B中云母表面(光谱a)相比,2846,2878 cm-1偏移至2845和2881 cm-1,比值I2881/I2843变大。这说明,加入Aβ(1-40)12 h后,SPBs的链间横向相互作用变大,SPBs趋向于凝胶状态。另外,来自于νsFR(CH2)的2904 cm-1偏移至2901 cm-1并且峰强明显变大。2929 cm-1(νs(CH3))减弱几乎消失,2962 cm-1(νa(CH3))增强很多,这两个峰属于SPBs疏水部分的甲基头端。这些变化表明在云母表面Aβ(1-40)与SPBs疏水端的相互作用,疏水链包含酰基链和甲基头端。而在SiO2表面Aβ(1-40)与SPBs相互作用速度较慢,此时Aβ(1-40)没有进入到疏水部分。
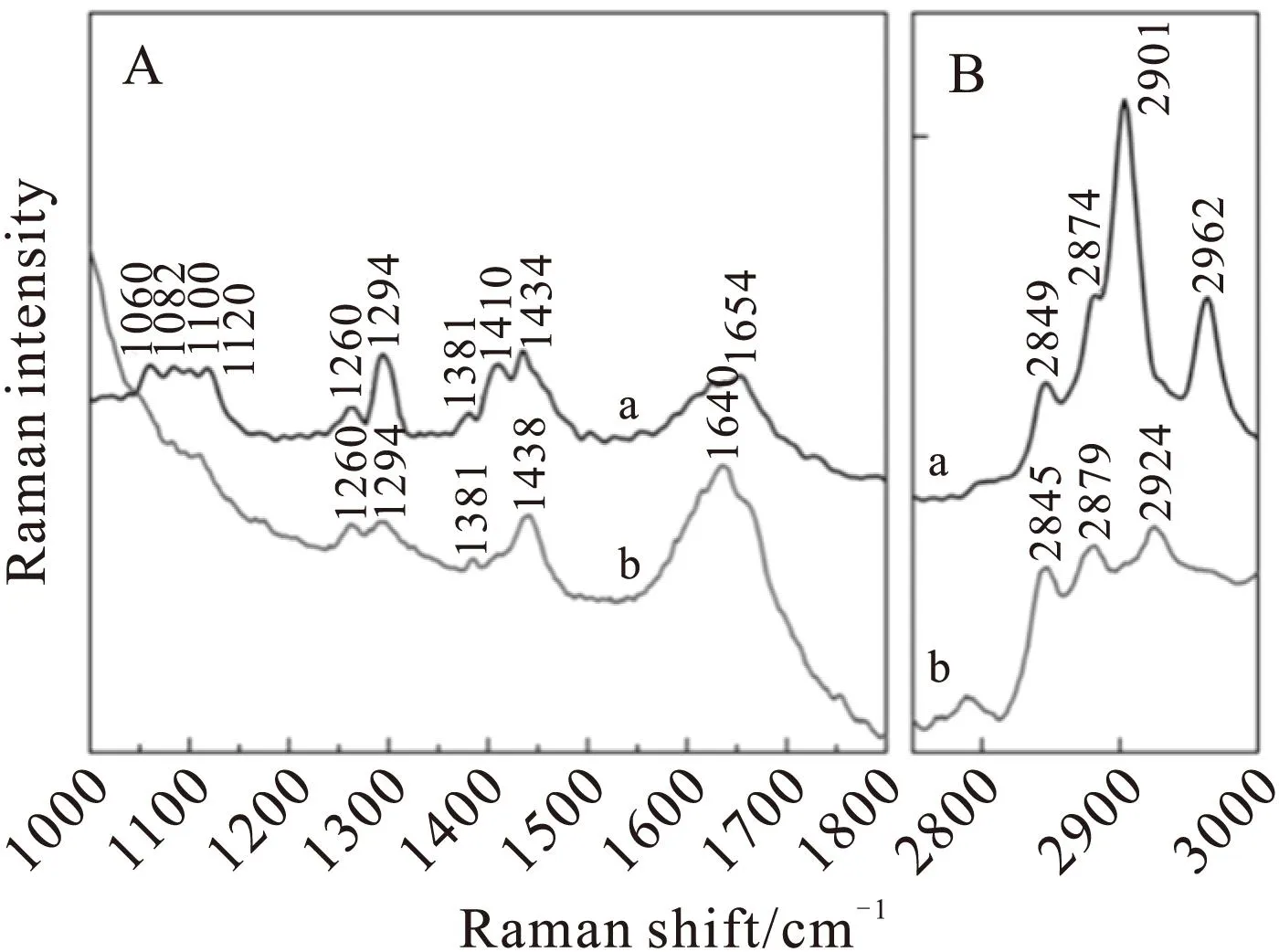
Fig.4Raman spectra of SPBs in the presence of Aβ(1-40)for 12 h incubations(a)mica,(b)SiO2,(A)1000~1800 cm-1,(B)2800~3000 cm-1

Fig.5Raman spectra of SPBs in the presence of Aβ(1-40)for 24 h incubations(a)mica,(b)SiO2,(A)1000~1800 cm-1,(B)2800~3000 cm-1
随着Aβ(1-40)加入时间增加,拉曼光谱继续发生变化,图 5表示的是在SPBs表面加入Aβ(1-40)24 h后的拉曼光谱。光谱a为云母表面的拉曼光谱,光谱b代表SiO2表面的拉曼光谱。图 5A是1000~1800 cm-1区域的拉曼光谱,图 5B是2800~3000 cm-1区域的拉曼光谱。
在云母表面,与12 h的拉曼光谱相比,24 h的光谱a又有几个新的峰出现,1003,1188,1211和1240 cm-1。其中,1003 cm-1处窄的强的谱带来自于Aβ(1-40)的苯丙氨酸,1188 cm-1和1211 cm-1可以归属于Aβ(1-40)的酪氨酸[27]。这几个来自氨基酸残基的拉曼特征峰在光谱b中都没有出现。我们可以将这两种氨基酸强度的增加归因于随着蛋白加入时间增加,说明Aβ(1-40)在云母表面比在SiO2表面聚集更多。
光谱a中,amide III(1230~1300 cm-1)的拉曼信号出现在1240 cm-1,光谱b中在1244 cm-1,对应于amide III的β-折叠结构[28]。与此同时,光谱a中代表amide III的α-螺旋结构出现在1260 cm-1,光谱b中出现在1268 cm-1处[28]。光谱a中表示CH2扭转的1300 cm-1比图 4中a强度更强,这可能是因为Aβ(1-40)对SPBs酰基链的亚甲基产生了影响。Aβ(1-40)的amide I(1590~1725 cm-1)在1656 cm-1的强度明显增强,那是因为Aβ(1-40)蛋白发生了更多的聚集和构象转变。在光谱b中,1202 cm-1,1656 cm-1强度增加幅度较小。说明SiO2表面Aβ(1-40)聚集程度比云母上小。
对于2800~3000 cm-1区域(图 5B),与图 4B中a相比,CH振动强度整体增强幅度较大,2845,2881 cm-1偏移至2849 和2874 cm-1,并且I2874/I2849比图 4中I2881/I2843大。且2902和2962 cm-1明显增强。这说明随着Aβ(1-40)加入更长时间,云母表面聚集更多Aβ(1-40),并且蛋白与SPBs疏水端作用更强烈,SPBs趋向于凝胶状态,膜在一定程度被破坏。而光谱b中无论是峰强及峰位变化都较小。表明在SiO2表面Aβ(1-40)聚集以及与SPBs疏水端的相互作用程度比较弱。
从上述结果可以看到,由于衬底的作用,导致SiO2表面上形成的脂质双层膜的流动性较小,横向链间相互作用较大。另外GM1是含有唾液酸的糖脂,Neu5Ac是唾液酸的主要形式,它的特征峰 1019 cm-1只出现在云母衬底上,并且在加入Aβ后这个特征峰的消失表明Neu5Ac与Aβ蛋白的直接相互作用。这些证明了在云母上GM1的Neu5Ac功能团很可能是暴露在上面的,而且由于较好的流动性很可能使得GM1聚集形成了团簇。暴露在表面的聚集的Neu5Ac通过发生CH-π相互作用绑定 Aβ,但是在SiO2衬底上团簇的形成较为困难,Neu5Ac也可能不是暴露在膜表面的,所以对Aβ的绑定相对较少。这从酪氨酸和苯丙氨酸的特征振动没有出现,而且α-螺旋结构和 β-折叠结构的特征振动峰相对较弱也可以证明,说明Aβ(1-40)在SiO2表面比在云母表面聚集的少,使Aβ构象转变相对较慢。另外在SiO2表面脂质双层膜疏水端的变化也比较缓慢,而云母表面随着Aβ(1-40)加入更长时间,蛋白与SPBs疏水端作用强烈,SPBs趋向于凝胶状态,膜在一定程度上被破坏。Aβ(1-40)与SPBs相互作用是通过疏水性C终端插入双层膜中与脂质体的疏水性酰基链相互作用,很可能因为SiO2表面有较大的横向相互作用,C终端的插入相对比较困难,所以SiO2衬底上GM1/SM/Chol SPBs的疏水端在Aβ蛋白的作用下基本上没有变化。
4结论
GM1,SM和Chol是等离子膜脂筏的主要成分,这些脂筏被对信息传导,细胞运输脂质排序起到重要作用,经常作为细胞膜模拟体系用于研究。固体支撑脂质双层膜是很好的模拟生物膜系统,但固体衬底的表面结构和性质会影响脂质膜的成膜过程、流动性、微区形成以及化学活性。在本论文中,利用囊泡融合法在云母和SiO2表面都形成了平坦均匀的GM1/SM/CholSPBs,通过拉曼光谱分析云母表面的SPBs流动性比SiO2表面要好,从分子水平上分析了基底材料对磷脂分子构象的影响。加入 Aβ蛋白后,不同时间的拉曼光谱表明基底材料对蛋白构象变化有所影响。Aβ蛋白在 SiO2表面比在云母表面聚集的少,使 Aβ蛋白构象转变相对较慢。在SiO2表面,Aβ蛋白与脂质双层膜疏水端作用比较缓慢。而在云母表面,随着Aβ加入的增加,蛋白与SPBs 疏水端相互作用比SiO2强烈。
参考文献
[1]Schengrund C L,The role(s)of gangliosides in neural differentiation and repair:a perspective[J].Brain Res Bull,1990,24(1):131-141.
[2]Ngamukote S,Yanagisawa M,Ariga T,etal.Developmental changes of glycosphingolipids and expression of glycogenes in mouse brains[J].J Neurochem,2007,103(6):2327-2341.
[3]Yanagisawa K,Odaka A,Suzuki N,etal.GM1 ganglioside-bound amyloid β-protein(Aβ):a possible form of preamyloid in Alzheimer's disease[J].Nat Med,1995,1(10):1062-1066.
[4]Choo-Smith L P,Garzon-Rodriguez W,Glabe C G,etal.Acceleration of amyloidfibril formation by specific binding of Aβ-(1-40)peptide to gangliosidecontaining membrane vesicles[J].J Biol Chem,1997,272(37):22987-2990.
[5]Kakio A,Nishimoto S,Yanagisawa K,etal.Cholesteroldependent formation of GM1 ganglioside-bound amyloid β-protein,an endogenous seed for Alzheimer amyloid[J].J Biol Chem,2001,276(27):24985-24990.
[6]Kakio A,Nishimoto S,Yanagisawa K,etal.Interactions of amyloid β-protein with various gangliosides in raft-like membranes:importance of GM1 ganglioside-bound form as an endogenous seed for Alzheimer amyloid[J].Biochemistry,2002,41(23):7385-7390.
[7]Wakabayashi M,Okada T,Kozutsumi Y,etal.GM1 gangliosid emediated accumulation of amyloid beta-protein on cell membranes[J].Biochem Biophys Res Commun,2005,328(4):1019-1023.
[8]Yamamoto N,Fukata Y,Fukata M,etal.GM1-ganglioside-induced Aβ assembly on synaptic membranes of cultured neurons[J].Biochim Biophys Acta,2007,1768(5):1128-1137.
[9]Okada T,Wakabayashi M,Ikeda K,etal.Formation of toxic fibrils of Alzheimer's amyloid β-protein-(1-40)by monosialoganglioside GM1,a neuronal membrane component[J].J Mol Biol.,2007,371(2):481-489.
[10]Yamamoto N,Matsubara E,Maeda S,etal.Takashima,W.Maruyama,M.Michikawa,K.Yanagisawa,A ganglioside-induced toxic soluble Aβ assembly:its enhanced formation from Aβ bearing the arctic mutation[J].J Biol Chem,2007,282(4):2646-2655.
[11]Chi E Y,Frey S L,Lee K Y C,etal.Ganglioside GM1-mediated amyloid-beta fibrillogenesis and membrane disruption[J].Biochemistry,2007,46(7):1913-1924.
[12]Mao Y,Shang Z,Imai Y,etal.Surface-induced phase separation of a sphingomyelin/cholesterol/ganglioside GM1-planar bilayer on mica surfaces and microdomain molecular conformation that accelerates Aβ oligomerization[J].Biochim Biophys Acta,2010,1798(6):1090-1099
[13]Lee C,Bain C D,etal.Raman spectra of planar supported lipid bilayers[J].Biochim Biophys Acta Biomembr,2005,1711(1):59-71.
[14]Jeong D W,Kim K,Lee S,etal.Fluorescence recovery after merging a surfactant-covered droplet:a novel technique to measure the diffusion of phospholipid monolayers at fluid/fluid interfaces[J].Langmuir,2014,30(48):14369-14374.
[15]Cho N J,Frank C W.Fabrication of a planar zwitterionic lipid bilayer on titanium oxide[J].Langmuir,2010,26(20):15706-15710.
[16]Tasumi M,Shimanouchi T,Miyazawa T.Normal vibrations and force constants of polymethylene chain[J].J Mol Spectrosc,1962,9(1):261-287.
[17]Schachtschneider J H,Snyder,etal.Vibrational analysis of the n-paraffins-II:normal co-ordinate calculations[J].Spectrochim Acta,1963,19(1):117-168.
[18]Snyder R G,Schachtschneider J H.Vibrational analysis of the n-paraffins-I:assignments of infrared bands in the spectra of C3H8through n-C19H40[J].Spectrochim Acta,1963,19(1):85-116.
[19]Meier R J,Csiszar A,etal.Detecting the effect of very low amounts of penetrants in lipid bilayers using Raman spectroscopy[J].J Phys Chem B,2006,110(42):20727-20728.
[20]Vinogradova E,Tlahuice F,Velazquez-S A J J,etal.Surface‐enhanced Raman scattering of N-acetylneuraminic acid on silver nanoparticle surface[J].J Raman Spectrosc,2014,45(9):730-735.
[21]Angata T,Varki A.Chemical diversity in the sialic acids and related α-keto acids:an evolutionary perspective[J].Chem Rev,2002,102(2):439-470.
[22]Yellin N,Levin I W.Cooperative unit size in the gel-liquid crytalline phase transition of dipalmitoyl phosphatidylcholine-water multilayers:an estimate from Raman spectroscopy[J].Biochim Biophys Acta Biomembr,1977,468(3):490-494.
[23]Zerbi G,Magni R,Gussoni M,etal.Molecular mechanics for phase transition and melting of n-alkanes:a spectroscopic study of molecular mobility of solid n-nonadecane[J].Chem Phys,1981,75(7):3175-3194.
[24]Boerio F J,Koenig J L.Raman scattering in crystalline polyethylene[J].J Chem Phys,1970,52(7):3425-3431.
[25]Snyder R G,Hsu S L,Krimm S,etal.Vibrational spectra in the C-H stretching region and the structure of the polymethylene chain[J].Spectrochim Acta,1978,34(4):395-406.
[26]Wang Y,Purrello R,Jordan T,etal.UVRR spectroscopy of the peptide bond,1.Amide S,a nonhelical structure marker,is a C.alpha.H bending mode[J].J Am Chem Soc,1991,113(17):6359-6368.
[27]Thomas GJ Jr.Raman spectroscopy of protein and nucleic acid assemblies[J].Annu Rev Biophys Biomol Struct,1999,28:1-27.
[28]Chou I H,Benford M,Beier H T,etal.Nanofluidic biosensing for-amyloid detection using surface enhanced Raman spectroscopy[J].Nano Lett,2008,8(6):1729-1735.
The Interaction of Supported Planar Lipid Bilayers Containing Ganglioside-GM1 with Aβ on Different Substrates
HU Zhi-ping1,2,WANG Xiao-li1,2,ZHANG Zhen-long1,2,CHENG Xiu-ying1,2*,MAO Yan-li1,2
(1.DepartmentofPhysicsandElectronics,HenanUniversity,Kaifeng475004,China;2.InstituteforComputationalMaterialsScience,HenanUniversity,Kaifeng475004,China)
Abstract:Supported planar lipid bilayers are artificial lipid bilayer membranes.Surface structures and properties of the solid substrates can affect the formation process,fluidity,two-dimensional structure and chemical activity of the SPBs,then affect properties of protein.Even onmica and SiO2surfaces,which are flat and biologically inert,and most widely used as the substrates for the supported lipid bilayers,cause differences in the structure and properties of the supported membranes.In this paper,by performing Raman spectroscopy,we analyzed the conformation of SPBs at mica and SiO2.Futhermore,we added the monomer amyloid-beta peptides onto SPBs.The differences between the conformation of amyloid-beta at mica and SiO2 are shown by Raman spectroscopy with different incubation time.
Key words:supported planar lipid bilayers; amyloid-beta peptides; Raman spectroscopy; mica; SiO2
收稿日期:2015-06-15; 修改稿日期:2015-11-11
基金项目:国家自然科学基金(21103043),河南省科技发展计划项目(142102210389)
作者简介:胡智萍(1991-),女,硕士.研究方向为生物物理.E-mail:zhipinghu521@163.com 通讯作者:程秀英.E-mail:943995698@qq.com
文章编号:1004-5929(2016)02-0168-07
中图分类号:O6
文献标志码:A
doi:10.13883/j.issn1004-5929.201602013

