洋常春藤法呢基焦磷酸合酶基因的克隆与序列分析
阮琴妹,曹雄军,2,孙化鹏,钟晓红*
(1.湖南农业大学园艺园林学院,湖南 长沙 410128;2.广西农业科学院葡萄与葡萄酒研究所,广西 南宁530007)
洋常春藤法呢基焦磷酸合酶基因的克隆与序列分析
阮琴妹1,曹雄军1,2,孙化鹏1,钟晓红1*
(1.湖南农业大学园艺园林学院,湖南 长沙 410128;2.广西农业科学院葡萄与葡萄酒研究所,广西 南宁530007)
摘 要:以洋常春藤叶片为材料,采用同源RT–PCR方法,克隆获得了洋常春藤法呢基焦磷酸合成酶基因,其cDNA序列大小为1 050 bp,开放阅读框为1 026 bp,推测编码342个氨基酸残基,该序列的核苷酸、氨基酸与五加科植物有同源性;用在线数据软件进行分析,推测该蛋白可能存在于细胞质之中,定位在细胞膜外,FPS蛋白的相对分子质量为39 735.7;该蛋白含有2个天冬氨酸保守结构域,其二级结构主要以α螺旋和无规则卷曲为主;双子叶植物系统进化树分析结果表明,洋常春藤的FPS与刺五加、人参、三七、西洋参、辽东楤木的FPS亲缘关系最近,这一结果符合传统的分类法规则。
关 键 词:洋常春藤;法呢基焦磷酸合成酶;同源性;五加科植物
投稿网址:http://xb.ijournal.cn
洋常春藤(Hedera helix)为伞形目五加科常春藤属常绿藤本双子叶植物,是兼药用、观赏等多功能使用的优质材料[1–2]。作为一种传统的药用植物,洋常春藤主要的活性成分是三萜皂苷类化合物(常春藤皂苷C和α–常春藤皂苷)[1]。三萜类皂苷化合物在抗肿瘤、抑菌、抗氧化等领域具有广阔的应用前景[3–5]。
法呢基焦磷酸合成酶(farnesyl diphosphate synthase, FPS)是催化法尼基焦磷酸(farnesyl pyrophosphate,FPP)生物合成萜类物质的一种重要前体,在三萜皂苷生物合成途径中起着关键限速酶的作用,对皂苷类化合物的合成累积有重要的作用[6–8]。对普通小麦倍半萜合成途径关键基因FPS进行功能分析的结果表明,FPS基因控制倍半萜化合物的合成量[9]。Wang等[10]克隆了茯苓FPS基因,并对不同生长阶段的茯苓在茉莉酮酸甲酯处理下的总三萜类化合物含量进行了测定,发现茯苓植株中FPS的含量与其合成总三萜类化合物的含量呈正相关关系。目前已有多种植物的FPS基因相继被成功克隆[11–18],如刺五加、人参、西洋参、三七、辽东楤木、绞股蓝等,但洋常春藤FPS基因序列信息在GenBank和文献中均少见报道。本研究中根据NCBI GenBank所登录的五加科植物FPS基因的cDNA序列信息来设计引物,采用RT–PCR法克隆FPS基因,获得其cDNA序列,并对其生物学信息进行分析,旨在探讨FPS基因的表达调控在洋常春藤皂苷类化合物中的作用机制。
1 材料与方法
1.1材料
供试洋常春藤取自湖南农业大学园艺园林学院实验基地,经湖南农业大学观赏园艺教研室鉴定为洋常春藤。
总RNA的提取材料为完全展开的2片洋常春藤叶片。将试验材料以清水冲洗杂质,用滤纸吸干水分后剪成小块状,用锡箔纸迅速分装后立即冻存在液氮中,再转入-80 ℃冰箱中保存备用。
1.2仪器与试剂
PrimeScriptTMⅡ 1ststrand cDNA synthesis Kit 和TaKaRa Ex Taq®购于宝生物工程有限公司(大连TaKaRa 公司);多糖多酚植物RNA提取试剂盒为天根生化科技(北京)有限公司产品;Trans 5k DNA marker、PCR产物回收试剂盒、IPTG、X–gal、pEASY®–T1 Simple克隆试剂盒、Trans1–T1感受态细胞、2×Easy Taq PCR SuperMix(+dye)等均购自北京全式金生物技术有限公司,其他试剂均为国产,分析纯。
1.3洋常春藤FPS基因的克隆
1.3.1洋常春藤总RNA的提取和cDNA单链合成
将洋常春藤样品从-80 ℃冰箱中取出,在液氮中研磨至粉状,用多糖多酚植物RNA提取试剂盒提取其总RNA。用1.0%琼脂糖凝胶电泳检测样品总RNA的完整性。用德国Implen P330超微量分光光度计检测RNA的浓度与纯度。
逆转录反应参照PrimeScriptTMⅡ 1ststrand cDNA synthesis Kit使用说明,选择Oligo dT为引物,合成第一链。将逆转录产物保存在-20 ℃冰箱中备用。
1.3.2引物合成与RT–PCR扩增
利用同源克隆技术,通过比较人参(DQ087959.1)、刺五加(JQ178346.1)、西洋参(GQ401664.1)、三七(DQ059550.1和KJ804175.1)等五加科植物的FPS核苷酸序列的同源性,设计1对FPS基因特异性引物,上游引物FPSF为5'–ACATAAACAGCCAGAATG A–3';下游引物FPSR 为5'–AATTACTTACTTTTGC CGC–3'。引物由铂尚生物技术(上海)有限公司合成。
以洋常春藤样品的逆转录产物cDNA为模板进行FPS基因扩增。PCR反应体系50 μL:TaKaRa Ex Taq(5 U/μL)0.25 μL,10×Ex Taq Buffer(Mg2+free)5 μL,dNTP Mixture(各2.5 mmol/L)4 μL,MgCl2(25 mmol/L)5 μL,引物FPSF(10 mmol/L)和FPSR(10 mmol/L)各1.25 μL,cDNA模板1.5 μL,定量补足ddH2O至50 μL。PCR反应程序:98 ℃变性10 s,53 ℃复性30 s,72 ℃延伸50 s,30个循环;72 ℃延伸7 min。4 ℃保存。PCR扩增产物用1.0 %琼脂糖凝胶电泳鉴定。
1.3.3PCR产物回收、克隆及序列测定
按照PCR产物回收试剂盒说明书进行回收,用德国Implen P330超微量分光光度计检测回收产物RNA的浓度与纯度。取20 ng回收产物与pEASY®–T1 Simple载体连接,转化大肠杆菌Trans1–T1感受态细胞,待其复苏后分别涂布在含有卡那霉素、X–gal和IPTG的LB固体培养基平板上。将该平板置于37 ℃培养箱中培养12 h,12 h后观察培养皿内菌落的长势与分布情况,并在超净工作台上进行蓝白斑重组子筛选。用PCR方法鉴定阳性克隆。PCR扩增反应体系50 μL:2×Easy Taq PCR SuperMix(+dye)25 μL,引物M13F(10 μmol/L) 和M13R(10 μmol/L)各1 μL,模板1 μL,定量补足ddH2O至50 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸50 s,30个循环;72 ℃延伸5 min。4 ℃保存。取10 μL的PCR扩增产物,用1.0%琼脂糖凝胶电泳鉴定为阳性后,用含有卡那霉素的LB液体培养基过夜培养,送铂尚生物技术(上海)有限公司测序。
1.3.4序列分析方法
用序列处理在线工具包(SMS)对洋常春藤FPS 的cDNA序列进行序列氨基酸翻译;利用BLAST搜索NCBI上的FPS核苷酸和氨基酸数据库,比对数据库中洋常春藤近缘物种的FPS序列信息;用MEGA 6.06软件构建系统发育树;用在线工具ProtParam、TMHMM与PSORT、SOPMA、ScanProsite和SWISS–MODEL分别预测或分析洋常春藤FPS蛋白的基本理化性质、蛋白的跨膜区与定位、蛋白质二级结构、蛋白功能结构域和蛋白质的三维结构。
2 结果与分析
2.1洋常春藤总RNA提取与FPS基因扩增结果
由图1可见,所提取洋常春藤样品总RNA的28 S和18 S的条带完整清晰,且28 S的亮度是18 S 的2倍左右,表明所提取总RNA的完整性较好。用紫外分光光度法测得洋常春藤样品总RNA的OD260 nm与OD280 nm的比值为1.91,OD260 nm与OD230 nm的比值为2.10,表明总RNA的纯度较高,可用于后续试验。

图1 洋常春藤总RNA的电泳结果Fig.1 Electrophoretogram of total RNA from RT–PCR products of Hedera helix
参照PrimeScriptTMⅡ 1ststrand cDNA synthesis Kit使用说明,成功获得逆转录产物cDNA,并将其作为洋常春藤FPS基因的扩增模板。用所设计的特异引物进行洋常春藤FPS基因PCR扩增。琼脂糖凝胶电泳结果(图2)表明,扩增产物条带单一且清晰,大小为1 050 bp,符合预期。将此扩增产物进行切胶、纯化和回收。

图2 洋常春藤FPS基因产物的电泳图谱Fig.2 Electrophoretogram of RT–PCR products from gene FPS in Hedera helix
2.2洋常春藤FPS基因的cDNA克隆
培养皿内菌落长势一致,分布平均,阳性率高达90%。菌落PCR扩增后经1.0%的琼脂糖凝胶电泳检测(图3),得到阳性克隆片段的长度与上述以cDNA为模板得到的扩增产物的长度相符,表明上述扩增片段已经连接到pEASY®–T1 Simple载体上,洋常春藤FPS基因的cDNA已被克隆。
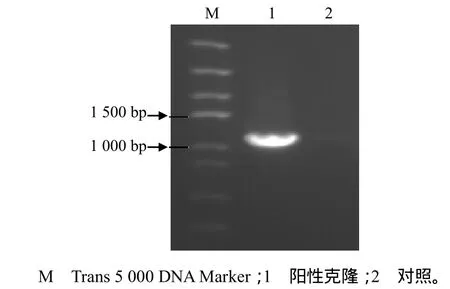
图3 菌落的PCR鉴定结果Fig.3 Result of PCR identification from colonies
2.3洋常春藤FPS基因cDNA序列的同源性分析
试验获得的洋常春藤FPS基因的cDNA片段长度为1 050 bp。该片段的翻译起始位点在第16位碱基处,终止密码子TAA位于1 042 bp处。FPS基因的开放阅读框共1 026个碱基,编码342个氨基酸(图4),与预期结果相符。洋常春藤FPS基因的核苷酸序列与刺五加(JQ178346.1)、人参(DQ087959.1)、西洋参(GQ401664.1)、三七(DQ059550.1、KJ804175.1)和辽东楤木(HM219226.1、JX067865.1)的FPS核苷酸序列的相似性最高,分别为98%、97%、97%、97% 和97%;与伞形科植物积雪草(AY787627.1)、北柴胡(HQ123429.1)和菊科三脉紫菀(JX424564.1)的核苷酸序列的相似性较低,分别为91%、88%和82%,上述8种植物的FPS氨基酸序列与洋常春藤FPS氨基酸序列的一致性分别为97%、97%、97%、97%、96%、94%、93%和86%。在GenBank中未查询到五加科洋常春藤植物的FPS基因序列信息。

图4 洋常春藤FPS基因的cDNA序列及推测的氨基酸序列Fig.4 Deduced sequence of amino acid and cDNA of gene FPS in Hedera helix
2.4洋常春藤FPS蛋白的系统进化分析结果
用MEGA 6.06软件,将洋常春藤FPS蛋白与GenBank中登录的20种双子叶植物的FPS蛋白进行聚类分析,构建FPS蛋白系统进化树(图5)。洋常春藤FPS蛋白首先与刺五加聚为一支,可信度达84%;后与三七、人参、西洋参和辽东楤木等五加科植物的FPS蛋白聚为一支,可信度达97%;再与同一伞形目植物积雪草聚为一支,可信度达100%,说明洋常春藤FPS蛋白与五加科、伞形目植物的FPS蛋白亲缘关系最近。洋常春藤FPS蛋白与双子叶植物如葫芦目、豆目等的FPS蛋白聚为一大支,这与传统的分类结果一致,表明洋常春藤FPS蛋白与其他双子叶植物FPS蛋白是从同一祖先进化而来,它们具有相似的酶催化功能。

图5 洋常春藤FPS蛋白的系统进化分析结果Fig.5 Phylogenetic tree of protein FPS in Hedera helix
2.5 洋常春藤FPS蛋白的预测分析
用Expasy在线工具的ProtParam预测蛋白质的基本理化性质,测得洋常春藤FPS蛋白的相对分子质量为39 735.7,理论等电点(pI)为5.55。由PSORT分析结果得知,洋常春藤FPS蛋白存在于细胞质之中。由TMHMM分析结果得知,洋常春藤FPS蛋白全部定位于细胞膜外,无跨膜区域。洋常春藤FPS蛋白的二级结构(图6)中含有220个α螺旋(alpha helix),占二级结构总数的59.06%;含有34个延伸链(extended strand),占二级结构总数的9.94%;含有15个β折叠(beta turn),占二级结构总数的4.39%;含有91个无规则卷曲(random coil),占二级结构总数的26.61%。由ScanProsite分析洋常春藤FPS蛋白功能结构域的结果得知,FPS的氨基酸序列含有2个天冬氨酸保守结构区域(一般为特异性识别异戊烯基转移酶所具有)。这2个天冬氨酸保守结构区域在洋常春藤FPS氨基酸序列的90~104和224~236位置处,分别为LVLDDIMDSSHTRRG和MGTYFQVQDDYLD。用SWISS–MODEL预测,得到了洋常春藤FPS蛋白的三维结构模型(图7)。模型覆盖范围为4~342;模型序列与同源模型序列的一致性为83.53%;模型样本是[4kk](2.1.Å)。
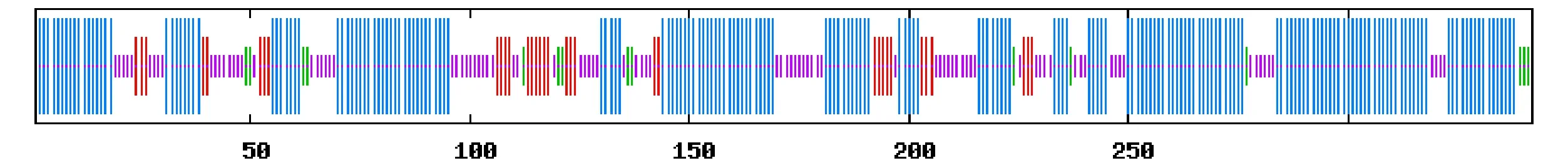
图6 洋常春藤FPS蛋白的二级结构预测结果Fig.6 Predicted secondary structure of protein FPS in Hedera helix

图7 洋常春藤FPS蛋白的三级结构预测结果Fig.7 Predicted 3D structure of protein FPS in Hedera helix
3 结论与讨论
高质量的RNA是RT–PCR及基因克隆成功的重要保证,但洋常春藤是一种多糖多酚藤本植物,用一般的提取方法来得到其核酸有一定的难度[19],因此,试验中采用了多糖多酚植物总RNA的提取试剂和提取方法并稍加改进。
三萜皂苷类化合物是经异戊二烯途径产生的,该途径分为起始阶段、骨架构建阶段和修饰阶段共三个阶段。起始阶段是该途径中生成前提物质必不可少的环节。FPS在起始阶段起着重要的作用,它能使香叶二磷酸(geranyl pyrophosphate, GPP)转化成FPP,最终获得不同类型的三萜皂苷类化合物[6]。本试验中克隆获得的洋常春藤FPS的核苷酸和氨基酸序列与其他植物的FPS相比均有同源性,其中与五加科植物刺五加、人参、三七、西洋参、辽东楤木的一致性最高,均高达97%;双子叶植物系统进化树分析结果表明,洋常春藤的FPS蛋白先与五加科植物的FPS蛋白聚为一支,说明它们的亲缘关系最近。这也证实了洋常春藤植物与五科植物的FPS基因有同源性。洋常春藤FPS基因的同源性分析结果与预期结果[14]相符,这一结果也符合传统的植物分类规则。
洋常春藤FPS的氨基酸序列含有2个特异性识别天冬氨酸保守结构区域,位于序列的90~104 (LVLDDIMDSSHTRRG)和224~236(MGTYFQVQD DYLD)位置上。此预测结果与邢朝斌等[17]对刺五加FPS基因的分析研究结果完全一致。这2个富含天冬氨酸的结构域DDXXD被认为是酶与底物的结合位点,是这一类异戊烯基转移酶的活性中心[20]。这表明克隆得到的洋常春藤FPS基因属于该家族。
洋常春藤FPS蛋白定位于细胞质之中,它可以为合成萜类化合物的前体提供物质保障。此外,该蛋白仅存在于细胞膜外,无跨膜区域,没有任何隔离cDNA编码FPS基因的结构,表明洋常春藤可能只有1个FPS基因。该结果与Xiang等[21]对腊梅FPS基因的研究结果一致。洋常春藤FPS蛋白的二级结构主要以α螺旋为主,无规则卷曲次之,延伸链和β折叠较少;三维结构预测模式图的模型序列与同源模型序列的一致性高达83.53%,说明洋常春藤FPS蛋白与其他物种FPS蛋白的核心结构一致。这也进一步证明洋常春藤的FPS蛋白是一个在萜类化合物合成途径中起重要作用的功能蛋白[17]。
本研究中成功克隆了洋常春藤的FPS基因,并对该基因的生物学信息进行了分析。研究结果表明,洋常春藤的FPS基因片段与其他物种的FPS基因片段具有一定的共同特征[7],它可能与其他植物的FPS基因起着相同或相似的生物学功能,参与了三萜皂苷类化合物的生物合成过程[22]。
参考文献:
[1] Lutsenko Y,Bylka W,Matlawska I,et al.Hedera helix as a medicinal plant[J].Herba Polonica,2010,56(1):83–96.
[2] 李秀芬,张德顺,王小青,等.常春藤应用概述[J].山东林业科技,2002(3):39–40.
[3] 程晓华,熊玉卿.五环三萜皂苷的药代动力学研究进展[J].中国临床药理学杂志,2008,24(5):443–446.
[4] 韩红霞,吕世静.三萜皂苷类化合物抗肿瘤机制的研究新进展[J].中国医院药学杂志,2010,30(1):64.
[5] 孙延芳,梁宗锁,刘政,等.酸枣果三萜皂苷抑菌和抗氧化活性的研究[J].食品工业科技,2012,33(6):139–142.
[6] 陈颖,孙海燕,曹银萍.三萜皂苷生物合成途径研究进展[J].中国野生植物资源,2013,31(6):15–17.
[7] 李嵘,王喆之.植物法呢基焦磷酸合成酶的生物信息学分析[J].热带亚热带植物学报,2007,15(2):126–134.
[8] 唐克轩,沈乾,付雪晴,等.植物次生代谢产物生物反应器研究进展[J].中国农业科技导报,2014,16(1):7–15.
[9] 张彦.普通小麦倍半萜合成途径关键基因Tafps的鉴定和功能分析[D].北京:中国农业科学院,2012.
[10] Wang J,Li Y,Liu D.Cloning and characterization of farnesyl diphosphate synthase gene involved in triterpenoids biosynthesis from Poria cocos[J]. International Journal of Molecular Sciences,2014,15(12):22188–22202.
[11] Zhao Y J,Chen X,Zhang M,et al.Molecular cloning and characterisation of farnesyl pyrophosphate synthase from Tripterygium wilfordii[J].Plos One,2015,10(5):e0125415.
[12] Su S S,Zhang H M,Liu X Y,et al.Cloning and characterization of a farnesyl pyrophosphate synthase from Matricaria recutita L.and its upregulation by methyl jasmonate[J].Genetics and Molecular Research:GMR,2014,14(1):349–361.
[13] Ferriols V M,Yaginuma R,Adachi M,et al.Cloning and characterization of farnesyl pyrophosphate synthase from the highly branched isoprenoid producing diatom Rhizosolenia setigera[J].Scientific Reports,2015(5):10246.
[14] 蒋东,唐银琳,陶晨陈,等.绞股蓝法呢基焦磷酸合酶基因的克隆及其序列分析[J].生物技术通讯,2014,25(2):198–202.
[15] 蒋东.绞股蓝法呢基焦磷酸合酶(FPS)基因的克隆及其原核表达[D].南宁:广西医科大学,2014.
[16] 牛云云.三七,西洋参中三萜皂苷合成关键酶基因的克隆及表达模式分析[D].北京:北京协和医学院,2013.
[17] 邢朝斌,龙月红,何闪,等.刺五加法呢基焦磷酸合酶基因的克隆、生物信息学及表达分析[J].中国中药杂志,2012,37(12):1725–1730.
[18] 吴颖.辽东楤木三萜皂苷合成相关基因克隆及功能研究[D].长春:吉林大学,2011.
[19] 那冬晨,邓俊敏.常春藤总DNA提取方法的改进[J].北方园艺,2008(9):162–163.
[20] Szkopiñska A,Plochocka D.Farnesyl diphosphate synthase, regulation of product specificity[J].Acta Biochim Polonica,2005,52(1):45–55.
[21] Xiang L,Zhao K,Chen L.Molecular cloning and expression of Chimonanthus praecox farnesyl pyrophosphate synthase gene and its possible involvement in the biosynthesis of floral volatile sesquiterpenoids[J].Plant Physiology and Biochemistry,2010,48(10):845–850.
[22] 蒙姣荣,陈本勇,黎起秦,等.罗汉果法呢基焦磷酸合成酶基因的克隆及其序列分析[J].中草药,2011,42(12):2512–2517.
责任编辑:王赛群英文编辑:王 库
Cloning and sequence analyzing of farnesyl pyrophosphate synthase from Hedera helix
Ruan Qinmei1, Cao Xiongjun1,2, Sun Huapeng1, Zhong Xiaohong1*
(1.College of Horticulture and Landscape, Hunan Agricultural University, Changsha 410128, China; 2.Grape and Wine Research Institute, Guangxi Academy of Agricultural Science, Nanning 530007, China)
Abstract:In this study, cDNA encoded farnesyl diphosphate synthase (FPS) was cloned using homology RT–PCR method from Hedera helix leaves. The results revealed that sequence of the cDNA with 1 050 bp base had an open reading frame of 1 026 bp and 342 amino acid residues. The sequence of nucleotides and amino acids of FPS were homology with those of araliaceous plants; according to the online prediction, the FPS, with a 39 735.7 relative molecular mass of the protein, stored in cytoplasm and located in the outer membrane; the speculated FPS contained two conserved domains of aspartic acid, and its secondary structure was mainly dominated with alpha helix and random coil; phylogenetic analysis on amino acid sequence of the FPS in dicotyledons showed that the FPS was closely related to Eleutherococcus senticosus, Panax ginseng, Panax notoginseng, Panax quinquefolius and Aralia elata, which were consistent with the traditional classification rules.
Keywords:Hedera helix; farnesyl pyrophosphate synthase; homology; Araliaceous plants
中图分类号:Q943.2
文献标志码:A
文章编号:1007−1032(2016)02−0136−06
收稿日期:2015–07–08 修回日期:2016–03–07
基金项目:湖南省研究生科研创新项目(CX2014B290);湖南省教育厅科研项目(15A089)
作者简介:阮琴妹(1989—),女,福建周宁人,硕士研究生,主要从事园艺植物功能成分利用研究,1182134891@qq.com;*通信作者,钟晓红,教授,主要从事药用植物资源高值化利用研究,xh–zhong@163.com

