响应面法优化混菌发酵野木瓜果酒产酯工艺的研究
韦广鑫,张 丹,曾凡坤,周永文,张惟广(.西南大学食品科学学院,重庆40075;.重庆金立方酒业股份有限公司,重庆4040)
响应面法优化混菌发酵野木瓜果酒产酯工艺的研究
韦广鑫1,张丹1,曾凡坤1,周永文2,张惟广1
(1.西南大学食品科学学院,重庆400715;2.重庆金立方酒业股份有限公司,重庆401420)
摘要:通过单因素实验与响应面分析法优化混菌发酵野木瓜果酒的工艺参数,探讨混菌方式、接种量、SO2添加量、发酵温度、pH值对总酯含量的作用规律。结果表明,间隔3d接种(异常汉逊酵母接种3d后接种sy酿酒酵母),异常汉逊酵母接种量为1.88×105cfu/mL、sy酿酒酵母接种量为1.63×107cfu/mL,温度为18℃,SO2添加量为100 mg/L,pH3.55,在此条件下,发酵产出的野木瓜果酒总酯含量达到19.350 mg/L±0.712 mg/L,比纯种发酵时的总酯含量高出1.7倍。
关键词:野木瓜果酒;混菌发酵;总酯;响应面法;果酒
优先数字出版时间:2016-03-24;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160324.1202.003.html。
野木瓜(Stauntonia chinensis)属蔷薇科灌木丛植物,为中国特有果木之一,素有“百益之果”美称,主要分布于贵州正安县、重庆綦江等地。野木瓜皮薄肉厚、风味浓郁、品质优良,富含氨基酸、维生素、矿物质、有机酸和酶等,其中有机酸包括柠檬酸、齐墩果酸等,酶包括过氧化氢酶、超氧化物歧化酶(SOD)等[1]。由于野木瓜鲜食品种存在糖酸比极低、果实坚硬等特点,不适宜直接食用,通常将其制成野木瓜果脯、果酒、果醋等,为在充分利用资源的同时,又提高产品附加值。重庆金立方酒业集团采用活性干酵母纯种发酵野木瓜果酒,酿制出色泽金黄、果香淡雅、诸味协调的野木瓜果酒。虽然果酒成品品质得到了保证,但酒液风格单调、风味淡薄,缺乏果味和酯香,难以达到高品质野木瓜果酒的要求。
自然发酵的葡萄酒与人工接种酿酒酵母发酵的葡萄酒相比,酒液风味浓郁,香气怡人,风格典型。主要是因为自然发酵过程中的酵母群体更为复杂,酿酒酵母主要完成酒精发酵,而非酿酒酵母能够合成多种酶,将原料中的前体物质转化成为酯类、酸类、高级醇等,后者对于果酒的风味影响更加显著[2]。于是有研究者提出将非酿酒酵母与酿酒酵母混合发酵,在保证发酵效率的同时,提高酒液中的酯类物质含量,丰富果酒香气品质。Rojas等[3]将非酿酒酵母(Hanseniaspora guilliermondii 11104和Pichia anomala 10590)与酿酒酵母混合发酵,发现前者能够显著提高葡萄酒中乙酸乙酯、乙酸异戊酯和2-乙酸苯乙酯的含量。Clemente-Jimenez J M等[4]发现Pichia fermentans与Saccharomyces cerevisiae顺序混菌发酵,能够显著提高乙醛、乙酸乙酯、正丙醇、正丁醇、辛酸乙酯、2,3-丁二醇、甘油等物质的含量。汪立平等[5]利用法尔皮有孢汉逊酵母混合酵母属酵母顺序发酵苹果酒,使苹果酒总酯浓度提高为酿酒酵母纯种发酵时的1.60倍,且发酵时间与纯种发酵相同,均为31d。课题组根据非酿酒酵母的耐酒精、耐SO2、耐酸、凝聚性、发酵效率等酿造特性[6],筛选出1株适宜野木瓜果酒发酵的异常汉逊酵母(Hansenula anomala),以此与安琪SY酿酒酵母混合发酵,利用响应面法优化混菌发酵工艺,以期为高品质野木瓜果酒的开发提供理论依据。
1材料与方法
1.1材料与仪器
野木瓜:采收于重庆市綦江区。sy酿酒酵母:安琪酵母有限公司;异常汉逊酵母(H.anomala SICC 2.96),四川省食品发酵工业研究设计院。酵母营养添加物:法国LAFFORT公司。2-辛醇(色谱纯):Sigma公司。正构烷烃混标:C3—C9、C10—C25,百灵威科技有限公司。其他试剂均为国产分析纯或色谱纯。
仪器设备:榨汁机、ZWY-2102C恒温培养振荡器(上海智城分析仪器制造有限公司)、LHS-150SC恒温恒湿培养箱(上海齐欣科学仪器有限公司)、PB-10酸度计(德国赛多利斯集团)、UV1000紫外可见分光光度计(上海天美科学仪器有限公司)、BX43型显微镜(日本OLYMPUS公司)、手动SPME进样器、50/30μm DVB/CAR/PDMS萃取头(美国SUPELCO公司);QP2010气相色谱-质谱联用仪(日本岛津公司)。
1.2实验方法
1.2.1种子液的培养
异常汉逊酵母:从斜面种子上接1环于40mL豆芽汁培养基于28℃、120r/min条件下振荡培养18h后,混匀,取1mL于显微镜下,通过血球平板记数法计数。记下活菌数为7.50×107cfu/mL。
安琪sy酵母:将酵母粉用10%的糖水活化后,混匀,取1mL于显微镜下,通过血球平板记数法计数,活菌数为6.5×107cfu/mL。
107cfu/mL接种方式为取25mL种子液,8000r/min离心15min,用无菌水洗涤2次后,将菌泥接入100mL发酵液中。H.anomala在发酵液中初始活菌数为1.88× 107cfu/mL,sy酿酒酵母初始活菌数为1.63×107cfu/mL。105cfu/mL、103cfu/mL接种方式为将上述种子液稀释至相应倍数接入。
1.2.2野木瓜果酒酿造工艺
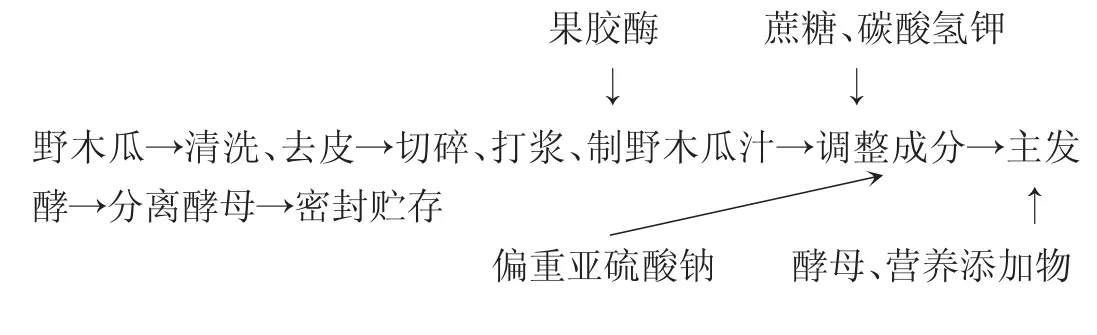
操作要点:挑选成熟无霉变的野木瓜,清洗、去皮籽、切碎,按1∶1加水打浆,制成野木瓜汁,加入0.02%果胶酶,45℃处理3~4h,再加入一定量偏重亚硫酸钠,搅拌均匀。添加蔗糖、碳酸氢钾,调整野木瓜汁外观糖度为22ºBrix,适当pH值,准备接种发酵。取调整好的野木瓜汁100mL置于150mL发酵锥形瓶中,调节发酵温度,接入酵母,同时加入0.3 g/L酵母营养添加物。发酵至外观糖度不变时,即为主发酵结束。分离酵母,密封酒液,置于4℃冰箱中保存[7]。
1.2.3香气提取方法(固相微萃取法)
取8mL酒液放入20mL萃取瓶中,加入2 g NaCl促进香气的挥发,加入20 μL2-辛醇(浓度为0.4914 mg/mL)作内标,用聚四氟乙烯隔垫密封,于45℃下水浴平衡15min后,插入活化好的萃取头,推出纤维头,顶空吸附40min后,插入到GC进样口解析5min。
GC条件:DB-5MS石英毛细管柱(30m×0.25 mm× 0.25μm);进样口温度为230℃;升温程序:35℃保持4min,以5℃/min升至55℃,保持2min,再以8℃/min升至120℃,再以10℃/min升至230℃,保持4min。载气为氦气,流速1mL/min,压力47.7 kPa。分流比为5∶1。
MS条件:电离方式EI;电子能量70 eV;离子源温度230℃;采集模式:全扫描;四级杆温度150℃;质量扫描范围m/z 40~450;扫描速率769 u/s。
1.2.4总酯含量的测定
安琪sy酿酒酵母酿造出的野木瓜酒[7]主要酯类物质为乙酸异戊酯、己酸乙酯、苯甲酸乙酯、辛酸乙酯、乙酸苯乙酯、癸酸乙酯、反式-4-癸烯酸乙酯、月桂酸乙酯、棕榈酸乙酯。总酯记为上述9种酯类物质之和。各组分含量采用内标法进行半定量,2-辛醇为内标物。
计算公式:香气成分的含量=f(校正因子)×各组分的峰面积×内标样浓度/内标样的峰面积(校准因子设为1)[8]。
1.2.5单因素实验
改变混菌方式、接种量、发酵温度、SO2添加量、pH值中的一个因素,固定其他因素不变,进行单因素实验。因素水平如下:pH值(3.00、3.25、3.50、3.75、4.00);SO2添加量(80 mg/L、100 mg/L、120 mg/L、140 mg/L、160 mg/L);发酵温度(15℃、18℃、20℃、22℃、25℃);混菌方式(同时接种、间隔3d接种、间隔5d接种、间隔10d接种和间隔15d接种);接种量(2种酵母分别为103cfu/mL、105cfu/mL、107cfu/mL)。
1.2.6响应面优化实验
根据单因素实验结果,选择合适的因素水平进行响应面实验设计,以获得最高总酯含量。利用Design-Eepert8.0.6软件中的多元二次回归方程拟合因素与响应值之间的关系,通过分析回归方程得出最佳工艺及最大响应值。
计算公式为Y=a+i=1kbxi+j=1kcxj2+dxixj,式中Y为预测值,a为常数项,b为一次项系数,c为二次项系数,d为交互作用项系数。
2结果与分析
2.1单因素实验结果与分析
pH值对总酯含量的影响:混菌方式为同时接种,异常汉逊酵母与安琪sy果酒酵母的接种量均为107cfu/mL,发酵温度为22℃,SO2添加量为100 mg/L的条件下,用碳酸氢钾调节野木瓜发酵汁pH值为3.00、3.25、3.50、3.75、4.00,探讨pH值对总酯含量的影响。由图1可知,野木瓜果酒的总酯含量随着pH值的增大呈先增大后下降的趋势。pH值为3.5时,总酯含量最大,为8.30 mg/L;pH值在3.00~3.50之间时,总酯含量增大,原因是酵母在过酸条件下生长代谢受到抑制,随着pH值的增大,酵母生长逐渐恢复正常。当pH值增大到3.50以上时,总酯含量反而开始降低,这是因为酯类化合物产生途径之一为酸类化合物与醇类化合物在酯酶作用下缩合而成[9],碳酸氢钾调节pH值的过程中,会中和部分有机酸,导致总酯含量降低。
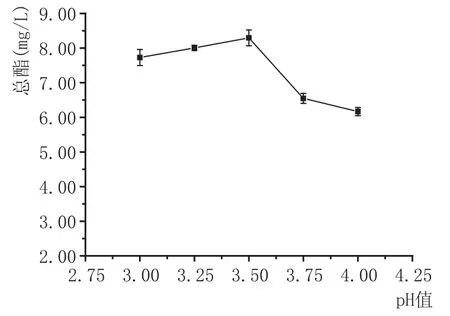
图1 pH值对野木瓜果酒总酯含量的影响
SO2添加量对总酯含量的影响:混菌方式为同时接种,异常汉逊酵母与安琪sy果酒酵母的接种量均为107cfu/mL,发酵温度为22℃,pH3.50,用偏重亚硫酸钠调节SO2添加量为80 mg/L、100 mg/L、120 mg/L、140 mg/L、160 mg/L,探讨SO2对总酯含量的影响。由图2可知,在一定范围内(120 mg/L以下),总酯含量无明显变化,继续增加SO2添加量,总酯含量逐渐降低。这是因为SO2的添加抑制了发酵初期生长旺盛的异常汉逊酵母,而对sy酿酒酵母影响较小,非酿酒酵母对于酯类物质的产生更有意义[10]。SO2添加量过低会存在食品安全风险,因此SO2添加量选为100 mg/L。
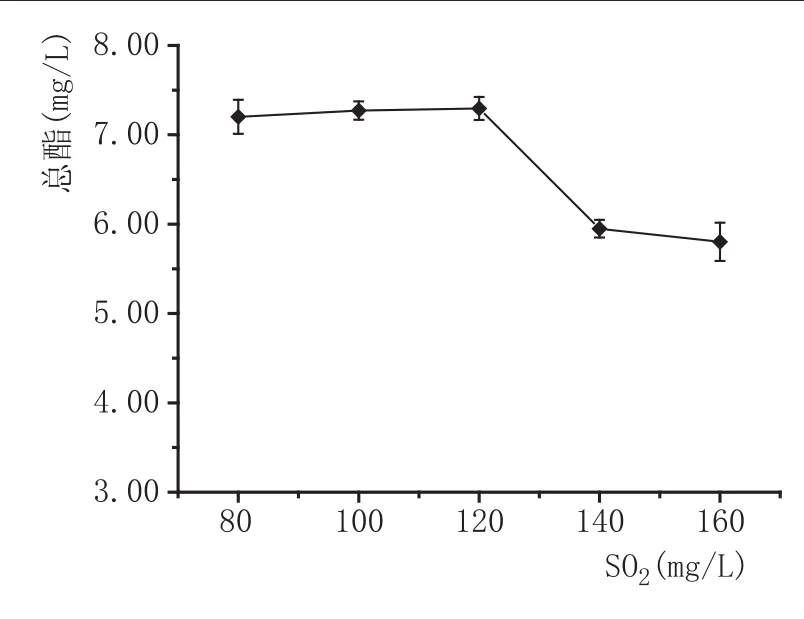
图2 SO2添加量对野木瓜果酒总酯含量的影响
发酵温度对总酯含量的影响:混菌方式为同时接种,异常汉逊酵母与安琪sy果酒酵母的接种量均为107cfu/mL,发酵温度为22℃,SO2添加量为100 mg/L时,探讨发酵温度分别为15℃、18℃、20℃、22℃、25℃对野木瓜果酒总酯含量的影响。由图3可知,总酯含量在上述温度区间内,随温度的升高先增加再减少。18℃条件下,产酯量最高,为15.14 mg/L。15℃、18℃、20℃产酯量明显高于22℃、25℃,这是因为低温发酵趋向于产生更多的酯类化合物,Molina A.M[11]对比了15℃和28℃发酵温度下的葡萄酒总酯含量(包括乙酯类化合物和乙酸酯类化合物),发现前者比后者高出88.55%。图3中,15℃总酯含量低于18℃,可能是因为低温抑制了酵母的生长,导致发酵不彻底,15℃发酵出的果酒残糖(8.32 mg/mL)高于18℃(6.78 mg/mL)也证实了这一点。
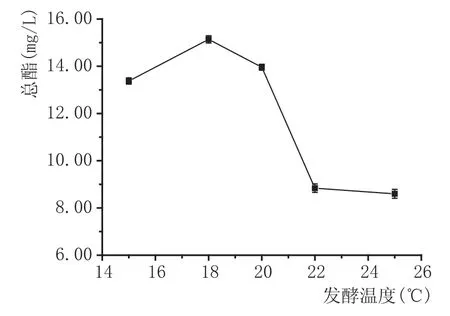
图3发酵温度对野木瓜果酒总酯含量的影响
混菌方式对总酯含量的影响:异常汉逊酵母与安琪sy果酒酵母的接种量均为107cfu/mL,发酵温度为22℃,pH3.50,SO2添加量为100 mg/L时,根据果酒发酵降糖规律,设定2种酵母同时接种、间隔3d接种、间隔5d接种、间隔10d接种和间隔15d接种,探讨混菌方式对总酯含量的影响。由图4可知,总酯含量随酵母接种间隔时间的延长,呈先增加后减少的趋势。先接种异常汉逊酵母,间隔3d接种酿酒酵母所酿制的野木瓜果酒产酯最高,为13.32 mg/L。间隔3d、5d发酵果酒酯类物质高于同时接种发酵果酒,说明顺序发酵优于同时发酵,顺序发酵更接近传统葡萄酒酿造过程中酵母种群数量变化规律[12-13]。另外,2种酵母接种间隔时间过长,也不利于产酯。综合考虑,选择间隔3d接种的顺序发酵方式进行混菌发酵实验。
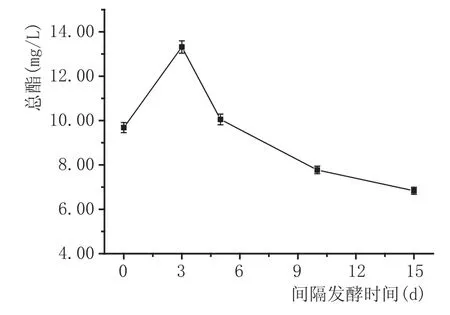
图4混菌方式对野木瓜果酒总酯含量的影响
接种量对总酯含量的影响:混菌方式为同时接种,发酵温度为22℃,pH3.50,SO2添加量为100 mg/L时,依据Comitini F等[14]混菌发酵接种量,探讨异常汉逊酵母与安琪sy果酒酵母的接种量分别为103cfu/mL、105cfu/mL、107cfu/mL时对总酯含量的影响。由表1可知,sy接种量取一定值,异常汉逊酵母接种量增大时,总酯含量并无明显提高(p>0.05)。反之,异常汉逊酵母接种量一定时,sy接种量增大时,总酯含量变化也不显著(p〉0.05),但其还原糖含量显著降低(p=0.025<0.05),当安琪sy果酒酵母接种量达到107cfu/mL时,残糖含量较低,表明其发酵完成度较高。选择安琪sy果酒酵母接种量为107cfu/mL,异常汉逊酵母分别为103cfu/mL、105cfu/mL、107cfu/mL,进行响应面分析实验。
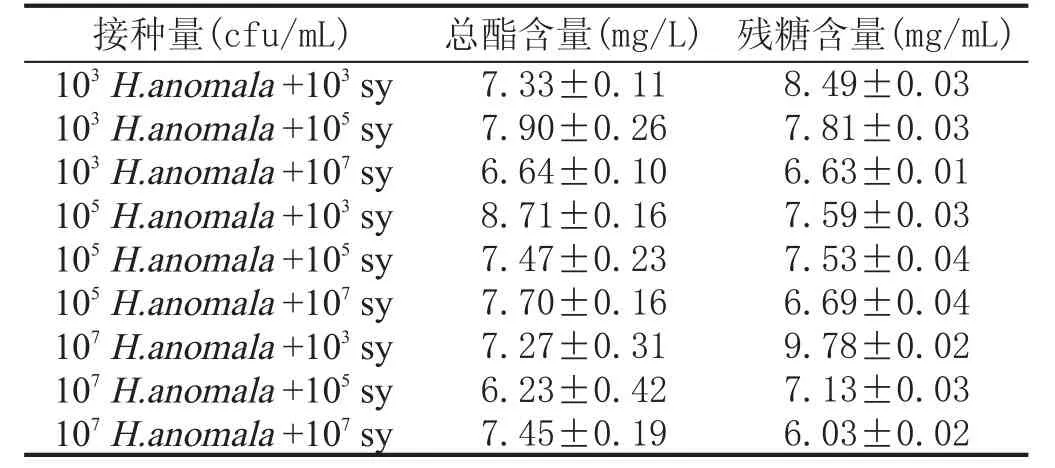
表1接种量对总酯含量及还原糖含量的影响
2.2响应面优化实验
在单因素实验的结果基础之上,选取接种量(异常汉逊酵母分别为103cfu/mL、105cfu/mL、107cfu/mL,安琪sy果酒酵母为107cfu/mL)、温度(16℃、18℃、20℃)、pH值(3.40、3.50、3.60)为自变量,以总酯含量作为响应值,根据Box-Behnken实验设计原理设计3因素3水平的响应面实验。实验方案及结果见表2。
对响应面实验结果进行多元线性回归和二项式拟合,得到关于Y的回归方程:
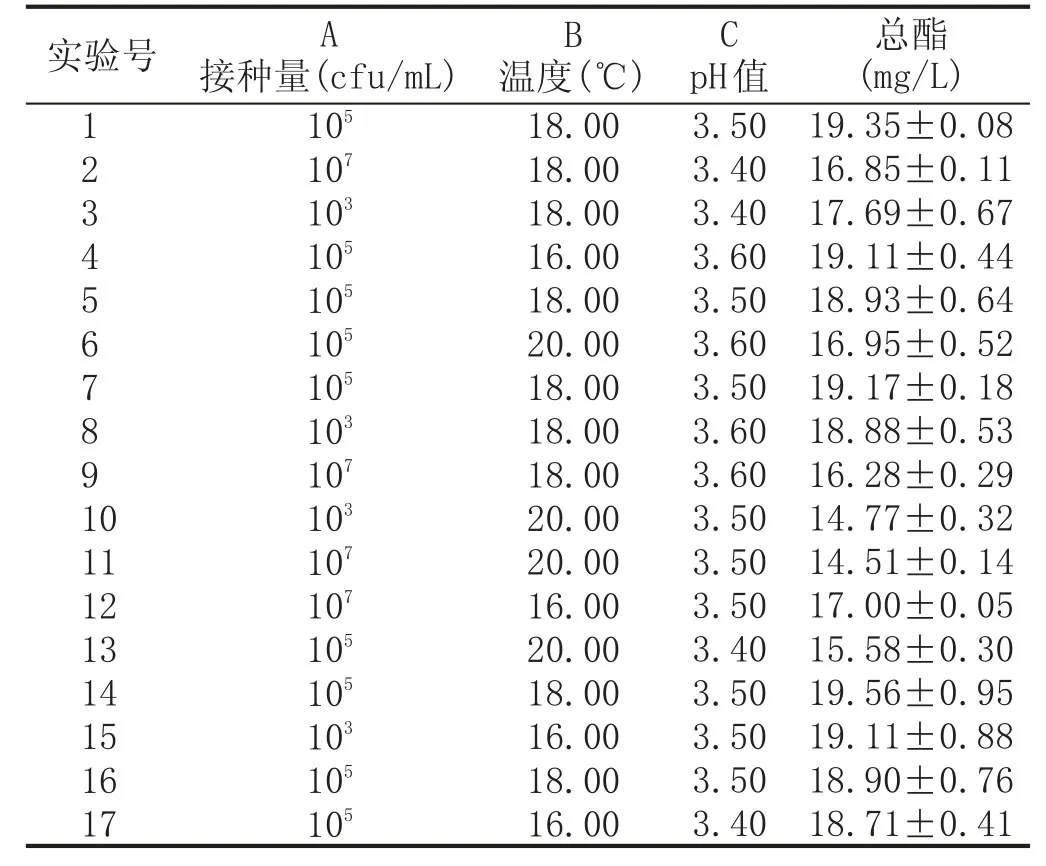
表2响应面实验设计及结果
Y=19.18-0.73A-1.52B+0.30C+0.46AB-0.44AC+ 0.24BC-1.50A2-1.34B2-0.26C2。
式中:A表示异常汉逊酵母接种量,B表示发酵温度,C表示发酵初始液pH值。
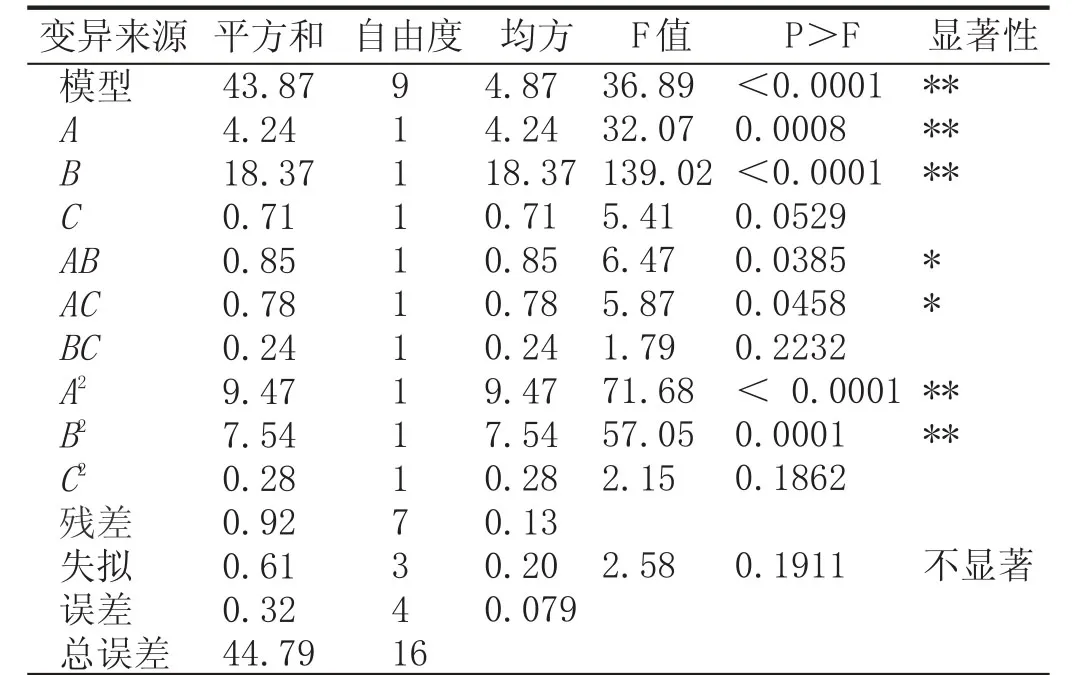
表3响应面分析法对总酯含量的方差分析
由表3可知,以总酯含量为响应值时,模型p<0.01,表明二次方程模型极显著。失拟项p=0.1911>0.05不显著,说明回归方程拟合度较高,数学模型稳定,可用该数学模型对不同发酵条件下野木瓜果酒中的总酯含量进行预测。方程相关系数为R2=0.9794,表明该模型反映97.94%的因变量与自变量的关系。
由p值可知,一次项A、B和二次项A2、B2对野木瓜果酒的总酯含量影响极显著(p<0.01),二次项AB、AC影响显著(p<0.05),C、BC、C2影响不显著(p>0.05)。根据F值,判断各因素对总酯含量的影响大小依次为温度、接种量、pH值,说明温度对于总酯含量的影响最显著。
响应面图的曲面坡度越大,则因素的改变对于响应值的影响越显著,表明两因素交互作用对响应值的影响越大。反之,响应面图曲面越平缓,则因素对于响应值的影响不显著,两因素交互作用对响应值的影响较小。等高线直观地反映出两个因素之间交互作用的显著程度,其中椭圆越扁平或椭圆的轴线与坐标轴之间角度越大,则表明两因素交互作用越显著,反之,则不显著[15-16]。根据上述性质图5—图7可知,接种量与温度、接种量与pH值交互作用显著,而接种量与温度交互作用不显著。在因素所考察的范围内,总酯含量随着温度、接种量的增加,先增加后减小。而在pH3.40~3.60范围内,其改变对总酯含量影响不显著。这与表3方差分析结果一致。
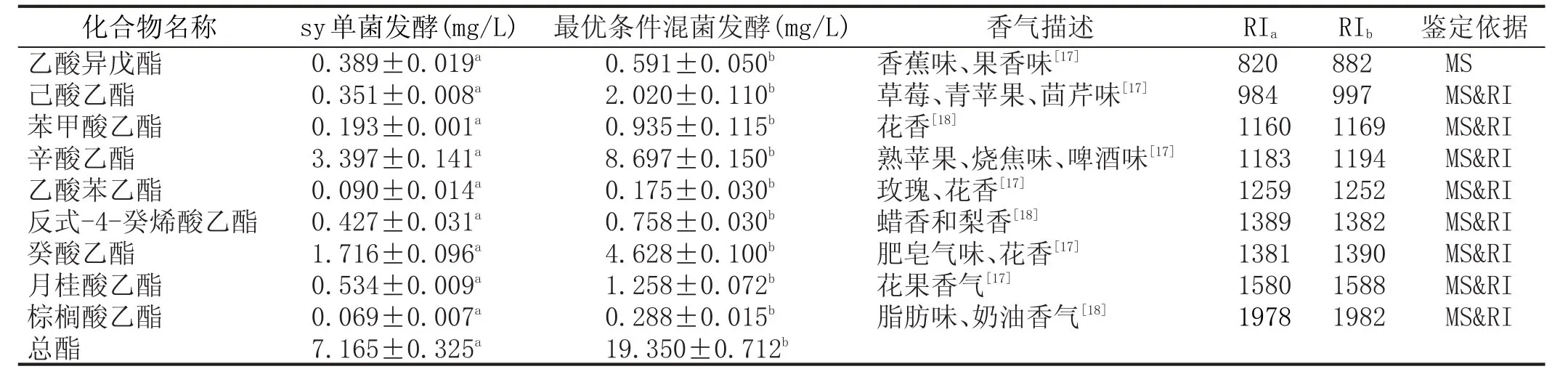
表4混菌发酵与单菌发酵野木瓜果酒主要酯类物质含量比较
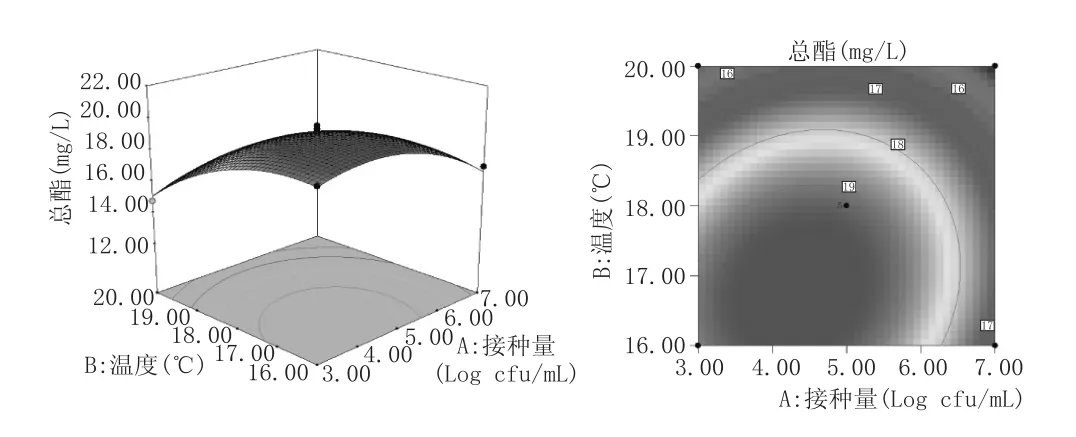
图5接种量与温度对总酯含量影响的等高线和响应面图
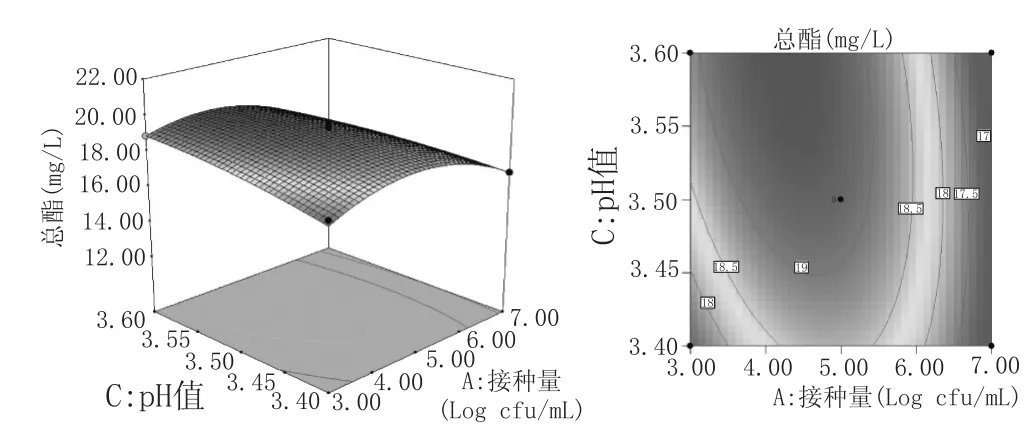
图6接种量和pH值对总酯含量影响的等高线和响应面图
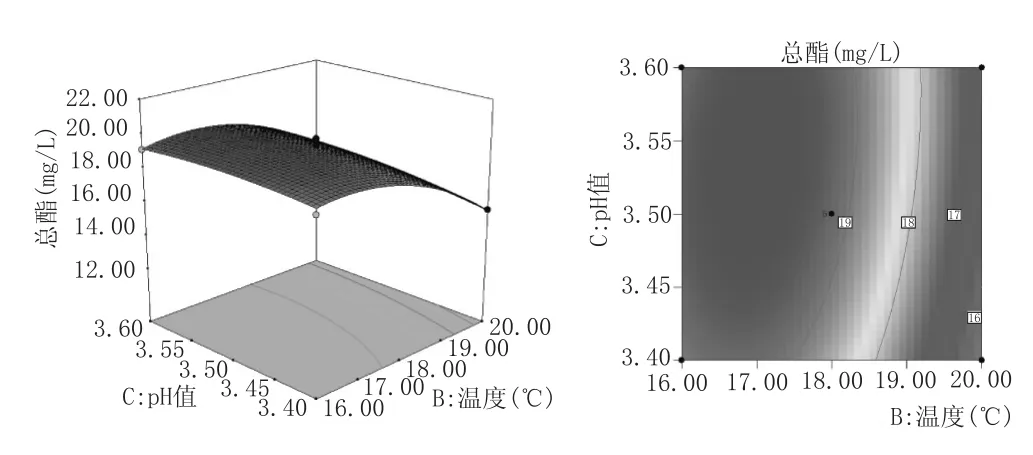
图7温度与pH值对总酯含量影响的等高线和响应面图
2.3验证性实验
图5—图7反映了响应面图在考察因素范围内存在极值,通过Design-Expert8.0.6软件进行验证优化,得到野木瓜果酒总酯含量最高时的工艺参数:接种量为4.36 Log cfu/mL、温度为17.63℃、pH3.54,预测的总酯含量达到19.64 mg/L。结合实际情况,验证实验设置时间为间隔3d接种、异常汉逊酵母接种量为105cfu/mL、温度为18℃、SO2添加量为100 mg/L、pH3.55,总酯含量达到19.350 mg/L±0.712 mg/L,与响应面的预测值接近,说明该模型可用于预测混菌发酵野木瓜果酒总酯含量。经优化后的混菌发酵野木瓜果酒比未优化前单菌发酵的总酯含量(7.165 mg/L±0.325 mg/L)高出1.7倍之多,证明通过混菌发酵提高野木瓜果酒总酯含量,所以改善野木瓜果酒香气品质的措施可行。单菌发酵野木瓜果酒与混菌发酵优化工艺后野木瓜果酒各酯类化合物含量见表4。从表4中也可看出各种酯类化合物的含量都有了显著的提高。
3 结论
本研究通过单因素实验与响应面实验,建立了混菌发酵野木瓜果酒总酯含量的多元二次回归方程:Y= 19.18-0.73A-1.52B+0.30C+0.46AB-0.44AC+0.24BC-1.50A2-1.34B2-0.26C2,并确定了混菌发酵的最优工艺参数:间隔3d接种(异常汉逊酵母接种3d之后接种sy酿酒酵母)、异常汉逊酵母接种量为1.88×105cfu/mL、sy酿酒酵母接种量为1.63×107cfu/mL,温度为18℃,SO2添加量为100 mg/L,pH3.55,在此工艺条件下,发酵酿出的野木瓜果酒总酯含量达到19.350 mg/L±0.712 mg/L。与未优化前单菌发酵野木瓜果酒相比总酯含量提高了1.7倍。证实了通过混菌发酵改善野木瓜果酒香气措施的可行性,为高品质野木瓜果酒的生产提供了一定的理论依据。
参考文献:
[1]吴国卿,王文平,陈燕.野木瓜的资源状况与食用加工研究综述[J].贵州农业科学,2010(2):163-165.
[2]Ciani M,Comitini F,Mannazzu I,et al.Controlled mixed culture fermentation: a new perspective on the use of non-Saccharomyces yeasts in winemaking[J].FEMS Yeast Research,2010,10(2):123-133.
[3]Rojas V,Gil J V,Piñaga F,et al.Studies on acetate ester production by non-Saccharomyces wine yeasts[J].International Journal of Food Microbiology,2001,70(3):283-289.
[4]Clemente-Jimenez J M,Mingorance-Cazorla L,Martínez-Rodríguez S,et al.Influence of sequential yeast mixtures on wine fermentation[J].International Journal of Food Microbiology,2005,98(3):301-308.
[5]汪立平,徐岩.混菌发酵对苹果酒香气物质及发酵效率的影响[J].食品科学,2006,26(10):151-155.
[6]Comitini F,Gobbi M,Domizio P,et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J].Food Microbiology,2011,28(5):873-882.
[7]韦广鑫,龙立利,杨笑天,等.野木瓜果酒发酵工艺优化研究[J].酿酒科技,2015(5):83-85.
[8]汪正范.色谱定性与定量[M].北京:化学工业出版社,2000.
[9]Sumby K M,Grbin P R,Jiranek V.Microbial modulation of aromatic esters in wine: current knowledge and future prospects [J].Food Chemistry,2010,121(1):1-16.
[10]刘树文,王玉霞,陶怀泉,等.SO2和酒精处理对葡萄酒自然发酵酵母菌群的影响[J].西北农林科技大学学报:自然科学版,2008,36(5):196-200.
[11]Molina AM,Swiegers J H,Varela C,et al.Influence of wine fermentation temperature on the synthesis of yeast-derived volatile aroma compounds[J].Applied Microbiology and Biotechnology,2007,77(3):681-682.
[12]程雷,李梓,王军.葡萄自然发酵过程中酵母菌的研究[J].中国食品学报,2010(2):131-137.
[13]Fleet G H.Yeast interactions and wine flavor[J].International Journal of Food Microbiology,2003,86(1-2):11-22.
[14]夏季,郑炯,陈光静,等.响应面法优化超声辅助提取野木瓜多酚工艺[J].食品工业科技,2014,35(21):253-258.
[15]高向阳,宋莲军,高晓平,等.现代食品分析[M].北京:科学出版社,2012.
[16]Rodríguez-Bencomo J J,Cabrera-Valido H M,Pérez-Trujillo J P,et al.Bound aroma compounds of Gual and Listán blanco grape varieties and their influence in the elaborated wines[J].Food Chemistry,2011,127(3): 1153:1162.
Optimization of Mixed Bacteria Fermentation of Stauntonia chinensis Wine by Response Surface Method
WEI Guangxin1,ZHANG Dan1,ZENG Fankun1,ZHOU Yongwen2and ZHANG Weiguang1
(1.College of Food Science,Southwest University,Chongqing 400715;2.Chongqing Jinlifang Winery Co.Ltd.,Chongqing 401420,China)
Abstract:In this study,mixed bacteria fermentation of Stauntonia chinensis wine was optimized by single factor test and response surface method.The effects of mixed bacteria mode,inoculating quantity,addition level of SO2,fermenting temperature and pH value on total esters content were explored.The results showed that,under condition of inoculation at a three-day interval(Sy Saccharomyces cerevisiae inoculated 3d after H.anomala inoculation and their inoculating quantity were 107cfu/mL and 105cfu/mL respectively),fermenting temperature at 18℃,pH3.55,and the addition level of SO2=100 mg/L,total esters content in the produced Stauntonia chinensis wine reached up to 19.350 mg/L± 0.712 mg/L,1.7 times higher than that in Stauntonia chinensis wine fermented by pure yeast strain.
Key words:Stauntonia chinensis wine;mixed bacteria fermentation;total esters;response surface method;fruit wine
中图分类号:TS262.7;TS261.4;TS261.1
文献标识码:A
文章编号:1001-9286(2016)06-0097-05
DOI:10.13746/j.njkj.2016041
基金项目:重庆市科委应用开发项目“皱皮木瓜发酵酒品质提升与产业化”,立项编号:cstc2013yykfB0174。
收稿日期:2016-02-03
作者简介:韦广鑫(1990-),男,硕士研究生,研究方向:食品生物技术,E-mail:415516496@qq.com。

