噁二唑-2-氧化物合成及抗日本血吸虫尾蚴活性* 1
钱益平,郭同,陈祥钊,唐 勇,申昌德,许祖波,李 勋,范小林
(赣南师范学院 化学化工学院,江西 赣州 341000)
噁二唑-2-氧化物合成及抗日本血吸虫尾蚴活性* 1
钱益平†,郭同,陈祥钊,唐勇,申昌德,许祖波,李勋,范小林
(赣南师范学院 化学化工学院,江西 赣州341000)
摘要:以苯丙烯醇为原料合成噁二唑-2-氧化物,并对其进行结构表征确认,评价其抗日本血吸虫尾蚴活性.结果表明,噁二唑-2-氧化物具有不同程度的杀灭尾蚴活性,其中4-苯基-1,2,5-噁二唑-3-醛基-2-氧化物杀灭尾蚴活性最好.
关键词:噁二唑-2-氧化物;日本血吸虫;尾蚴;活性
1引言
血吸虫病是一种流行于热带和亚热带地区、严重危害人民身体健康、影响经济社会发展的重大传染病.血吸虫的种类很多,人体常见的血吸虫主要三种:日本血吸虫、曼氏血吸虫,埃及血吸虫,在我国流行的主要是日本血吸虫[1].血吸虫的生活史主要包括7个主要阶段:成虫、卵、毛蚴、母胞蚴、子胞蚴、尾蚴和童虫.尾蚴是感染人畜的唯一阶段,也是血吸虫生命周期中最脆弱阶段[1-2].因此,尾蚴的防治是控制血吸虫病传播的重要环节,杀灭了尾蚴,就消除了感染威胁.化学药物是目前杀灭尾蚴最有效手段之一,主要有吡喹酮、氯硝柳胺、硝苯柳胺和五氯酚钠等[2].
一氧化氮(NO)是一种活性氧自由基分子,具有多种生物学效用的功能分子,特别是,NO与一般的生物效应分子不同,NO无需与特异性蛋白受体结合,可借助其良好的脂溶性快速直接进入病原体体内发挥杀灭作用[3-4].近年来,发现NO对血吸虫成虫、童虫和尾蚴具有抑制和杀灭作用[5].在自然环境状态下,不存在足以导致尾蚴死亡的NO水平,但在尾蚴以外的其它寄生阶段(如中间宿主钉螺体内、终宿主哺乳动物体内)均存在能够生成NO的合成酶,能够释放NO起到防治尾蚴感染,甚至杀灭尾蚴[5].
NO是一种气体分子,难以直接作为药物使用.[6]NO供体是外源性补充NO的主要方式之一,其中噁二唑-2-氧化物是一类独特的NO供体,在较低浓度时具有很好的NO释放能力,已经被广泛应用于NO药物研究中.[6]目前尚无噁二唑-2-氧化物杀灭尾蚴活性的相关报道.因此,本文以苯丙烯醇为原料合成了一系列的噁二唑-2-氧化合物,评价了其杀灭尾蚴活性.
2实验部分
2.1仪器与试剂
主要仪器 Bruker Advance 400型核磁共振仪(瑞士Bruker公司);SMZ 180系列体式显微镜(江西省凤凰光学集团有限公司);DHJF-4005低温搅拌反应器(郑州长城科工贸有限公司).
主要试剂 肉桂醇、盐酸羟胺和二氧化锰购于阿拉丁试剂公司,亚硝酸钠购于天津科密欧试剂公司,其它溶剂均为分析纯.
日本血吸虫阳性钉螺购自江苏省血吸虫病防治研究所.
2.2目标化合物的合成与表征
目标化合物的合成路线见图1.以肉桂醇为起始原料,在亚硝酸钠的作用下合成化合物2,再二氧化锰氧化生成化合物3,进一步与羟胺加成生成化合物4,然后与二氯亚砜反应合成化合物5,所有的中间产物及最终产物结构都经过NMR和MS等表征确认.

图1 化合物合成路线(a)NaNO2, CH3COOH, rt; (b) MnO2, DCM, rt; (c) NH2OH·HCl, CH3COONa, EtOH, 80 ℃; (d) SOCl2, DMF, 0 ℃.
化合物2的合成[7]:称取肉桂醇6.7 g(50 mmol)于100 mL圆底烧瓶中,加入20 mL冰醋酸溶解,向反应液中缓慢滴加NaNO2(100 mmol)溶液,室温搅拌24 h,待反应完成后,用冰水淬灭,反应混合液用乙酸乙酯萃取(20 mL×3),合并有机层,依次用饱和NaHCO3溶液、蒸馏水和饱和食盐水洗,最后往有机层加入无水硫酸钠干燥,减压浓缩,残留物采用柱层析色谱分离,洗脱剂为乙酸乙酯和石油醚(V/V=1∶3),得淡黄色固体3.36 g,产率为35%.1H NMR (400MHz, CDCl3), δ (ppm): 7.80-7.82 (m, 2H), 7.53-7.55 (m, 3H), 4.72 (s, 2H), 3.20 (s, 1H).13C NMR (400 MHz, CDCl3), δ (ppm): 13C NMR (100 MHz, CDCl3), δ (ppm): 156.86, 131.38, 129.41, 127.79, 126.14, 114.90, 53.32.MS (m/z): 192 [M+H]+.
化合物3的合成[7]:称取1.5 g (7.8 mmol) 化合物2于100 mL圆底烧瓶中,加入30 mL二氯甲烷溶解,加入已活化的二氧化锰10.17 g(117 mmol),室温搅拌反应9 h,然后过滤除去二氧化锰固体,并用二氯甲烷润洗固体残留物,滤液减压浓缩,残留物采用柱层析色谱分离,洗脱剂为乙酸乙酯和石油醚(V/V=1∶5),得淡黄色固体0.445 g,产率为30%.1H NMR (400 MHz, CDCl3), δ (ppm): 9.98 (s, 1H), 7.90-7.92 (m, 2H), 7.54-7.61 (m, 3H).13C NMR (100 MHz, CDCl3), δ (ppm): 178.22, 154.98, 131.94, 128.99, 128.72, 124.90, 113.69. MS (m/z): 190[M+H]+.
化合物4的合成[7]:称取0.2 g (1.1 mmol) 化合物3于100 mL圆底烧瓶中,加入20 mL乙醇溶解,用30 mL乙醇溶解盐酸羟胺0.115 g (1.65 mmol)和醋酸钠0.09 g (1.1 mmol)并缓慢滴入其中回流6 h,用水淬灭,反应混合液用乙酸乙酯(20 mL×3)萃取,合并有机层并用饱和食盐水洗涤有机层,最后往有机层加入无水硫酸钠干燥,减压浓缩,残留物采用柱层析色谱分离,洗脱剂为乙酸乙酯和石油醚(V/V=1∶3),得淡黄色固体0.09 g,产率为40%.1H NMR (400 MHz, DMSO), δ (ppm): 12.45 (s, 1H), 7.91 (s, 1H), 7.76-7.74 (dd, 2H), 7.62-7.53 (m, 3H);13C NMR (100 MHz, CDCl3), δ (ppm): 156.40, 149.96, 135.45, 131.58, 129.29, 129.14, 111.80. MS (m/z): 205[M+H]+.
化合物5的合成[7]:称取0.08 g (0.39 mmol) 化合物4于圆底烧瓶中,加入5 mL DMF溶解,置于0 ℃下冰浴反应,缓慢滴加氯化亚砜0.12Ml (4 mmol)至反应瓶中并反应过夜,反应完毕后加入冰水淬灭,接着用二氯甲烷(20 mL×3)萃取,合并有机相,分别用饱和的碳酸氢钠,水和饱和食盐水洗涤,分出有机层,并往有机层中加入无水硫酸钠干燥,减压浓缩,残留物采用柱层析色谱分离,洗脱剂为乙酸乙酯和石油醚(v/v=1∶3),得到淡黄色固体0.0387 g,产率为54%.1H NMR (400MHz, CDCl3), δ (ppm): 7.74-7.76 (m, 2H), 7.56-7.61 (m, 3H).13C NMR (100 MHz, CDCl3), δ (ppm): 155.63 (s), 133.07, 130.20, 127.48, 124.42, 107.91. MS (m/z): 187[M+H]+.
2.3灭尾蚴活性评价
分别称取1 mmol化合物2、3、4和5,加入到1 mL DMSO中进行溶解,配制成1 mM的母液.
实验当日取阳性钉螺于锥形瓶中,加入去氯水并加以光照,室温的温度控制在25 ℃左右,保持逸蚴时间2 h.分别往24孔培养板中加入2 mL去氯水,同时分别移取1 mmol药液4 μL、8 μL、16 μL和32 μL于培养板中,稀释后的浓度分别为2 μM、4 μM、8 μM和16 μM.分别向培养板中加入血吸虫尾蚴,并设含有32 μL DMSO(最大溶解体积)的去氯水空白对照.在显微镜下观察尾蚴的存活数量.显微镜下观察凡是断尾、表皮肿胀等情况时视为死亡.
3结果与讨论
尾蚴作为血吸虫生命周期中一个重要阶段,容易受到外界刺激,对自由基也更加敏感[4-5].NO是一种自由基,具有较好的抗血吸虫尾蚴活性,但难以直接作为药物使用杀灭尾蚴.噁二唑-2-氧化物是一种已知的外源性NO供体,已经被广泛的用于外源性NO药物研究中[6].本研究合成了4个噁二唑-2-氧化物,评价了其杀尾蚴活性.实验结果发现,噁二唑-2-氧化物2-5均具有一定的杀灭尾蚴活性(表1).在同一浓度下(4μM),化合物3作用1h后杀灭尾蚴活性为5.9%,2h后导致尾蚴死亡率可明显提高到58.8%,相比1h活性提高了近10倍,4h后可完全杀灭尾蚴(100%)(表1和图2).表明,化合物3随作用时间的延长,其杀灭活性显著提高.这种活性-时间效应现象,在化合物2、4和5杀尾蚴活性中也有不同程度的体现.由此说明,噁二唑-2-氧化物对尾蚴致死率随作用时间的递增呈现递增趋势,具有一定的时间效应.

表1 噁二唑-2-氧化物灭日本血吸虫尾蚴活性
注:显微镜下观察药物灭蚴活性.凡是断尾、表皮肿胀以及解剖针刺激无反应视为死亡.
进一步分析发现,化合物灭尾蚴活性随浓度的增加均不同程度上升,但相对提高的不是很明显.作用浓度为2 μM时,化合物2、3、4和5作用尾蚴4 h后,尾蚴死亡率分别达到12%、100%、23.1%和25%(图3),进一步提高作用浓度到8 μM时,尾蚴死亡率分别达到10%、100%、33.3%和41.2%(图3),并没有显著的提高.实际上,化合物浓度的提高,实质是NO浓度的提高.该实验结果提示,外源性噁二唑-2-氧化物对尾蚴具有杀灭作用,但杀灭活性与使用剂量无明显的相关性,即可能NO浓度不是影响活性的主要因素.这与外源性NO供体对成虫的杀灭效果不一致[8].
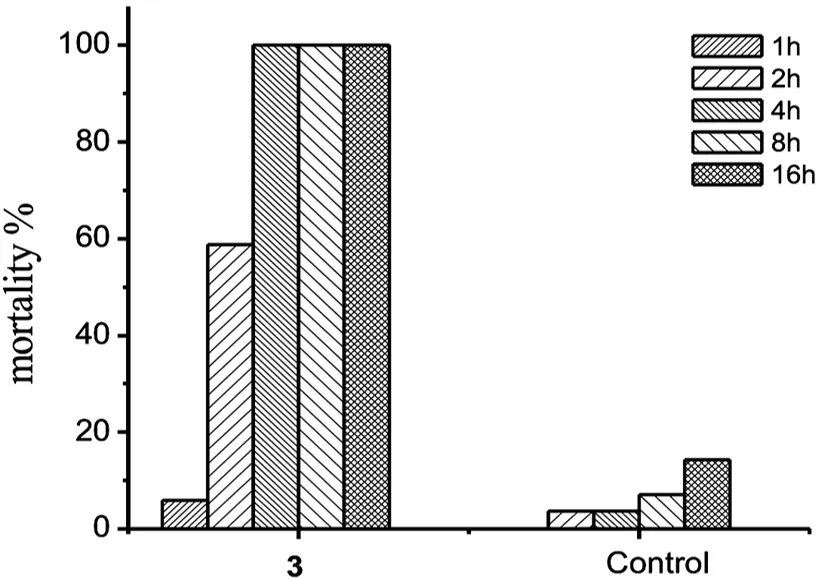
图2 化合物3在4 μM时灭尾蚴效果
此外,从化合物杀灭尾蚴整体效果分析可知,在作用剂量4 μM下,作用时间2 h时,化合物2、4和5作用尾蚴的致死率均未超过30%,但化合物3杀灭尾蚴活性可达到58.8%,进一步延长作用时间,化合物2、4和5的致死率虽有所提高,但仍均未超过50%,明显低于化合物3,而化合物3 在作用4 h可完全杀灭尾蚴(图4).同样,在其它作用浓度和时间下,3对尾蚴的杀灭效果同样明显好于化合物2、4和5(表1).进一步分析可知,噁二唑-2-氧化物灭尾蚴效果为3>5>4>2.
NO作为杀灭病原体的一种小分子,具体的作用机理尚未完全阐明.一般认为是NO的细胞毒性,如NO能与病原体中某些物质反应生成更强的氧化物质,如生成超氧阴离子自由基、过氧亚硝基负离子等,导致体内过氧化级联反应大量发生,从而造成病原体损伤[9];此外NO还可引起病原体脂质、蛋白质和核酸等亚硝基或硝化,从而使病原体体膜破坏、防御体系失活和DNA断裂等,进一步引起病原体损伤和死亡[10].化合物3灭尾蚴的药效最强,这可能是由于C-3位醛基高的亲电性,容易与维持尾蚴体表糖腭上的蛋白质等物质反应,快速破坏了尾蚴体表糖萼结构,导致其不能适应外界环境,从而导致其快速死亡,具体的原因正在进一步研究中.
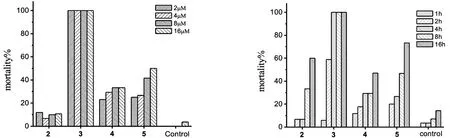
图3 化合物2-5在不同浓度下4 h灭尾蚴效果 图4化合物2-5(4 μM)在不同时间下灭尾蚴效果
4结论
本文合成了4种噁二唑-2-氧化物,并进行了核磁、质谱表征确认为目标结构,评价了其灭日本血吸虫尾蚴活性.实验结果表明,外源性NO供体噁二唑-2-氧化物对日本血吸虫尾蚴具有较明显的杀灭效果,其中4-苯基-1,2,5-噁二唑-3-醛基-2-氧化物(3)灭尾蚴活性最好.
参考文献:
[1]毛守白.血吸虫生物学与血吸虫病的防治[M].北京:人民卫生出版社,1990:121.
[2]郭维,郑绿茵,高艳春,等.杀灭血吸虫尾蚴药物的研究进展[J].中国人兽共患病学报,2008,24:672-674.
[3]何宏轩,张西臣,张晓龙.一氧化氮和寄生虫感染[J].中国兽医寄生虫病,2001,9:41-44.
[4]Jortzik, E., Wang, L., Becker, K. Thiol-Based Posttranslational Modifications in Parasites[J].Antioxid. Redox Signal, 2012,17:657-673.
[5]Perbandt, M., Ndjonka, D., Liebau, E. Protective Mechanisms of Helminths Against Reactive Oxygen Species are Highly Promising Drug Targets[J].Curr. Med. Chem, 2014,21,1794-1808.
[6]Wang, P., Xian, M., Tang, X. P., et al. Nitric oxide donors: chemical activities and biological applications[J].Chem. Rev. 2002,102:1091-1134.
[7]Sayed, A. A., Simeonov, A., Thomas, C. J., et al. Identification of oxadiazoles as new drug leads for the control of schistosomiasis[J].Nature Med, 2008,14,407-412.
[8]Rai, G., Sayed, A. A., Thomas, C. J. et al. Structure Mechanism Insights and the Role of Nitric Oxide Donation Guide the Development of Oxadiazole-2-Oxides as Therapeutic Agents against Schistosomiasis[J].J. Med. Chem. 2009,52:6474-6483.
[9]Nitric oxide-releasing indomethacin enhances susceptibility to Trypanosoma cruzi infection acting in the cell invasion and oxidative stress associated with anemia.Chem[J].Biol. Interact, 2015,227:104-111.
[10]Piedrafita, D., Spithill T.W.,Dalton J.P.,et al. Juvenile Fasciola hepatica are resistant to killing in vitro by free radicals compared with larvae of schistosoma mansoni[J].Parasite Immunol, 2000,22:287-295.
* 收稿日期:2016-04-05
DOI:10.13698/j.cnki.cn36-1037/c.2016.03.009
基金项目:国家自然科学基金项目(21302022)
作者简介:郭同(1990-),男,赣南师范学院化学化工学院2013级硕士研究生,研究方向:血吸虫防治药物. † 通讯作者:钱益平(1984-),男,赣南师范学院化学化工学院讲师、博士,研究方向:有机药物化学.
中图分类号:O626.27
文献标志码:A
文章编号:1004-8332(2016)03-0033-04
Synthesis of Oxadiazole-2-Dxide Analogues as Anti-SchistosomaJaponicumCercaria Agents
QIAN Yiping, GUO Tong, CHEN Xiangzhao,TANG Yong, SHEN Changde, XU Zhubo, LI Xun, FAN Xiaolin
(SchoolofChemistryandChemicalEngineering,GannanNormalUniversity,Ganzhou341000,China)
Abstract:A series of oxadiazoles-2-oxide analogues were synthesized by benzene propylene glycol as raw material, and their structures were confirmed by1H NMR and EI-MS, and their anti-schistosoma japonicum cercaria activities were evaluated. The results showed that the drugs had obvious the activity against schistosoma japonicum cercaria. Among them, the compound 4-phenyl-1,2,5-oxadiazoles-3-aldehyde-2-oxide had a best effect on anti-schistosoma japonicum cercaria.
Key words:oxadiazoles-2-oxides; schistosoma japonicum; cercaria; activity
网络出版地址:http://www.cnki.net/kcms/detail/36.1037.C.20160510.1213.028.html

