瞬时受体电位通道蛋白的跨膜片段分析
苏秋香,张丽艳,汲坤,张改改,张利华
(沈阳医学院基础医学院1.机能实验学教研室;2.病理生理教研室,沈阳 110034)
瞬时受体电位通道蛋白的跨膜片段分析
苏秋香1,张丽艳2,汲坤2,张改改2,张利华2
(沈阳医学院基础医学院1.机能实验学教研室;2.病理生理教研室,沈阳 110034)
摘要目的分析瞬时受体电位(TRP)通道的膜拓扑结构。方法采用糖基化的方法,对传统TRP通道TRPC5的各疏水片段进行膜整合分析。结果TRPC5通道中,S4~S8片段按顺序分别以Ncyt/Cexo和Nexo/Ccyt的方式插入到膜中,C末端位于细胞内。而S1~S3片段可能存在2种膜整合方式:一种是S1和S3整合到膜上,S2位于细胞外;另一种是混合模式,S1和S3分别位于细胞内,其N末端均位于细胞内。结论TRPC5通道的S4~S8为跨膜片段,S1~S3片段需进一步实验验证。
关键词瞬时受体电位通道;膜拓扑结构;跨膜片段分析
网络出版地址
瞬时受体电位(transient receptor potential,TRP)通道是一类非选择性阳离子通道,位于细胞膜上,最早发现于果蝇的视觉系统[1]。在哺乳动物中已发现28种TRP通道亚型,分属于7个亚家族,包括TRPC、TRPV、TRPM、TRPA、TRPP、TRPML和TRPN,每个亚家族又包含若干通道[2]。TRP通道蛋白分布广泛,其调节机制各异且功能多样,参与到多种生理过程中[3]。哺乳动物TRPC通道又被分为TRPC1、TRPC2、TRPC4/5、TRPC3/6/7四个亚型[4]。由于TRP通道的亚型较多,功能复杂,直至最近才将TRP结构与功能的关系基本阐明[5]。所有亚家族结构上均含6个跨膜拓扑结构,其氨基酸(N)末端和羧基(C)末端均位于胞内,由第5及第6跨膜片段共同构成非选择性阳离子孔道。TRPC通道N末端由3~4个锚蛋白重复序列、1个卷曲螺旋和1个小窝蛋白结合区组成;C末端包含TRP标志基序(EWKFAR)。虽然TRP通道的基本结构已经提出,但具体的跨膜疏水片段以及拓扑结构形成机制并未阐明。VANNIER等[6]于1998年报道,TRPC3的第1个疏水片段位于细胞内,而其余的7个疏水片段按顺序整合到膜上,成为跨膜片段。而DOHKE等[7]于2004年报道,TRPC1的第3个疏水片段位于细胞内,而其余的7个疏水片段按顺序整合到膜上,成为跨膜片段。离子通道属于膜蛋白,其结构的阐明对于了解离子通道的功能非常有帮助。拓扑结构分析常被用来研究膜蛋白的结构,研究膜蛋白的各个跨膜片断在线粒体蛋白合成的同时是如何整合到内质网膜上的,并最终形成什么样的跨膜结构[8]。目前,最常用的方法是糖基化和蛋白酶K水解。本研究采用体外蛋白转录、翻译和转运系统以及糖基化方法分析了TRP家族中比较有代表性的TRPC5通道的膜拓扑结构,为阐明TRP通道蛋白的结构与功能提供数据。
1 材料与方法
1.1质粒构建
1.1.1G⁃loop导入质粒制作:利用PCR方法扩出编码TRPC5中含疏水片段S1~S8的DNA片段(V292⁃D636),同时在DNA片段的5′端导入NcoⅠ酶切位点,3′端导入XhoⅠ酶切位点,利用NcoⅠ和XhoⅠ酶切位点把该DNA片段亚克隆到pCITE⁃2a载体(美国Novagen公司)中。然后利用点变异方法,分别在每个疏水片段之间的连接中根据有效糖基化的12⁃14规则导入EcoⅠ酶切位点,利用酶切的方法,把来自人带3蛋白中含有一个糖基化受体位点的G⁃loop分别插入到各连接中的EcoⅠ酶切位点上。
1.1.2截短蛋白质粒制作:我们利用PCR方法分别扩出编码TRPC5中疏水片段S1、S1~S2、S1~S3、S1~S4、S1~S5、S1~S6、S1~S7、S1~S8的DNA片段,然后利用酶切的方法,把这些DNA片段融合到携带有PLg报告基因的pCITE⁃2a载体中,PLg报告基因中含有糖基化位点。
1.2体外蛋白转录、翻译及转运实验
利用狗胰腺粗面内质网小泡和兔网织红细胞抽出液模拟体内蛋白转录、翻译及转运实验。首先进行mRNA合成,所有质粒经过ScaⅠ酶切线性化,在标准条件下使用T7 RNA多聚酶进行体外转录,37℃,1 h。然后把获得的mRNA在含有或不含有狗胰腺粗面内质网小泡的兔网织红细胞抽出液系统中进行体外蛋白合成和转运,37℃,1 h。对在含有粗面内质网条件下合成的蛋白产物进一步进行蛋白水解试验,蛋白水解酶采用蛋白酶K。我们用[35S]蛋氨酸标记蛋白,用SDS⁃PAGE电泳分离蛋白产物,最后进行同位素自显影。
1.3膜拓扑结构分析
在未添加粗面内质网小泡的条件下,膜蛋白经体外合成后出现一条蛋白带,这是未被糖基化的蛋白带。因为糖基化反应仅发生在内质网膜腔内,而且一个糖基化受体位点由于接受一个高甘露糖基寡聚糖,分子量会增加2 500。因此,在粗面内质网存在下,如果出现1条分子量比未被糖基化的蛋白带多出约3 000的蛋白带,就说明该蛋白带被糖基化了,同时也说明该蛋白含有糖基化受体位点的多肽区域位于内质网腔内(细胞外)。在粗面内质网存在下,获得的蛋白经过蛋白酶K处理后,位于内质网腔外(细胞内)的多肽会被蛋白酶K消化降解,蛋白带缩短或消失。根据导入的糖基化受体位点是否被糖基化以及合成的蛋白是否被蛋白酶K消化降解,可以推测出蛋白的多肽链是位于内质网腔内(细胞外)还是位于内质网腔外(细胞内),从而推测出膜蛋白各疏水区域是否是跨膜片段,即推测出膜蛋白的拓扑结构。
2 结果
2.1TRPC5跨膜疏水片段预测
利用Kyte⁃Doolittle方法对TRPC5氨基酸序列进行疏水性分析(图1)。S1(328~350)、S2(359~384)、S3(402~418)、S4(437~456)、S5(476~497)、S6(508~532)、S7(567~587)、S8(598~624)这8个区域疏水性较高,被认为可能成为跨膜片段。
2.2使用N和C末端切除蛋白进行TRPC5各片段的膜整合分析
N末端(氨基酸末端)常常会影响蛋白的体外表达量,所以在膜蛋白的拓扑结构分析中常常使用N 和C末端切除蛋白进行体外蛋白的表达及转运实验。如图2A,先构建N和C末端切除的TRPC5质粒TRPC5(V292⁃D636),然后在每2个可能的跨膜疏水片段(S1~S8)的中间连接(loop)中分别导入来自于人带3蛋白的含有一个糖基化位点的G⁃loop,质粒构建完成后,体外合成mRNA,在粗面内质网和蛋白酶K分别存在的条件下,进行蛋白合成和转运,最后进行SDS⁃PAGE电泳实验。
SDS⁃PAGE结果(图2B)显示,在未添加粗面内质网小泡的条件下,TRPC5(V292⁃D636)经体外合成后,出现1条分子量约在55 000的蛋白带,这是未被糖基化的蛋白带。在粗面内质网存在下,L358 (S1⁃S2 loop)、L393(S2⁃S3 loop)、E467(S4⁃S5 loop)和P550(S6⁃S7 loop)出现一条明显的糖基化蛋白带,说明S1⁃S2连接、S2⁃S3连接、S4⁃S5连接和S6⁃S7连接位于内质网腔内(细胞外),人工导入的G⁃loop上的的糖基化受体位点被糖基化;其糖基化效率分别为30%、66%、20%和39%(图2C)。在粗面内质网存在下获得的蛋白经过蛋白酶K处理后,位于内质网腔外(细胞内)的肽链被蛋白酶K消化降解,蛋白带消失(图2B)。
2.3使用截短蛋白进行TRPC5各片段的膜整合分析
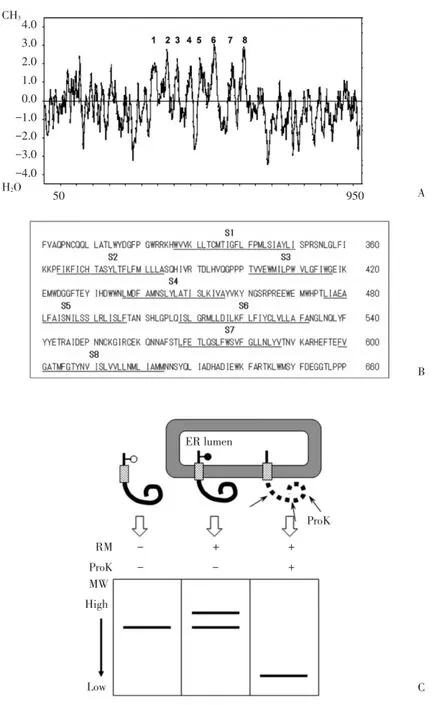
图1 TRPC5跨膜片段预测和膜拓扑结构分析方法图示Fig.1 Prediction of membrane spanning segments in TRPC5 and cartoons for topological analysis
本研究采用另一种策略,使用截短蛋白对TRPC5各片段的膜整合又进行了分析。在含有不同疏水片段的构建体的C末端融合一个报告基因PLg,该报告基因含有一个糖基化位点(图3A)。如果该报告基因在翻译转运时被糖基化,说明截短蛋白的C末端位于内质网腔内(细胞外)。SDS⁃PAGE结果(图3B)显示,S1⁃PLg、S1⁃S2⁃PLg、S1⁃S4⁃PLg和S1⁃S6⁃PLg经体外合成后,在粗面内质网存在下分别出现了1条糖基化蛋白带,且经蛋白酶K处理后,仍然有蛋白带残留,说明截短蛋白的C末端,即S1⁃S2连接、S2⁃S3连接、S4⁃S5连接和S6⁃S7连接,是位于内质网腔内(细胞外)的,其之前的最后一个疏水片段是以Ncyt/Cexo的形式整合到膜上的。每个截短蛋白的糖基化效率(图3C)S1⁃PLg为37%,S1⁃S2⁃PLg 为51%,S1⁃S4⁃PLg为17%,S1⁃S6⁃PLg为34%。
2.4TRPC5通道蛋白膜整合分析
根据图2和图3的数据结果,推测TRPC5通道蛋白的膜整合可能采取3种基本模式(图4)。模式Ⅰ:N末端位于细胞内,S1跨膜,而S2位于细胞外(内质网腔内),S3~S8疏水片段按顺序跨膜,C末端位于细胞内;模式Ⅱ:N末端和S1位于细胞内,S2~S8疏水片段按顺序跨膜,C末端位于细胞内(与VANNIER等[6]1998年报道的TRPC3模型相同);模式Ⅲ:N末端位于细胞内,S1和S2跨膜,而S3位于细胞内,S4~S8疏水片段按顺序跨膜,C末端位于细胞内(与DOHKE等[7]2004年报道的TRPC1模型相同)。根据2种实验方法均得出的S1⁃S2连接、S2⁃S3连接、S4⁃S5连接和S6⁃S7连接位于内质网腔内(细胞外)的结果,我们推测出TRPC5各疏水片段可能的膜整合方式。S4⁃S5连接和S6⁃S7连接位于细胞外,可以推测出TRPC5的S4~S8疏水片段按顺序整合到膜上,成为跨膜片段,C末端位于细胞内。而S1⁃S2连接、S2⁃S3连接位于细胞外,可以推测出S1~S3疏水片段的膜整合方式存在2种可能性。第1种是TRPC5通道蛋白采用模式Ⅰ的跨膜方式;第2种是TRPC5采用模式Ⅰ与模式Ⅱ的混合跨膜方式。
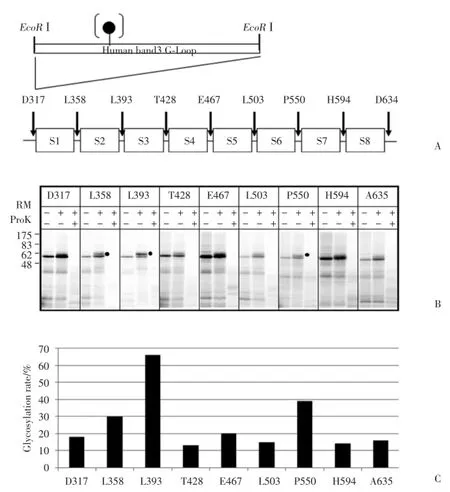
图2 使用N和C末端切除蛋白进行TRPC5各片段的膜整合分析Fig.2 Membrane integration assays of each transmembrane segment of TRPC5 using N⁃and C⁃terminus⁃deleted proteins
3 讨论
通常膜蛋白在内质网合成的同时,腔内会发生糖基化现象,而腔外发生蛋白水解的现象。根据这一特点,科学家们常采用各种无细胞系统进行蛋白的体外转录、翻译和转运,在粗面内质网存在的情况下,体外模拟膜蛋白合成和转运过程,观察目标蛋白的糖基化和蛋白水解的现象,从而分析膜蛋白的拓扑结构[9]。但膜蛋白的糖基化反应有效进行需要一定的条件,那就是膜蛋白的糖基化受体位点应该与膜上寡糖基转移酶的活性位点结合,而这个位点与内质网膜之间的距离遵守12⁃14规则。该规则认为,糖基化受体位点的N端距内质网膜表面至少有12个残基的距离,其C端至少有14个残基的距离,该受体位点才能被有效糖基化[10]。此规则已被用来分析膜蛋白的拓扑结构[11⁃12]。
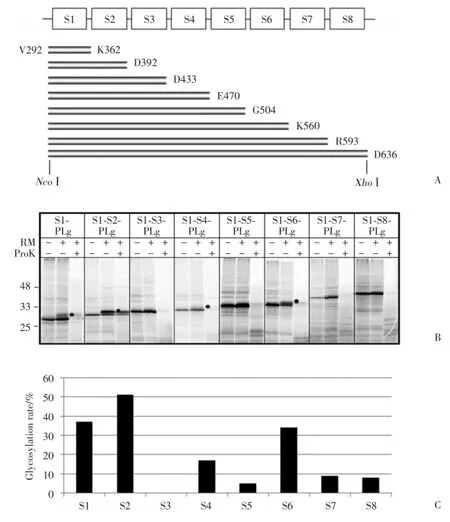
图3 使用截短蛋白进行TRPC5各片段的膜整合分析Fig.3 Membrane integration assays of each transmembrane segment of TRPC5 using truncated proteins
本研究根据人工导入或自然存在的糖基化位点发生糖基化需要满足该位点位于内质网膜腔内(即细胞外)的原理,设计2种实验策略来推测TRPC5的膜拓扑结构。一种是在TRPC5的可能跨膜片段之间的连接上导入含糖基化位点的G⁃loop,观察G⁃loop是否被糖基化,从而推出该连接是否位于细胞外;另一种是在含可能跨膜片段的TRPC5截短蛋白的C末端连接含糖基化位点的PLg报告基因,观察该报告基因是否被糖基化,推出TRPC5截短蛋白的C末端是否位于细胞外,从而推出C末端所在的连接是否位于细胞外。
2种实验策略的结果均显示,TRPC5通道蛋白的S1⁃S2连接、S2⁃S3连接、S4⁃S5连接和S6⁃S7连接位于细胞外。根据该结果,可推测出S4~S8疏水片段为跨膜片段,与之前VANNIER[6]和DOHKE[7]发表的TRPC3和TRPC1的S4~S8为跨膜片段的结果一致。而S1~S3部分与之前的数据不符。我们分析了TRPC3、TRPC1和本研究的TRPC5实验方法,发现结果不同可能由于实验方法的差异。VANNIER的TRPC3实验用的是全长的通道蛋白,而DOHKE的TRPC1实验和我们的TRPC5实验用的均是去除N端的通道蛋白。TRP通道家族的N端含有锚蛋白结构域,有助于通道形成四聚体结构,而这种四聚体结构的形成很可能抑制疏水片段S1的膜插入功能,这样S2~S8会按通常的模式插入膜中,形成TRPC3模式。而N端去除之后,疏水片段S1没有限制,但S1应该具有一定的跨膜能力,所以S1会引导一部分通道蛋白插入膜中,形成跨膜片段,最终使得TRPC5的膜拓扑结构可能形成TRPC3(Ⅱ型)模式和TRPC1(Ⅲ型)模式的混合体。我们需做进一步的实验来验证。首先,我们需要检验各个疏水片段的膜插入能力,然后,设计使用全长的通道蛋白来检测TRPC5的膜拓扑结构,并同时检测锚蛋白结构域在TRP通道蛋白跨膜过程中的作用。本研究的糖基化结果显示,TRPC5的S4~S8疏水片段按顺序整合到膜上,成为跨膜片段;而S1~S3疏水片段的膜整合方式存在2种可能性,一种是S2疏水片段位于细胞外,S1、S3为跨膜片段,另一种是同时存在2种方式,一部分TRPC5通道的S1位于细胞内、S2~S3为跨膜片段,而另一部分的TRPC5通道的S1~S2为跨膜片段、S3位于细胞内。我们需要进行进一步研究来明确TRPC5的S1~S3疏水片段的膜整合方式。
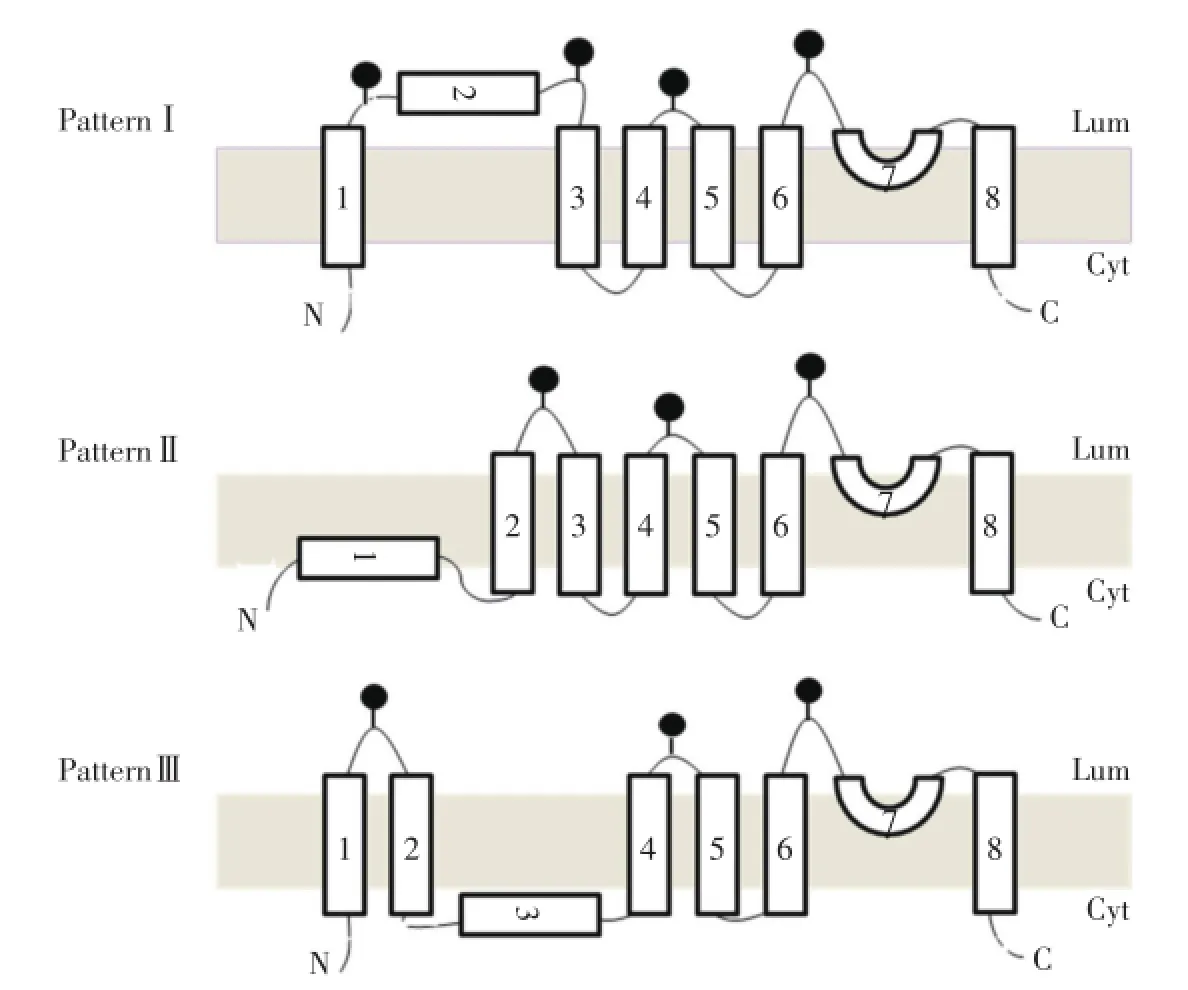
图4 TRPC5可能的膜拓扑结构模型Fig.4 Possible topological model of TRPC5
参考文献:
[1]COSENS DJ,MANNING A.Abnormal electroretinogram from a Dro⁃sophila mutant[J].Nature,1969,224(5216):285-287.
[2]CLAPHAM DE.TRP channels as cellular sensors[J].Natrue,2003,426(6966):517-524.
[3]NILIUS V,VOETS T.TRP channels:a TR(I)P through a world of multifunctional cation channels[J].Pflugers Arch,2005,451(1):1-10.
[4]FUSCO FR,MARTORANA A,GIAMPA C,et al.Cellular localiza⁃ tion of TRPC3 channel in rat brain:preferential distribution to oligo⁃dendrocytes[J].Neurosci Lett,2004,365(2):137-142.
[5]韩重阳,王晓良.瞬时受体电位通道研究进展[J].生理科学进展,2008,39(1):27-32.
[6]VANNIER B,ZHU X,BROWN D,et al.The membrane topology of human transient receptor potential 3 as inferred from glycosylation⁃scanning mutagenesis and epitope immunocytochemistry[J].J Biol Chem,1998,273(15):8675-8679.
[7]DOHKE Y,OH YS,AMBUDKAR IS,et al.Biogenesis and topology of the transient receptor potential Ca2+channel TRPC1[J].J Biol Chem,2004,279(13):12242-12248.
[8]VON HEIJNE G.Membrane⁃protein topology[J].Nat Rev Mol Cell Biol,2006,7(12):909-918.
[9]ZHANG L,SATO Y,HESSA T,et al.Contribution of hydrophobic and electrostatic interactions to the membrane integration of the Shaker K+channel voltage sensor domain[J].Proc Natl Acad Sci U S A,2007,104(20):8263-8268.
[10]NILSSON IM,VON HEIJNE G.Determination of the distance be⁃tween the oligosaccharyltransferase active site and the endoplas⁃mic reticulum membrane[J].J Biol Chem,1993,268(8):5798-5801.
[11]张丽艳,尚德志,汲坤,等.糖基化扫描方法分析KvAP通道电压感受器S3⁃S4在膜中所处位置[J].中国医科大学学报,2013,42 (1):10-13.
[12]尚德志,张丽艳,汲坤,等.Shaker通道电压感受器S3⁃S4片段末端氨基酸分析[J].中国医科大学学报,2012,41(12):1077-1079.
(编辑陈姜)
网络出版时间:
中图分类号R338.8
文献标志码A
文章编号0258-4646(2016)07-0610-06
DOI:10.12007/j.issn.0258⁃4646.2016.07.008
基金项目:辽宁省科技厅科学事业公益研究基金(2014001024);沈阳医学院科学研究基金(20141005)
作者简介:苏秋香(1962-),女,副教授,本科.
通信作者:张丽艳,E-mail:1580471013@qq.com
收稿日期:2016-04-06
Transmembrane Segment Analysis of Transient Receptor Potential Channel
SU Qiuxiang1,ZHANG Liyan2,JI Kun2,ZHANG Gaigai2,ZHANG Lihua2
(1.Department of Medical Functional Experimentation,College of Basic Medical Sciences,Shenyang Medical College,Shenyang 110034,China;2.Department of Pathophysiology,College of Basic Medical Sciences,Shenyang Medical College,Shenyang 110034)
AbstractObjectiveTo investigate the membrane topology of transient receptor potential(TRP)channel.MethodsGlycosylation method was used to investigate the membrane integrations of each hydrophobic segment of canonical TRP(TRPC5).ResultsIn TRPC5 channel,S4⁃S8 segments were integrated into membrane with Ncyt/Cexo and Nexo/Ccyt orientations sequentially,and C⁃terminus was intracellular.S1⁃S3 segments were integrated into membrane with two possible types.One was that S1 and S3 were integrated into membrane,whereas S2 was left out of the membrane on the cytosolic side;and the other was a mixed type that S1 and S3 were exposed to cytoplasm respectively.Both of them,the N⁃termi⁃nus was intracellular.ConclusionS4⁃S8 segments of TRPC5 are transmembrane segments.The integrations of S1⁃S3 segments into membrane need to be further investigated.
Keywordstransient receptor potential channel;membrane topology;transmembrane segment analysis

