急性痛风性关节炎患者血清IL-1β、IL-6、IL-18及TNF-α水平的研究
刘淑娟丁焕发* 徐晓辰王尚云兰立强韦涌涛( 青岛市第八人民医院内分泌科,山东 青岛 6600; 青岛市第八人民医院检验科,山东 青岛 6600)
急性痛风性关节炎患者血清IL-1β、IL-6、IL-18及TNF-α水平的研究
刘淑娟1丁焕发1* 徐晓辰1王尚云2兰立强1韦涌涛2
(1 青岛市第八人民医院内分泌科,山东 青岛 266100;2 青岛市第八人民医院检验科,山东 青岛 266100)
【摘要】目的 探讨急性痛风性关节炎(acute gouty arthritis,AGA)患者血清白细胞介素(interleukin,IL)-1β、IL-6、IL-18及肿瘤坏死因子(tumor necrosis factor,TNF)-α水平的变化及意义。方法 用ELISA法测定100例AGA患者(观察组,T)和100名健康查体者(对照组,C)血清IL-1β、IL-6、IL-18及TNF-α水平。观察组与对照组比较采用独立样本t检验,一般生理指标及血生化指标用独立样本t检验,计数资料采用χ2检验。计量资料用(�±s)表示。采用IBM SPSS 19.0软件包对所有数据进行统计学分析。结果 观察组与对照组相比,IL-1β、IL-6、IL-18及TNF-α水平均显著升高,差异有统计学意义(P<0.01)。结论 IL-1β、IL-6、IL-18及TNF-α水平在AGA发病时升高,提示它们参与了炎性反应过程,在炎症机制中发挥了重要作用。
【关键词】白细胞介素-1β;白细胞介素-6;白细胞介素-18;肿瘤坏死因子-α;痛风性关节炎
随着社会的发展,痛风的患病率逐年上升,急性痛风性关节炎(AGA)患病率随年龄的增长有逐渐增高的趋势,且常伴有多种代谢病、慢性病,发病高峰年龄为40岁左右,临床上以男性患者多见,女性约占5%[1],且多为绝经期后妇女。近年来研究发现单核/巨噬细胞系统在急性痛风性关节炎启动、进展及缓解中均发挥了关键作用,其中IL-1β是单钠尿酸盐(monosodium urate,MSU)晶体诱导炎症的关键因子,NLRP3炎性体通过促进IL-1β的生成在AGA发作中发挥不可替代的作用[2]。同时IL-6、IL-18及TNF-α等多种促炎性细胞因子参与了AGA的发病过程。当AGA发生时上述炎性因子水平升高。本研究即对此进行研究、探讨,以期发现IL-1β、IL-6、IL-18及TNF-α在AGA表达水平的变化及意义,指导AGA的早期防治及优化治疗方案。
1 对象与方法
1.1 研究对象。观察组(T):随机选取符合以下诊断标准和剔除标准的患者100例(男95例,女5例),年龄(47.25±10.99)岁,全部来自本院2014年8月至2016年2月的门诊患者。①急性痛风性关节炎诊断标准:应用美国风湿病协会(ACR)1997年制定的诊断标准。②入选和剔除标准:a.符合ACR诊断标准的急性原发性痛风性关节炎。d.排除心血管、肾脏、血液疾病、肿瘤疾病引起的继发性痛风。c.排除合并感染性疾病患者。d.排除自身免疫性疾病及全身系统疾病患者。e.年龄18~75岁。f.一般情况良好。g.未服用降尿酸药物治疗者。对照组(C):随机选取青岛本地居民健康查体者100例(男95例,女5例),年龄(46.15±11.80)岁,排除高尿酸血症患者。高尿酸血症的诊断标准:是指正常嘌呤饮食状态下,非同日两次空腹血清尿酸水平(37 ℃)男性>420 μmol/L,绝经前女性>360 μmol/L,绝经后女性的诊断标准同男性。
1.2 观测指标。①测定两组的一般生理指标:年龄(Age)、身高(BH)、体质量(BW)、收缩压/舒张压(SBP/DBP)、腰围(WC)、臀围(HC)。计算腰臀比(WHR)及体质量指数(BMI)。BMI=体质量(kg)/身高(m)2。②测定两组的空腹血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、尿酸(UA)、空腹血糖(FPG)、三酰甘油(TG)、总胆固醇(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、C-反应蛋白(CRP)、肌酐(Cr)、尿素氮(BUN)。测定两组全血白细胞总数(WBC)、中性粒细胞数(NEUT)、中性粒细胞百分比(NEUT%)。③测定两组空腹血清IL-1β、IL-6、IL-18及TNF-α水平。
1.3 主要检测方法:所有入选者由专人进行一般生理指标测量并记录。实验中血清ALT、AST、UA、FPG、TG、TC、LDL-C、HDL-C、CRP、Cr、BUN的检测用全自动生化分析仪,IL-1β、IL-6、IL-18及TNF-α的检测采用ELISA试剂盒。血分析采用SYSMEX XT-2000i全自动血液分析仪检测。
1.4 统计学处理:观察组与对照组IL-1β、IL-6、IL-18及TNF-α水平、一般生理指标、血生化指标、全血分析白细胞数等用独立样本t检验,计数资料采用χ2检验。计量资料用(±s)表示。采用IBM SPSS 19.0软件包对所有数据进行统计学分析,以P<0.05为有统计学差异。
2 结 果
2.1 一般临床资料及实验室检查指标比较:观察组与对照组比较,两组性别、Age、AST差异均无统计学意义(P>0.05);与对照组相比,观察组BH、BW、BMI、SBP、DBP、WC、HC、WHR、FPG、UA、ALT、Cr、BUN、TG、TC、LDL-C、HDL-C、C-RP、WBC、NEUT、NEUT%均明显升高,差异有统计学意义(P<0.05~0.01),见表1。
表1 两组一般资料及实验室检查指标水平(±s)
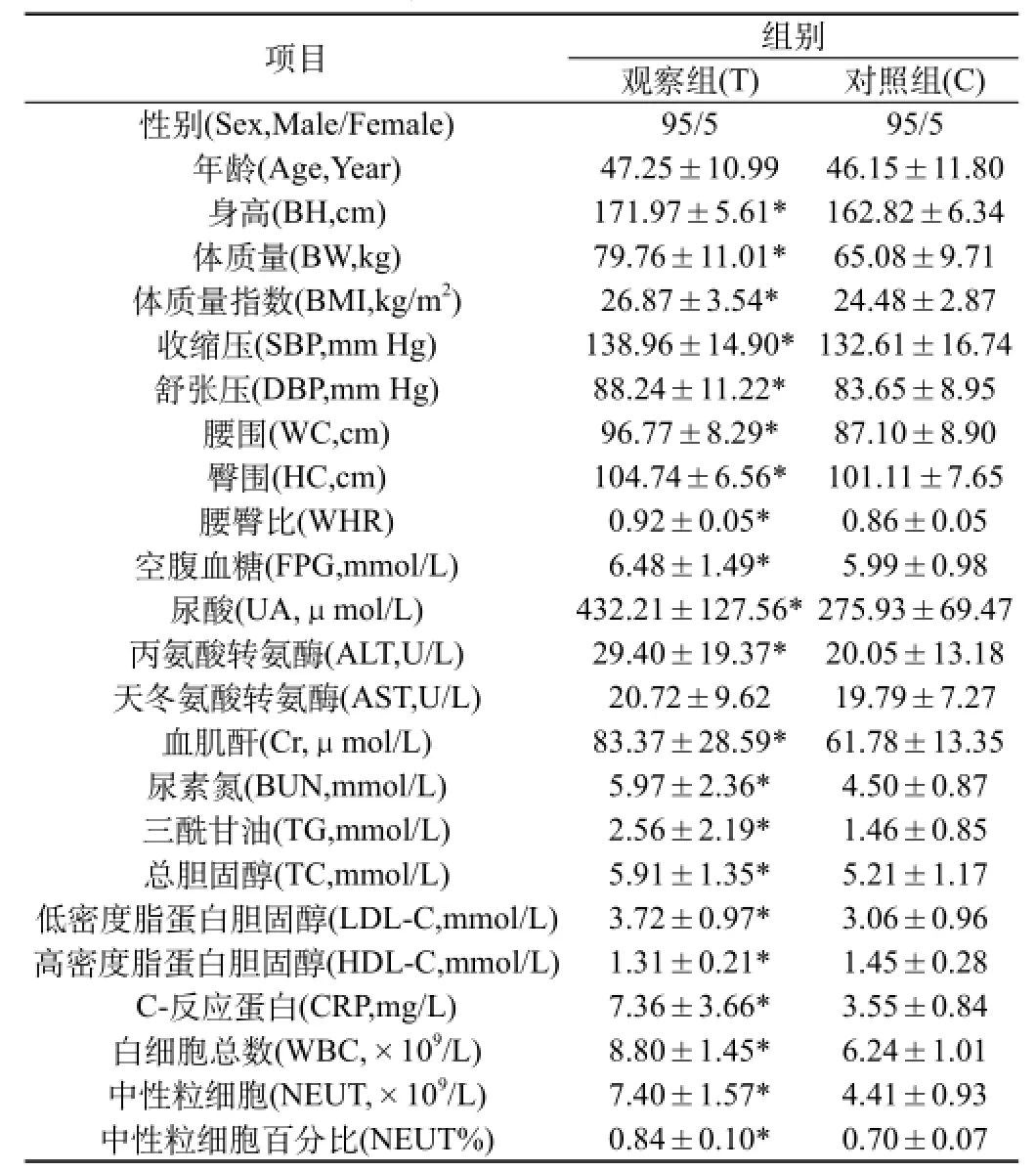
表1 两组一般资料及实验室检查指标水平(±s)
注:*观察组与对照组相比(T vs C)P<0.01,#观察组与对照组相比(T vs C)P<0.05
项目 组别观察组(T) 对照组(C)性别(Sex,Male/Female) 95/5 95/5年龄(Age,Year) 47.25±10.99 46.15±11.80身高(BH,cm) 171.97±5.61* 162.82±6.34体质量(BW,kg) 79.76±11.01* 65.08±9.71体质量指数(BMI,kg/m2) 26.87±3.54* 24.48±2.87收缩压(SBP,mm Hg) 138.96±14.90*132.61±16.74舒张压(DBP,mm Hg) 88.24±11.22* 83.65±8.95腰围(WC,cm) 96.77±8.29* 87.10±8.90臀围(HC,cm) 104.74±6.56* 101.11±7.65腰臀比(WHR) 0.92±0.05* 0.86±0.05空腹血糖(FPG,mmol/L) 6.48±1.49* 5.99±0.98尿酸(UA,μmol/L) 432.21±127.56*275.93±69.47丙氨酸转氨酶(ALT,U/L) 29.40±19.37* 20.05±13.18天冬氨酸转氨酶(AST,U/L) 20.72±9.62 19.79±7.27血肌酐(Cr,μmol/L) 83.37±28.59* 61.78±13.35尿素氮(BUN,mmol/L) 5.97±2.36* 4.50±0.87三酰甘油(TG,mmol/L) 2.56±2.19* 1.46±0.85总胆固醇(TC,mmol/L) 5.91±1.35* 5.21±1.17低密度脂蛋白胆固醇(LDL-C,mmol/L) 3.72±0.97* 3.06±0.96高密度脂蛋白胆固醇(HDL-C,mmol/L) 1.31±0.21* 1.45±0.28 C-反应蛋白(CRP,mg/L) 7.36±3.66* 3.55±0.84白细胞总数(WBC,×109/L) 8.80±1.45* 6.24±1.01中性粒细胞(NEUT,×109/L) 7.40±1.57* 4.41±0.93中性粒细胞百分比(NEUT%) 0.84±0.10* 0.70±0.07
2.2 两组血清炎性因子表达水平比较:观察组与对照组相比,IL-1β、IL-6、IL-18及TNF-α水平均显著升高,差异有统计学意义(P <0.01)。见表2。
表2 两组血清炎性因子水平(±s)

表2 两组血清炎性因子水平(±s)
注:*观察组与对照组相比(T vs C)P<0.01,#观察组与对照组相比(T vs C)P<0.05
炎性因子 观察组(T) 对照组(C)IL-1β(pg/mL) 62.41±13.68* 15.56±4.02 IL-6(pg/mL) 48.87±19.25* 10.21±3.62 IL-18(pg/mL) 198.48±21.40* 55.09±16.36 TNF-α(ng/mL) 532.77±217.95* 216.57±43.76
3 讨 论
痛风(gout)是因嘌呤代谢障碍和(或)尿酸排泄减少、血UA持续升高而导致MSU晶体析出并沉积于组织或器官引起的一组临床症候群,属于代谢性风湿病[3]。报道显示,国内痛风的患病率目前在1%~3%,2009年山东沿海地区当地居民痛风患病率为1.96%,2007年~2008年美国痛风患病率上升至3.9%[4]。AGA可发生于任何年龄,发病高峰年龄为40岁左右,且常伴有糖尿病、肥胖、心脑血管病、肾脏病等,患病率随年龄的增长有逐渐增高的趋势。本研究中,与对照组相比,观察组BH、BW、BMI、SBP、DBP、WC、HC、WHR、FPG、UA、ALT、Cr、BUN、TG、TC、LDL-C、HDL-C均明显升高(P<0.01)亦支持上述观点。AGA临床上以男性患者多见,女性约占5%[1],且多为绝经期后妇女。AGA发作时疼痛剧烈,患者异常痛苦,严重影响日常工作和生活。近年来研究发现单核/巨噬细胞系统在AGA启动、进展及缓解中均发挥了关键作用,发作涉及IL-1β、IL-6、IL-18、TNF-α等多种炎性因子,其中IL-1β是MSU晶体诱导炎症的关键因子,IL-6、IL-18、TNF-α亦发挥了重要作用。
AGA的前炎性介质来源于常驻的滑膜细胞和迁移的单核巨噬细胞,而NEUT的侵入和活化是最重要的环节。发病时关节滑液和滑膜中出现的大量NEUT甚至可与急性化脓性关节炎时相当[5]。本研究中,发病时的WBC、NEUT、NEUT%及CRP均显著高于对照组,提示AGA发病时WBC及NEUT在炎症初期就参与了反应。
IL-1β已被确定为MSU晶体诱导炎症的关键因子,IL-1β对细胞和组织有多种作用。IL-1β是IL-1可溶型。IL-1主要由单核巨噬细胞所产生,也能由中性粒细胞合成,分为膜结合型(IL-α)和可溶型(IL-β)两种。IL-1多存在于血液和组织中。其生物学活性包括活化巨噬细胞、粒细胞并增强其活性;刺激单核/巨噬细胞等合成IL-1、IL-6、IL-8及TNF-α;致炎性反应等。IL-1β在滑膜、滑液、软骨等关节组织中均有它的活性形式被发现,并被认为是最经典的炎症调节剂,是炎症调节的始动因素。AGA时,MSU及UA激活NLRP3炎性体,上调IL-β表达,促进AGA患者炎性反应发生、进展[6-7]。本研究结果中发现,观察组血清IL-1β水平在AGA发病时较对照组明显升高,差异有统计学意义(P<0.01),提示IL-β在AGA炎症发生、进展时发挥及其重要的作用。
IL-6是AGA的重要炎性因子,发病时关节液中IL-6水平明显升高。本研究中,观察组血清IL-6水平与对照组相比显著升高,差异有统计学意义,表明IL-6在AGA炎症过程中发挥重要作用。与国内研究显示AGA致炎性因子IL-6表达显著升高相一致[8]。IL-6主要由Th2细胞产生,单核/巨噬细胞、成纤维细胞、内皮细胞、肥大细胞等亦可产生。IL-1可刺激单核/巨噬细胞等合成IL-6。IL-6有多种生物活性,参与多种疾病的炎性反应[9],可抑制炎性反应的许多方面,如减少中性粒细胞,单核/巨噬细胞在脂多糖诱导下的IL-1、TNF的合成;增加IL-1Ra合成;促进IL-1β及TNF受体释放;减少IL-8等炎症趋化因子的表达。在痛风性关节炎患者滑液中发现IL-6水平升高。有报道称,当痛风性关节炎等病情活动或关节破坏严重时,血清与关节液中IL-6水平升高。有人将IL-6作为判断痛风性关节炎等疾病活动性和严重程度的指标[10]。
IL-18也是AGA炎性反应过程中的重要炎性因子,其可能主要来源于痛风性关节炎患者的软骨和滑膜细胞及内皮细胞[5]。IL-18发挥生物学效应的活性成分,由单核/巨噬细胞、树突状细胞和Kupffer细胞,以及一些成骨细胞和角质形成细胞分泌,是在NLRP3炎性体介导caspase-1的活化,水解激活IL-18的前体释放出来。作为AGA一个重要的调节因子,IL-18通过促进NEUT的聚集,促进炎性反应,具有促进T细胞增殖的作用,增强TH1细胞和NK细胞的细胞毒活性,是一种多效能炎性细胞因子[11]。IL-18最终作用是产生干扰素-γ,从而加速炎性反应,成熟IL-18对IFN-γ的产生过程和对促溶细胞性NK细胞的活性有重要影响。本研究中,观察组血清IL-18水平与对照组相比显著升高,差异有统计学意义(P<0.01),提示IL-18参与了AGA炎性反应,在AGA启动、进展时发挥了重要作用。
TNF-α是一种具有内毒素样抗肿瘤炎性细胞因子,可作用于T细胞、B细胞、NK细胞发挥多种生物学活性。TNF-α主要由巨噬细胞、单核细胞产生,中性粒细胞、内皮细胞、星状细胞、平滑肌细胞、杀伤细胞也可产生TNF-α。有研究表明[12],TNF-α在风湿性关节炎的血清和滑膜中大量增加,并刺激下丘脑体温调节中枢及巨噬细胞释放IL-1、IL-6。TNF-α主要作用是刺激机体产生炎性反应,减低基质中蛋白多糖、胶原物质的合成,诱导基质金属蛋白酶高表达,增加血管内皮细胞的通透性,刺激产生如IL-1、IL-6、IL-8等炎性细胞因子。研究显示,在炎症的早中期阶段,痛风患者关节液中IL-1β、IL-6和TNF-α等炎性因子水平和白细胞水平明显升高。本研究中,观察组血清TNF-α水平与对照组相比显著升高,差异有统计学意义(P <0.01),表明在AGA炎症启动阶段TNF-α水平升高,与国内有些研究结果相一致[8,13]。TNF-α可加速急性滑膜炎关节滑液内的NEUT凋亡过程,凋亡的NEUT可被巨噬细胞所吞噬[5]。关于TNF-α对NEUT凋亡影响的研究结论尚不一致。
总之,本研究结果表明,IL-1β、IL-6、IL-18及TNF-α水平在AGA患者发病时异常,提示它们在AGA发病中参与了炎性反应过程,在炎症机制中可能发挥了重要作用。结果亦提示,IL-1β、IL-6、IL-18及TNF-α在炎症过程中存在共同作用,相互影响,各炎性因子之间的相互关系需要在今后的研究中进一步探讨。
参考文献
[1] Wallace K,Riedel A,Joseph-Ridge N,et al.In creasing prevalence of gout and hyperuricemia over 10 years among older adults in a managed care population[J].J Rheumatol,2004,31(18):1582-1587.
[2] Sidiropoulos PI,Goulielmos G,Voloudakis GK,et a1.Inflammasomes and rheumatic diseases: evolving concepts[J].Ann Rheum Dis,2008,67(10):1382-1389.
[3] Riehette P,Bardin T.Gout[J].Lancet,2010,375(9711):318-328.
[4] Zhu Y,Pandya BJ,Choi HK.Prevalence of gout and hyperuricemia in the US general population: the National Health and Nutrition Examination Survey 2007-2008[J].Arthritis Rheum,201l,63(10):3136.
[5] 伍沪生.痛风与晶体性关节病[M].北京:人民卫生出版社,2014:62.
[6] Martinon F,Petrilli V,Mayor A,et al.Gout-associated uric acid crystals activate the NALP3 in flammasome[J].Nature,2006,440 (7081):237-239.
[7] Gotseh F,Romero R,Chaiworapongsa T,et al.Evidence of the involvement of caspase-1 underphysiologic and pathologic cellula stress during human pregnancy: a link between the inflammasome and parturition[J].J Maternal-Fetal Neonat Med,2008,21(9):605-616.
[8] 党万太,周京国,谢文光,等.NLRP3炎性体在痛风性关节炎患者炎性反应中的机制研究[J].中国免疫学杂志,2014,30(3):373-377.
[9] 祝威,汪欣,杜宝东,等.杀菌—通透性增强蛋白对分泌性中耳炎大鼠中耳黏膜TNF-α和IL-6表达的影响[J].吉林大学学报,2004,30 (1):41-43.
[10] Punzi I,Calo L,Plobani M.Clinical sig-nificance of cytokine determination in synovial fluid[J].Crit Rev Clin Lab Sci,2002,39 (1):63-88.
[11] Sugimoto T,Ishikawa Y,Yoshimoto T,et a1.Interleukin l8 acts on memory T helper cells type l to induce airway in flammation and hyper-responsiveness in a naive host mouse[J].J Exp Med,2004,l99(4):535-545.
[12] Yabe Y,Hagiwara Y,Suda H,et al.Joint immobmmatory conditions in rat knee joints[J].Connect Tissue Res,2010,44(8):1039-1046.
[13] 党万太,王婧,谢文光,等.sCD14在痛风性关节炎患者炎性反应中的变化及其意义[J].西安交通大学学报(医学版),2015,36(4): 514-518.
中图分类号:R589.7
文献标识码:B
文章编号:1671-8194(2016)16-0003-03
基金项目:青岛市卫生科技发展计划项目,项目编号:2014-WJZD103
*通讯作者:E-mail: huanfadings@163.com
Research of Serum Level of IL-1β, IL-6, IL-18 and TNF-α of Patients with Acute Gouty Arthritis
LIU Shu-juan1, DING Huan-fa1*, XU Xiao-chen1, WANG Shang-yun2, LAN Li-qiang1, WEI Yong-tao2
(1 Department of Endocrinology, Qingdao Eighth People's Hospital, Qingdao 266100, China; 2 Department of Laboratory, Qingdao Eighth People's Hospital, Qingdao 266100, China)
[Abstract]Objective To investigate the change of serum level of interleukin (IL)-1β, IL-6, IL-18 and tumor necrosis factor (TNF)-α in the subjects with acute gouty arthritis (AGA) and their significance. Methods Based on standards of American College of Rheumatology (ACR) in 1997, 100 AGA patients were selected as AGA group (T) and 100 healthy subjects as control group (C). IL-1β, IL-6, IL-18 and TNF-α were measured using Enzyme-linked immunosorbent assay (ELISA) in the two groups. The statistical data were analyzed by IBM SPSS 19.0 software. Independent-samples t test was used in two groups. Result The expression of IL-1β, IL-6, IL-18 and TNF-α increased significantly when compared to C (P<0.01). Conclusion Increased expression of IL-1β, IL-6, IL-18 and TNF-α level are involved in the inflammatory response and play important roles in the pathogenesis of the process of AGA.
[Key words]Interleukin-1β; Interleukin-6; Interleukin-18; Tumor necrosis factor-α; Arthritis gouty

