小球藻等离子束诱变高产菌筛选
刘秀花 梁 梁 陈仲达 张淑红 宋兆齐 王 莉 梁 峰(商丘师范学院 生物精炼河南省工程实验室,河南 商丘 476000)
小球藻等离子束诱变高产菌筛选
刘秀花梁梁陈仲达张淑红宋兆齐王莉梁峰
(商丘师范学院生物精炼河南省工程实验室,河南商丘476000)
采用等离子束诱变对小球藻进行诱变处理,以期提高细胞油脂含量。通过荧光分光光度法对诱变菌株进行初筛,其中6株菌油脂含量高于出发菌株。再通过苏丹黑染色观察、尼罗红染色和酸热解法提取油脂等进行复筛,其中45s2-14产油量最高,达到0.070 7g/mL,45s2-1单位鲜菌体产油量达到26.9%,进一步优化培养条件将有望应用于工业化生产。
小球藻;等离子束诱变;油脂
随着化石能源的日渐枯竭,以及化石能源所带来的温室效应日渐严重,越来越多的科研工作者开始投入到可再生能源的研究和开发利用上[1]。无论是作为保健品或者是制备生物柴油,油脂都起到重要的作用。以动物、高等植物为原材料的油脂已经不能够满足人们日常生活和工业生产的需要[2]。而微藻类作为一种新型的化石能源替代品,由于其具有来源广、成本低、清洁可再生、生长速度快[3],光合作用效率高,不占用耕地面积[4],易于实现大规模工业化生产等优点,备受科研工作者的青睐[5]。微藻中得到的脂肪酸可转化成脂肪酸甲酯,即生物柴油。生物柴油作为化石能源的替代品,是一种新型可再生能源,具有广阔的应用前景。由于成本较高等因素限制了微藻油脂制备的工业化生产[6]。目前,降低藻类油脂制备成本成为亟待解决的一大问题。降低成本的方法有很多,包括优化培养基,降低培养成本,增加微藻油脂的积累量,增加可直接转化为生物柴油的成分,简化微藻生物柴油制备的生产工艺等。而增加微藻油脂积累的同时又提高微藻的生物量是最重要的方法,要大幅度提高油脂产量,选育优质高产的微生物菌种是最有效的途径。
该研究从增加油脂的积累量着手,通过对小球藻进行等离子束诱变,并对诱变菌株进行初筛、复筛,得到2株高产微藻藻株,从而为进一步提高油脂含量,以及利用微藻大规模工业化生产制备生物柴油进行有益探索。
1 材料与方法
1.1藻种和培养基
选用实验室所分离纯化并鉴定的小球藻(Chlorella sp.ZSLD-2-1 KF689557)。
培养基为基础培养基(BBM培养基,g/L):NaNO30.25,KH2PO40.175,K2HPO40.075,MgSO40.075,CaCl2· 2H2O 0.025,NaCl 0.25,EDTA 0.05,KOH 0.031,FeSO4· 7H2O 4.98×10-3,MnCl21.44×10-3,H3BO311.42×10-3,Zn-SO48.82×10-3,MoO30.71×10-3,CuSO4·5H2O 1.57×10-3,CO(NO3)2·6H2O 0.49×10-3,琼脂18g。培养基的配制方法:先量取500mL蒸馏水,加入1 000mL烧杯中,置于磁力搅拌器上,再依次加入上述试剂,定容至1 000mL,调pH至8.0。分装于500mL三角瓶中。高压蒸汽灭菌121℃灭菌30min,倒平板备用。
1.2研究方法
1.2.1等离子束诱变。采用北京艾德豪克国际技术有限公司生产的MANDELA型多功能等离子体诱变系统诱变。从斜面培养基挑取目的菌株,平板划线,放置于小球藻培养室内培养6d。从培养6d后的平板上挑取菌种接种至无菌水中悬浮。用移液枪吸取1.5mL藻液,离心收集藻体。用生理盐水重悬藻体,取1mL重悬后的藻液于血球计数板上,计数并调整藻液细胞数为105个/mL。取重悬后的藻液15μL,加入诱变系统的加样器中制成菌膜。将加样器放入诱变器中在通气量为12SLM,高度为5mm的条件下设定诱变时间分别为0、30、40、45、50、55、60、70s和80s诱变。用移液枪吸取1.5mL生理盐水冲洗菌膜,收集冲洗液,并吸取0.1mL冲洗液涂布平板,再用封口膜封闭平板,放入培养室培养。
1.2.2初筛。采用尼罗红荧光分光光度法初筛。挑取死亡率在80%左右的诱变菌株进行初筛。将诱变菌株分别接种于含有50mL BBM液体培养基的锥形瓶中,置于培养室内培养3d。3d后从每个锥形瓶内吸取lmL菌液计数,保证最后接种量一致。分别等量接种在5mL BBM液体培养基的试管中,每个菌株接3管,置于培养室内倾斜培养10d。将培养10d后的藻液离心收集菌种,离心收集后的藻种重悬浮于30mL离心管中。取8mL重悬后的菌液,加入2mL的二甲基亚枫,摇晃使之充分混匀。再加入30μL尼罗红染液,放置10min,取适量染色后的菌液放置于荧光分光光度计中,测定吸收峰[7,8]。初筛结果以单位荧光强度数值大小判定。单位荧光强度=(吸收峰-基础峰)/OD。
1.2.3复筛。将初筛所得目的菌株分别接种于100mL的BBM液体培养基中,置于培养室内培养10d,之后分别用热酸解法提取油脂,尼罗红染色荧光显微观察,苏丹黑染色显微观察的方法进行复筛。
酸热解法提取油脂:取若干支恒重的离心管,将培养10d后的菌液离心(8 000r/min,5min)收集菌体。将离心管倒置控水1h后,称取鲜菌体质量。之后加入6mol/L的HCl 6mL,并放置于超声波破碎仪中处理30min,再置于沸水浴中2h,使细胞完全破碎。取出并冰水浴10min,加入95%乙醇,放置10min。再加入5mL乙醚、5mL石油醚,摇晃使之混匀。离心(8 000r/min,5min),吸取上层有机溶剂层置于恒重的试管中。再在上述离心管中加入5mL乙醚、5mL石油醚,摇晃使之混匀。离心(8 000r/min,5min),吸取上层有机溶剂层置于称过重的试管中。将含有有机溶剂的试管放置于通风橱中冷却,再置于烘箱中(40℃)使有机溶剂挥发,称取油脂质量[9]。
苏丹黑染色方法:吸取1mL培养10d后的菌液,离心收集菌体(8 000r/min,3min),加入一定量的苏丹黑染液,染色30~60min。将染色后的菌液离心弃上清,并加入一定量的无菌水,摇晃混匀后再次离心弃上清,之后加入70%乙醇,摇晃混匀,离心弃上清。最后加入一定量的无菌水,制片观察[10]。
2 结果分析
2.1初筛结果
对诱变菌株进行初筛,最终得到6株含油量较高的菌株,分别为45s2-1、45s2-8、45s2-12、45s2-13、45s2-14 和L4,结果如表1所示。
从表1可以看出,45s2-14的OD只值最高,表明菌体收获量最多;而45s2-12的单位菌体荧光强度最高,为116.483;45s2-13稍次之,为91.005。可以初步得出结果,诱变后的菌株油脂含量有明显提高。但由于尼罗红染色荧光分光光度计只能粗略地估计藻类细胞内的大致油脂含量,所以还需进一步开展研究实验进行验证。

表1 初筛结果
2.2复筛结果
通过对初筛结果采用尼罗红染色、苏丹黑染色显微观察及酸热解法提取油脂等方法进行分析,尼罗红染色结果见图1,苏丹黑染色结果见图2,结果表明尼罗红染色与苏丹黑染色结果一致,诱变后细胞内油脂含量明显增加。
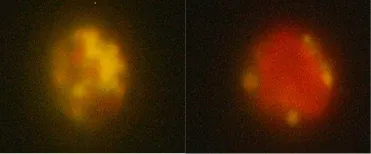
图1 尼罗红染色荧光显微图像
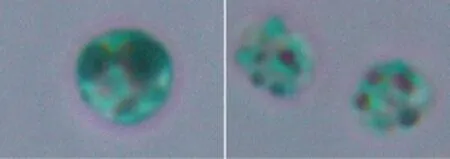
图2 苏丹黑染色显微图像
为了解藻体细胞的含油量,采用了酸热解法提取油脂,结果见表2。
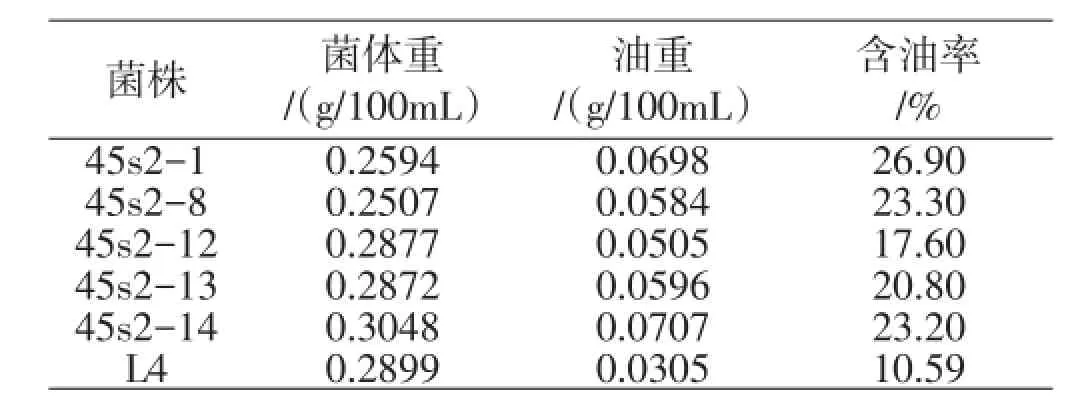
表2 100mL藻体培养物产油脂能力
从表2可以看出,45s2-1的单位菌体含油百分比最高为26.9%,产油量达到0.698g/mL,而45s2-14产油量最大,达到0.070 7g/100mL藻液,单位菌体含油百分为23.2%。经比较分析,可以看出,综合生物量和产油量45s2-1含油量最高,不过由于菌体量最低,不适合大规模的工业化生产。在以后的研究实践中,可以通过优化培养基等方法提高其菌体生长速率与菌体量。45s2-14虽然含油量不是最高,但鲜菌体重量与油脂含量都较高,适合作为大规模的工业化生产菌株。
3 分析与讨论
采用尼罗红染色荧光分光光度计法初筛,45s2-12和45s2-13的单位菌体荧光强度值最大,远高于出发菌株L4。复筛采用染色法和提取法,通过对菌株进行尼罗红染色和苏丹黑染色比较细胞内油脂含量,又通过酸热解法提取油脂,测定菌株实际含油量。得到准确的数据,确定高含油菌株。最后得出,45s2-1含油百分比最高,45s2-14次之。但由于相同培养条件下45s2-14鲜菌体量较高,且实际所得油脂量最大,适合于大规模的培养与油脂提取。45s2-1虽然含油百分比最高,但由于生长量较低,所以实际所得油脂量却不是最高的。因此,在以后的实验研究中,需对45s2-1菌株进行培养条件与培养基的优化,以提高45s2-1的生长量,得到更多的油脂。同时,在以后的科研工作中还可以通过运用基因工程、定点突变等技术手段对微藻进行改造,以便得到更高产油脂量的菌株。
通过等离子束诱变处理,对诱变菌株进行初筛得出6株高含油量菌株,又通过复筛,测定实际含油量,得出2株高含油量的目的菌株。从油脂含量方面入手,对未来的生物柴油的大规模生产得到较满意的结果。但在未来的研究中,还需从优化培养基、改变生长条件、改变其代谢方式、简化生产工艺的多方面同时入手,不断向生物柴油的大规模生产,造福于全人类的方向推进。同时,微藻作为一种营养丰富的高价值植物,无论是对其进行食品加工或是保健品的开发都具有广阔的前景。
[1]王萌,陈章和.藻类生物柴油研究现状与展望[J].生命科学,2011(1):121-126.
[2]宋东辉,侯李君,施定基.生物柴油原料资源高油脂微藻的开发利用[J].生物工程学报,2008(3):341-348.
[3]王蒙,李纯厚,戴明.以海洋微藻为原料提取生物燃料的研究进展与发展趋势[J].南方水产,2009(1):74-80.
[4]姜进举,苗凤萍,冯大伟,等.微藻生物柴油技术的研究现状及展望[J].中国生物工程杂志,2010(2):134-140.
[5]Chisiti Y.Biodiesel from microalgae beats bioethanol [J].Trends Biotechnol,2008(3):126-131.
[6]Miao Xiaoling,Wu Qingyu.Biodiesel production from heterotrophic microalgal oil[J].Bioresource Technol,2006(6):841-846.
[7]王海英,符茹,黄宝祥.基于尼罗红荧光染色的小球藻脂质快速检测方法研究[J].中国油脂,2012(3):78-81.
[8]梁文艳,张元春,曹敬灿,等.采用尼罗红荧光探针对微藻中油脂的定量测定[J].环境化学,2013(8):1491-1495.
[9]E.G.Bligh,W.J.Dyer.A rapid method of total lipid extraction and purification[J].Canadian Journal of Biochemistry and Physiology,1959(8):911-917.
[10]林汝榕,邢炳鹏,蔡文炫,等.苏丹黑B染色处理细胞技术在快速检测微藻油脂含量中的应用[J].台湾海峡,2011(2):292-298.
Screening High Oil Production Strains from Plasma-Beam Treated Mutagenic Chlorella
Liu XiuhuaLiang LiangChen ZhongdaZhang ShuhongSong ZhaoqiWang LiLiang Feng
(Biorefinery Engineering Lab of Henan Province,Shangqiu Normal University,Shangqiu Henan 476000)
High oil production strains were screened out from plasma-beam treated Mutagenic Chlorella,in order to improve the cellular lipid content.The screening of the mutant strain was carried out by means of fluorescence spectrophotometry,and the content of six strains of bacteria was higher than that of the starting strain.Then screening by Sultan black staining,Nile red staining and acid solution of heat extraction oil etc,45s2-14 has the highest oil content,which is 0.070 7g/mL,45s2-1 unit fresh biomass production reached 26.9%,further optimization of the culture conditions would be expected to be applied to industrial production.
Chlorella;plasma-beam mutagenesis;oil
TQ923
A
1003-5168(2016)04-0122-03
2016-03-06
河南省重点科技攻关项目资助(132102310039,142102310044);河南省教育厅自然科学研究项目(13A180830)。
刘秀花(1963-),女,教授,研究方向:微生物资源、酶制剂、生物能源。

