不同来源的细胞因子诱导的杀伤细胞体外抗肿瘤作用的比较研究
于 鸿 张耿月 魏天雪 何春莹 刘玉侠吉林省肿瘤防治研究所,吉林长春 130012
不同来源的细胞因子诱导的杀伤细胞体外抗肿瘤作用的比较研究
于鸿张耿月魏天雪何春莹刘玉侠▲
吉林省肿瘤防治研究所,吉林长春130012
[摘要]目的比较来自脐带血和恶性肿瘤患者外周血的细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)体外抗肿瘤作用的差异。方法 体外诱导培养肺癌患者外周血和脐血来源的CIK细胞,MTT法和流式细胞术检测诱导的CIK细胞的抗肿瘤活性及机制。结果 来自肺癌患者外周血和脐血的CIK细胞中CD3+细胞、CD3+CD56+和CD3+CD8+细胞百分比均伴随培养时间的延长而升高,组间比较无统计学差异;诱导培养21 d时,脐血CIK细胞和肺癌患者外周血来源的CIK细胞的增殖率分别为(185.76±39.68)%、(254.32±74.60)%,二者之间差异有统计学意义(P=0.0012);脐血CIK细胞的抗肿瘤活性高于肺癌患者外周血来源的CIK细胞(效靶比10∶1,靶细胞为K562细胞时,P=0.0016;靶细胞为A549细胞时,P=0.0022);脐血CIK细胞CD107a表达高于来自肺癌患者外周血的CIK细胞(靶细胞为K562细胞时,P=0.0469;靶细胞为A549细胞时,P=0.0413);脐血CIK细胞IFN-γ和TNF-α的分泌水平高于肺癌患者CIK细胞(P=0.0352;P=0.0389);脐血CIK细胞和肺癌患者CIK细胞诱导K562细胞凋亡的百分率为(25.30±4.87)%和(19.87±5.41)%,二者之间差异无统计学意义(P=0.2658)。结论 流式细胞术可同时检测CIK细胞的表型、功能及作用机制。本研究为临床应用CIK治疗提供更多选择和实验室依据。
[关键词]细胞因子诱导的杀伤细胞;流式细胞术;免疫治疗;CD107a
细胞因子诱导的杀伤细胞(cytokine induced killer cells,CIK)是一群异质性的具有抗肿瘤作用的细胞。CIK细胞主要表达CD3和CD56,抗肿瘤活性强,增殖迅速。用患者自身PBMC诱导的CIK细胞已经显示良好的临床疗效,尤其对慢性髓系白血病、肝癌、结直肠癌、肾癌、肺癌、乳腺癌等[1]。但是肿瘤患者在经历了放化疗后,经常出现白细胞减少、贫血等症状。尤其晚期恶性肿瘤患者每毫升外周血中单核细胞的数量也较正常人少。因此为了减轻患者负担,提高临床疗效,本研究比较了来自健康捐助者的脐血CIK细胞和来自肺癌患者外周血的CIK细胞在体外的抗肿瘤作用,并初步探讨了其机制上的差异,以寻找更有效可行的CIK治疗方法。
1 材料与方法
1.1材料来源
白血病细胞系K562和肺癌细胞系A549由吉林省肿瘤防治研究所常规传代培养。Recombinant hu man interleukin(IL)-2、IFN-γ、CD3-mAb(OKT-3)、IL-1α购自Biolegend。PI、anti-CD3-ECD、anti-CD56-PC5、anti-CD8-PC5、anti CD3-FITC、anti-CD8-FITC及相应的同型对照抗体均购自贝克曼库尔特公司。5,6-carboxyfluoresceindiacetatesuccinimidyester(CFSE)购自Molecular Probes。Annexin V apoptosis kit购自BD公司。MonensinSolution(BioLegend,Cat.420701)。PE anti-human CD107a(Lysosome-Associated Membrane Protein1,LAMP-1,BioLegend,Cat.328608,Clone:H4A3)。CCK-8购自碧云天生物技术公司。
1.2方法
1.2.1诱导培养CIK细胞肺癌患者外周血 (4份,10 mL/份)来自吉林省肿瘤医院住院患者(2014年8月~2015年8月);4份脐血(10 mL/份)来自吉林省妇幼保健院(2014年8月~2015年8月)。血液样本分别经红细胞裂解液处理后,获得的细胞被培养在IMDM培养基中(10%FCS,37℃,5%CO2饱和湿度),细胞浓度(1~2)×106/mL。培养24 h后,加入1000 U/mL IFN-γ,CD3-mAb(50 ng/mL),IL-2(300 U/mL),IL-1α(100 U/mL),继续培养并每3天半量换液或扩瓶1次,同时补加IL-2(300 U/mL)。在培养的第14天和第21天收获细胞,流式细胞仪检测分析(Beckman Coulter Epics XL-MCL)细胞表型,即 CD3+CD56+、CD3+CD8+细胞百分率。
1.2.2CIK细胞增殖实验采用CCK-8染色法检测诱导培养21 d的脐血CIK细胞和来自肺癌患者外周血的CIK细胞的增殖率。调整CIK细胞的初始密度为5×104/mL,37℃、5%CO2培养箱中培养,每3天扩瓶1次,CCK-8染色,酶标仪检测(490 nm),直到第21天,计算增殖率并分析比较实验结果。
1.2.3CIK细胞体外抗肿瘤活性实验(流式细胞仪法)标记靶细胞:A549和K562细胞用PBS洗1遍,调整细胞浓度为1.5×106/mL,CFSE(2.5 μmol/L)标记细胞,37℃孵育8 min,PBS洗细胞1次,加入1 mL IMDM(含10%FCS),室温避光孵育10 min,再加入PBS洗细胞1次备用。标记效应细胞:调整CIK细胞浓度为1×106/100 μL,标记用CD3、CD8和CD56抗体,室温避光孵育30 min,细胞用PBS洗1次备用。调整靶细胞密度为5×104/mL,设置不同的效靶比,分别为1∶1、5∶1、10∶1,相应的CIK效应细胞浓度分别为5×104/mL、25×104/mL、50×104/mL,分别设单独的靶细胞和效应细胞对照,37℃、5%CO2培养箱中培养24 h后,PI染色,流式细胞仪检测分析。
1.2.4CIK细胞体外抗肿瘤活性实验 (MTT法)按上述同样的效靶比将细胞接种于96孔板中,靶细胞浓度为2×104/孔,37℃ 5%CO2培养箱中培养24 h后,加入CIK细胞,MTT法检测CIK对靶细胞的杀伤效率。酶标仪检测490 nm处吸光度(A)值。抑制率(%)= [1-(实验组A值-CIK细胞A值)/肿瘤细胞A值]× 100%。
1.3观察指标
1.3.1检测CIK细胞CD107a表达 调整CIK细胞浓度为1×106/100 μL,加入CD107a-PE(10 μL),37℃,5%CO2培养箱中培养1 h后,加入Monensin,将效应细胞和靶细胞按10∶1的效靶比混合,37℃,5%CO2培养箱中培养3~4 h,PBS洗细胞1次,标记细胞用相应的CD3、CD8和CD56抗体,2%多聚甲醛固定细胞,流式细胞仪检测分析。实验设阴性对照(单独CIK组)以控制自发产生的CD107a。
1.3.2细胞因子的检测按前述方法将10∶1混合的效靶细胞(A549)培养24 h后,ELISA法检测培养上清中IFN-γ和TNF-α表达。
1.3.3细胞凋亡实验按前述方法将10∶1混合的效靶细胞(K562)培养24 h后,收集细胞,Annexin V/PI染色,流式细胞仪检测分析,每个样本收集10000个细胞。数据分析采用Coulter EXPO 32 v1.2软件。
1.4统计学分析
2 结果
2.1流式细胞术检测诱导培养的CIK细胞表型
来自肺癌患者外周血和脐血的CIK细胞在诱导培养的第14天和第21天的细胞表型检测结果表明,随着培养的延长,CD3+细胞、CD3+CD56+和CD3+CD8+细胞百分比升高(图1)。培养第14天时,来自肺癌患者外周血CIK细胞的CD3+细胞、CD3+CD8+和CD3+CD56+细胞百分比分别为(86.00±5.25)%、(66.88±2.56)%、(14.90±5.79)%;脐血CIK细胞的CD3+细胞、CD3+CD8+和CD3+CD56+细胞百分比分别为(90.68±1.77)%、(69.00±7.60)%、(20.13±3.09)%。培养第21天时,来自肺癌患者外周血CIK细胞的CD3+细胞、CD3+CD8+和CD3+CD56+细胞百分比分别为(91.13±5.48)%、(70.58± 2.49)%、(14.98±5.53)%;脐血CIK细胞的CD3+细胞、CD3+CD8+和CD3+CD56+细胞百分比分别为(96.83± 1.18)%、(76.15±5.78)%、(21.35±2.70)%。虽然脐血CIK细胞的CD3+、CD3+CD8+和CD3+CD56+细胞百分比高于肺癌患者外周血来源的CIK细胞,但二者之间差异无统计学意义(CD3+细胞百分比:P=0.1348;CD3+CD8+细胞百分比:P=0.0836);CD3+CD56+细胞百分比:P=0.1269。
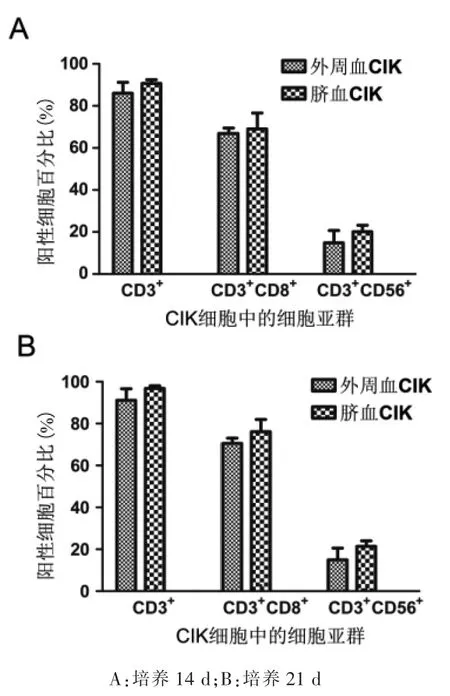
图1 CIK表型分析
2.2CIK细胞增殖实验结果
本研究使用CCK-8染色实验检测CIK细胞的增殖能力,培养21 d的肺癌患者外周血和脐血来源的CIK细胞增殖率分别为(185.76±39.68)%、(254.32±74.60)%,二者之间差异有统计学意义(P=0.0012)。
2.3CIK细胞体外抗肿瘤活性实验(流式细胞仪法)结果
CIK细胞与肿瘤细胞共孵育后,CIK细胞表面CD3、CD8、CD56的表达率与单独CIK对照组相比没有发生明显变化。以死亡的靶细胞标记为CFSE+PI+为依据,进一步比较来自肺癌患者和脐血的CIK细胞的抗肿瘤活性,结果表明,二者对A549和K562细胞均有抑制作用,来自脐血的CIK细胞有更强的抗肿瘤作用(图2)。
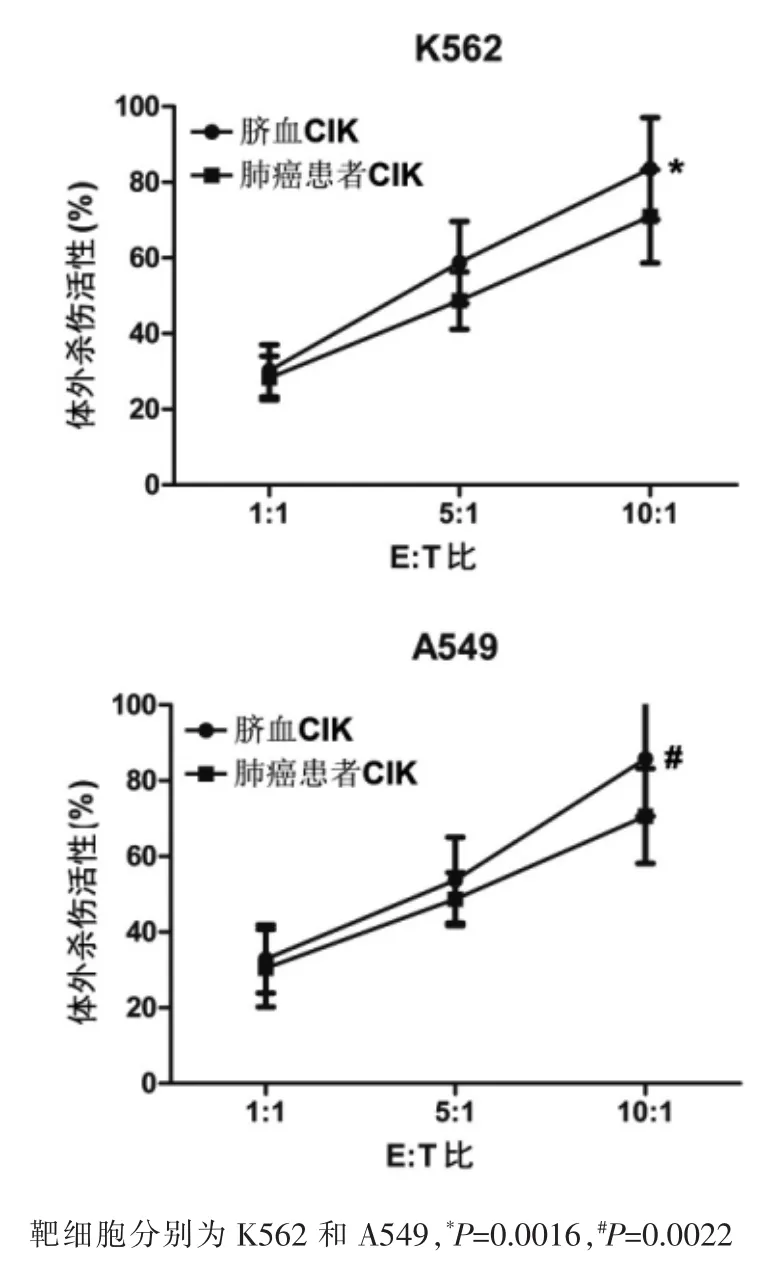
图2 流式检测CIK细胞对肿瘤细胞的杀伤作用
2.4CIK细胞体外抗肿瘤活性实验(MTT法)结果
根据公式计算来自肺癌患者外周血和脐血的CIK细胞对A549和K562细胞的体外生长抑制率,结果显示肿瘤患者自体CIK细胞和脐血CIK细胞均有不同程度的抗肿瘤效应且随效靶比的升高而增加;效靶比相同时,脐血CIK细胞的体外抑瘤活性高于来自肺癌患者的CIK细胞(图3)。
2.5检测CIK细胞CD107a表达实验结果
本研究通过检测CD107a的表达来间接说明CIK细胞的细胞毒性功能,实验结果表明,脐血CIK细胞CD107a表达高于来自肺癌患者外周血的CIK细胞(图4)。
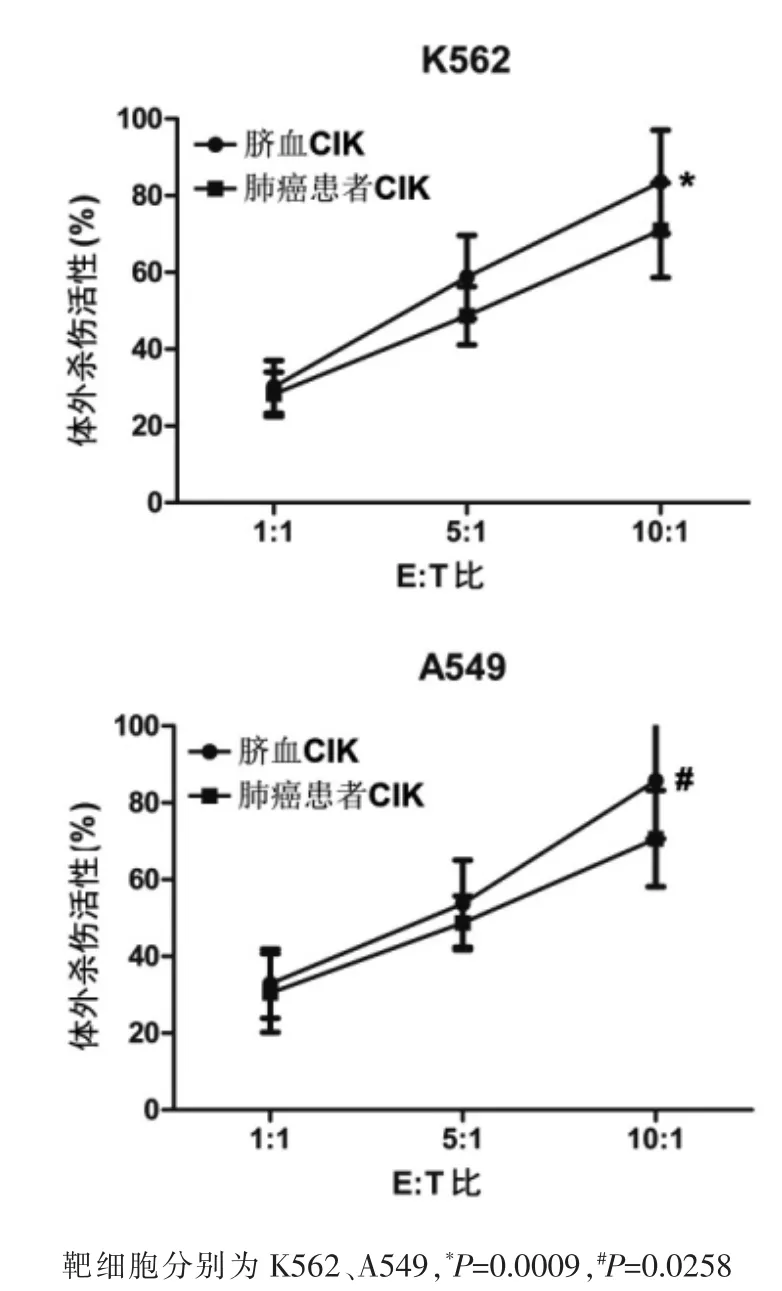
图3 MTT法检测CIK细胞对肿瘤细胞的杀伤作用
2.6检测CIK细胞分泌的细胞因子
ELISA法检测CIK细胞分泌的IFN-γ和TNF-α,脐血CIK和肺癌患者CIK分泌IFN-γ分别为(185.25± 30.45)pg/mL和(148.72±35.83)pg/mL,两者比较差异有统计学意义(P=0.0352);TNF-α分别为(20.85± 4.58)pg/mL和(14.88±3.32)pg/mL,两者比较差异有统计学意义(P=0.0389)。
2.7流式检测肿瘤细胞凋亡实验结果
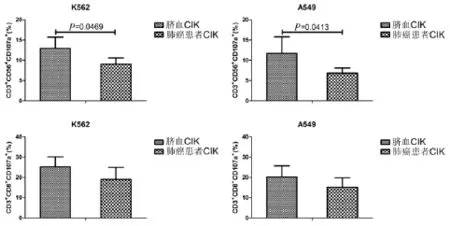
图4 不同CIK细胞CD107a表达
本研究用Annexin V/PI双染色检测来自肺癌患者外周血来源的CIK细胞和脐血CIK细胞对K562细胞凋亡的影响,结果见图5。脐血CIK细胞诱导的K562细胞凋亡的百分率[Annexin V+PI-细胞:(25.30± 4.87)%]高于肺癌患者的CIK细胞[Annexin V+PI-细胞:(19.87±5.41)%],但是统计学分析结果显示二者之间差异无统计学意义(P=0.2658)。
3 讨论
细胞因子诱导的杀伤细胞(CIK)临床治疗恶性肿瘤的安全性和可行性已被很多基础和临床试验确认[2-6]。CIK细胞是异质性的细胞群体,包括 CD3+CD56+、CD3+CD56-、CD3-CD56+细胞群,其中CD3+CD56+细胞来自CD3+CD56-T细胞,主要负责非主要组织相容性复合体(MHC)限制性的抗肿瘤活性。体外诱导培养的CIK细胞是单个核细胞在CD3单抗和多种细胞因子(包括IFN-γ、IL-2等)作用下产生的一群以CD3+CD56+细胞为主要效应细胞的异质细胞群,既具有T淋巴细胞强大的抗肿瘤活性,又具有NK细胞的非MHC限制性肿瘤杀伤能力,杀瘤活性高、杀瘤谱广。
目前,对于CIK细胞大规模制备应用和总体疗效的评估已经达成一定的共识[7,8]。本研究在前人经验的基础上[9-11],比较了来自脐血和肺癌患者外周血来源的CIK细胞体外抗肿瘤作用及机制的差异,以期为CIK细胞的临床应用提供更多的实验依据。本研究实验结果表明,与肺癌患者CIK细胞相比,脐血来源的CIK细胞表达CD3+CD56+、CD3+CD8+的比例更高,具有明显增强的抗肿瘤作用和增殖能力,同时伴随增加分泌IFN-γ、TNF-α。IFN-γ能够调节机体的免疫力,抑制病毒复制,抑制肿瘤细胞的增殖;TNF-α除能够诱导肿瘤细胞凋亡之外,还能够促进细胞毒性T细胞的分化以及其他效应因子,如IL-2、IFN-γ等的产生。
CIK细胞的抗肿瘤机制主要通过效靶细胞的接触,CIK细胞表面的黏附分子,白细胞功能相关抗原-1 (leukocyte function-associated antigen-1,LFA-1)与肿瘤细胞表达的LFA-1配体结合,导致对肿瘤细胞的细胞毒作用;CIK细胞活化的信号通路主要涉及NK细胞受体与肿瘤细胞表达的配体的结合和被活化,最终导致对肿瘤细胞的脱颗粒和细胞毒性;此外,CIK细胞由Fas配体通过Fas信号通路诱导肿瘤细胞凋亡[12-17]。

图5 CIK细胞对K562细胞凋亡的影响
效-靶细胞接触后,微管的极化运动会将溶解性颗粒运输到细胞之间的免疫突触中。颗粒一旦到达效应细胞的质膜,质膜就会溶解,颗粒即被释放到免疫突触中,最终导致靶细胞死亡[16]。CD107a(LAMP-1)、CD107b(LAMP-2)是溶酶体相关膜糖蛋白(LAMPs)。效应细胞的脱颗粒作用导致细胞内的细胞毒性颗粒膜上存在的CD107a和b暴露在细胞表面,这一过程与细胞内穿孔素的流失相关,也与细胞内IFN-γ的产生相关。因此检测CD107a和CD107b的表达可以更全面的分析CIK细胞的功能。本研究的结果证实了脐血CIK细胞CD107a的表达高于来自肺癌患者外周血的CIK细胞。
目前流式检测技术已广泛应用于基础实验和临床研究,使用流式细胞仪可以检测单个细胞水平的增殖,敏感性大大提高,而且结合单抗标记可以反映不同的细胞亚群的增殖、功能和作用机制,提供的信息更为丰富,同时也大大提高工作效率。本研究的技术路线就是采用流式细胞术同时检测脐血CIK和肺癌患者来源的CIK细胞表型、功能和肿瘤细胞的凋亡等,使实验结果的准确性和一致性明显提高。如CIK细胞的体外抗肿瘤实验采用流式检测和MTT法同步进行,流式细胞术所获得的检测结果与MTT法相比敏感性和重复性更佳。
综上所述,本研究为临床应用CIK治疗提供更多选择和实验室依据。后续的研究需要进一步比较不同来源的CIK细胞在作用机制上的差异,最终为提高临床疗效提供证据。
[参考文献]
[1]Guo Y,Han W.Cytokine-induced killer(CIK)cells:From basic research to clinical translation[J].Chin J Cancer,2015,34(3):99-107.
[2]Zhang Q,Liu XY,Zhang T,et al.The dual-functional capability of cytokine-induced killer cells and application in tumor immunology[J].Hum Immunol,2015,76(5):385-391.
[3]Li R,Wang C,Liu L,et al.Autologous cytokine-induced killer cell immunotherapy in lung cancer:A phase II clinical study[J].Cancer Immunol Immunother,2012,61(11):2125-2133.
[4]Avigan DE,Vasir B,George DJ,et al.Phase I/II study of vaccination with electrofused allogeneic dendritic cells/autologous tumor-derived cells in patients with stageⅣrenal cell carcinoma[J].J Immunother,2007,30(7):749-761.
[5]Pievani A,Borleri G,Pende D,et al.Dual-functional capability of CD3+CD56+CIK cells,a T-cell subset that acquires NK function and retains TCR-mediated specific cytotoxicity[J].Blood,2011,118(12):3301-3310.
[6]Mesiano G,Todorovic M,Gammaitoni L,et al.Cytokineinduced killer(CIK)cells as feasible and effective adoptive immuno therapy for the treatment of solid tumors[J].Expert Opin Biol Ther,2012,12(6):673-684.
[7]张志伟,宋鑫.DC-CIK细胞临床制备规范化研究[J].中国肿瘤,2011,20(2):85-88.
[8]Rutella S,Iudicone P,Bonanno G,et al.Adoptive immunotherapy with cytokine-induced killer cells generated with a new good manufacturing practice-grade protocol[J]. Cytotherapy,2012,14(7):841-850.
[9]Niu Q,Wang W,Li Y,et al.Cord blood-derived cytokineinduced killer cells biotherapy combined with secondlinechemotherapy in the treatment of advanced solid ma lignancies[J].Int Immunopharmacol,2011,11(4):449-456.
[10]Zhang Z,Wang L,Luo Z,et al.Efficacy and safety of cord blood-derived cytokine-induced killer cells in treatment of patients with malignancies[J].Cytotherapy,2015,17(8):1130-1138.
[11]Wang QJ,Wang H,Pan K,et al.Comparative study on anti-tumor immune response of autologous cytokine-induced killer(CIK)cells,dendritic cells-CIK(DC-CIK),and semi-allogeneic DC-CIK[J].C hin J Cancer,2010,29(7):641-648.
[12]Pan Y,Wu Y,Ji J,et al.Effect of cytokine-induced killer cells on immune function in patients with lung cancer[J].Oncol Lett,2016,11(4):2827-2834.
[13]Zhang J,Zhu L,Du H,et al.Autologous cytokine-induced killer cell therapy in lung cancer patients:A retro spectivestudy[J].BiomedPharmacother,2015,70:248-252.
[14]Liu H,Li J,Wang F,et al.Comparative study of different proceduresfortheseparationofperipheralblood mononuclear cells in cytokine-induced killer cell immunotherapy for hepatocarcinoma[J].Tumour Biol,2015,36(4):2299-2307.
[15]Wang M,Cao JX,Pan JH,et al.Adoptive immunotherapy of cytokine-induced killer cell therapy in the treatment of non-small cell lung cancer[J].PLoS One,2014,9(11):e112662.
[16]Betts MR,Brenchley JM,Price DA,et al.Sensitive and viable identification of antigen-specific CD8+T cells by a flow cytometric assay for degranulation[J].J Immunol Methods,2003,281(1-2):65-78.
[17]刘垠子,罗以,谢思琪,等.DC-CIK的抗肿瘤作用及机制的研究进展[J].肿瘤药学,2016,6(2):108-113.
▲通讯作者
[中图分类号]R392.9;R730.2
[文献标识码]A
[文章编号]1673-9701(2016)19-0038-05
收稿日期:(2016-05-26)
[基金项目]吉林省卫生计生科研计划(2014Z015)
Comparative study on anti-tumor effect of different sources of cytokine induced killer cells in vitro
YU HongZHANG GengyueWEI TianxueHE ChunyingLIU Yuxia
Jilin Province Cancer Prevention and Control Institute,Changchun130012,China
[Abstract]Objective To compare difference of the anti-tumor response of CIK cells from peripheral blood of patients with lung cancer and umbilical cord blood in vitro.Methods Peripheral monocytes were isolated from patients with lung cancer,and cord blood monocytes from healthy donors.Isolated cells were cultured and induced as CIK cells in vitro.The anti-tumor activities were measured by MTT assay and flow cytometry.Intracellular staining was used to test the secretion of cytokines.Results The percentage of CD3+,CD3+CD56+and CD3+CD8+cells in cord blood CIK and peripheral blood CIK of patients with lung cancer was increased with the prolongation of culture time,and there was no significant difference between the two groups;After cultured for 21 days,the proliferation rate of cord blood CIK cells and lung cancer patients'peripheral blood CIK cells was(185.76±39.68)%and(254.32±74.60)%,respectively,and there was significant difference between the two group(P=0.0012);The anti-tumor activity of cord blood CIK cells was higher than that of lung cancer patients'peripheral blood CIK cells(effector-target ratio of 10:1,when the target cells were K562 cells P=0.0016;when the target cells were A549 cells P=0.0022).CD107a expression in cord blood CIK cells was higher than CIK cells from the peripheral blood of patients with lung cancer(when the target cells were K562 cells,P=0.0469;when the target cells were A549 cells,P=0.0413);Secretion levels of IFN-γ and TNF-α in cord blood CIK cells were higher than that of CIK cells from lung cancer patients(P=0.0352,P=0.0389);The percentage of apoptotic K562 cells induced by cord blood CIK and CIK cells from lung cancer patients was(25.30±4.87)%and(19.87±5.41)%,respectively.There was no significant difference between them(P=0.2658).Conclusion The phenotype,function and mechanism of action of CIK cells can be detected simultaneously by flow cytometry.This results can provide experimental evidence for clinical application of CIK cells.
[Key words]Cytokine-induced killer cells;Flow cytometry;Immunotherapy;CD107a

