长双歧杆菌耐氧菌株选育及其高密度发酵条件的研究
吕秀明,梁金钟
(哈尔滨商业大学食品科学与工程重点实验室,黑龙江哈尔滨 150076)
长双歧杆菌耐氧菌株选育及其高密度发酵条件的研究
吕秀明,梁金钟*
(哈尔滨商业大学食品科学与工程重点实验室,黑龙江哈尔滨 150076)
通过对长双歧杆菌的紫外诱变,选育出耐氧菌株,命名为L80。以L80为实验菌株,通过单因素实验、响应曲面分析和流加补料培养,确定最优培养基方案。高密度培养优化后的方案是(以质量分数计):大豆蛋白胨4.03%,酵母浸粉2.02%,葡萄糖0.95%,水苏糖1.59%。发酵罐最佳流加方式为:pH6.5,糖浓度保持在6.0~8.0 g/L。最终活菌数达到(1.21±0.03)×1010cfu/mL。
长双歧杆菌,紫外诱变,高密度培养,响应曲面,流加培养
双歧杆菌(Bifidobacterium)是由法国巴斯德研究院的Tissier学者于1899年首次从健康吃母乳婴幼儿的粪便中分离出来的[1]。根据DNA的同源性和糖发酵研究发现,双歧杆菌属共分为24个种,而人类来源的只有12个种,其中能在人体肠道内定植并能用于制备保健食品的双歧杆菌主要有两歧双歧杆菌(Bifidobacterium.bifidum)、青春双歧杆菌(Bifido.adolescentis)、婴儿双歧杆菌(Bifido.infantis)、短双歧杆菌(Bifido.breve)和长双歧杆菌(Bifido.1ongum)5种[2-3]。它是人体肠道内重要的细菌,是一种有益而无害的生理细菌[4],具有免疫调节、抗肿瘤、抗菌消炎、抗衰老、降血脂、营养、护肝、通便等一系列功能[5-7]。
人体内的双歧杆菌要在达到一定数量之后才能发挥其益生作用,产品中的双歧杆菌在保质期内必须保持在106cfu/mL(106cfu/g)以上[8],而且还要在其特定的肠道部位才发挥作用[9]。双歧杆菌对氧气的要求较高,要实现其大规模培养,需要严格控制环境中的含氧量,这给工业化规模生产双歧杆菌制品的厂家带来困难。刘庆玉[10]等人利用紫外诱变得到一株高效木质素降解的菌株;袁辉[11]等人利用紫外诱变获得一株高产他克莫司的菌株。研究以物理诱变的手段,筛选并驯化获得一株耐氧菌株。然后以耐氧菌株为研究对象,通过单因素和响应曲面的手段,对培养基进行优化;以优化后的培养基为基础培养基,通过流加补料发酵培养,从而实现其高密度培养。
1 材料与方法
1.1材料与仪器
长双歧杆菌(Bifido.longum)由哈尔滨商业大学食品工程学院发酵工程实验室提供。
TPY培养基酪蛋白胨12.0 g/L,胰蛋白胨3.0 g/L,大豆蛋白胨3.0 g/L,葡萄糖5.0 g/L,酵母浸粉5.0 g/L,吐温-80 1.0 mL/L,L-半胱氨酸0.5 g/L,混合盐溶液10.0 mL/L,121℃灭菌15 min;
混合盐溶液(100 mL):CaCl20.020 g,KH2PO40.100 g,K2HPO40.100 g,MgSO40.048 g,NaHCO31.000 g,NaCl 0.200 g。
SW-CJ-1FD型单人单面净化工作台苏州净化设备有限公司;PHS-3C型酸度计杭州奥立龙仪器有限公司;V-5000分光光度计上海元析仪器有限公司;SBA-400生物传感分析仪山东省科学院生物研究所。
1.2实验方法
1.2.1紫外诱变将制备好的菌悬液(菌浓度为1.03×107cfu/mL)吸取15 mL,在紫外灯瓦数20 W,照射距离30 cm下进行紫外诱变[12]。用磁力搅拌器分别用紫外灯照射30、40、50、60、70、80、90 s。分别吸取诱变不同时间的菌液,将其稀释101~106倍,吸取0.2 mL涂布,每个稀释梯度做三组平行,37℃静置培养48 h。
1.2.2活菌计数在超净工作台中,将1 mL种子液接入9 mL已灭菌且充有N2的液体培养基中,置于 37℃培养箱中培养20 h后进行活菌计数。将盛有溶化的无菌琼脂培养基试管放置于56℃的恒温水浴中,用无菌注射器分别吸取各个稀释管的溶液1 mL于融化了的琼脂培养基试管中,然后将其平放于盛有冰水的盆中滚动,带菌的溶化培养基在试管内壁立即凝成一薄层。而后置37℃恒温培养箱中培养。每毫升样品中含有的双歧杆菌数量:双歧杆菌的数量(cfu/mL)=1 mL滚管计数的实际平均值×稀释倍数。
1.2.3氮源的选择在TPY培养基基础上,分别考察大豆蛋白胨、酪蛋白胨、牛肉膏、酵母浸粉、胰蛋白胨、蛋白胨、硫酸铵、硝酸钾8种氮源,质量分数为5.0%,对长双歧杆菌生长的影响,选出最优氮源。最优氮源按照质量分数为0.5%、1.0%、2.0%、3.0%、4.0%、5.0%、6.0%、7.0%、8.0%。按2%接种量接种于液体培养基中,初始pH7.0,培养温度37℃,置于恒温箱内静置培养20 h,测定培养液的OD600 nm值。
1.2.4碳源的选择在TPY培养基基础上,分别考察果糖、蔗糖、乳糖、绵白糖、葡萄糖、麦芽糖6种氮源,质量分数为2.0%,对长双歧杆菌生长的影响,选出最优碳源。最优碳源按照质量分数为0.10%、0.25%、0.50%、1.00%、1.50%、2.00%。按2%接种量接种于液体培养基中,初始pH7.0,培养温度37℃,置于恒温箱内静置培养20 h,测定培养液的OD600 nm值。
1.2.5益生元的选择在TPY培养基基础上,分别考察水苏糖、低聚异麦芽糖、低聚果糖3种益生元,质量分数为1.0%,对长双歧杆菌生长的影响,选出最优益生元。最优益生元按照质量分数为0.2%、0.5%、1.0%、1.5%、2.0%。按2%接种量接种于液体培养基中,初始pH7.0,培养温度37℃,置于恒温箱内静置培养20 h,测定培养液的OD600 nm值。
1.2.6响应曲面实验因素水平及其编码
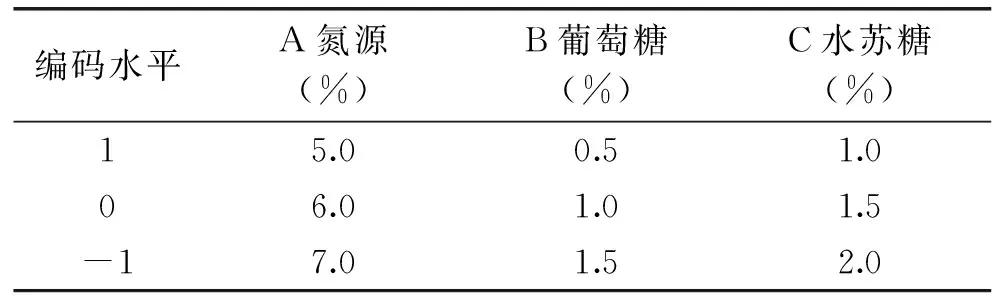
表1 Box-Behnken实验因素水平及其编码
1.2.7生长曲线的测定以G-TPY为基础培养基,按2%的接种量,37℃静置培养,每隔2 h测定菌体浓度、pH、OD600 nm及还原糖浓度,绘制生长曲线。
1.2.8氢氧化铵中和法高密度培养的研究选择质量分数28%的氨水为中和剂,利用1L全自动发酵罐,按最终确定的培养基进行发酵,以不流加中和剂作对照,选择pH5.0、5.5、6.0、6.5、7.0、7.5,20 h后测定菌浓度。
1.2.9流加补料法高密度培养的研究利用发酵罐自动控制功能,实现自动流加补料控制,每12 h添加50 mL 2.4倍浓缩培养基,保持发酵液pH6.5,糖浓度降至2.0、4.0、6.0、8.0 g/L时补加培养基,使发酵液糖浓度保持在2.0~4.0、4.0~6.0、6.0~8.0、8.0~10.0 g/L测定最大活菌数。
2 结果与分析
2.1紫外诱变选育耐氧菌株
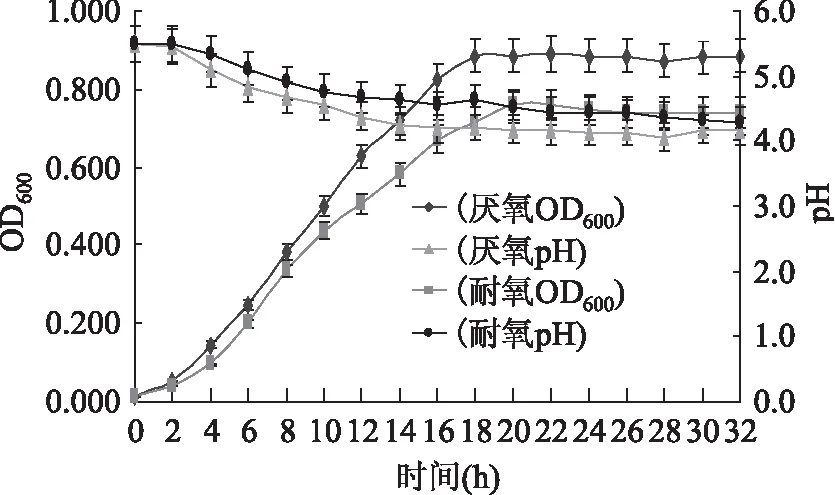
图1 厌氧菌株和耐氧菌株生长曲线对照Fig.1 Contrast between anaerobic bacteria and oxygen-resistant strain growth curve
将诱变后的菌种涂于平板上,37℃有氧培养。然后挑选200株菌接种于试管内,进行有氧静置培养,挑选长势最好的菌株传代培养,连续培养6代以上使其性状稳定,挑选一株长势最好的耐氧菌株进行实验,该菌株命名为L80。
长双歧杆菌为严格厌氧菌,经过紫外诱变具备一定耐氧能力,由图1可知,虽然耐氧菌株没有厌氧菌株长势好,但是具有较好的耐氧能力,可以在三角瓶中静止状态下培养。菌体生长分为延滞期、对数增长期、稳定期及衰减期四个时期。从生长曲线可以看出,在4 h内,为延滞期;4~18 h菌量迅速增长,为对数生长期;20 h后进入稳定期。对数增长期的后期菌体细胞的存活率和活性最强。所以长双歧杆菌以培养18~22 h为收获的最佳时期。
2.2长双歧杆菌的高密度培养
2.2.1培养基的优化
2.2.1.1氮源的选择由图2可知,有机氮源比无机氮源长势好,因为有机氮源中含有长双歧杆菌直接能利用的氨基酸等物质,无机氮源需要合成或转化才能得到。而使用有机混合氮源,比单独使用有机氮源或者无机氮源高,因为酵母粉中有氨基酸、微量元素、生长因子等营养物质,能促进长双歧杆菌的生长,所以选择大豆蛋白胨和酵母粉两种氮源。要使长双歧杆菌大量增殖,需要营养更加平衡和丰富的培养基,因此两者必须按照一定的比例混合。采用不同的大豆蛋白胨和酵母粉的比例,维持氮源总量不变进行实验。由图3、图4可知,最终氮源质量分数6.0%,大豆蛋白胨:酵母浸粉比例2∶1,有利于长双歧杆菌的生长。

图2 氮源种类对长双歧杆菌生长影响Fig.2 Effect of nitrogen source on the growth of B.longum
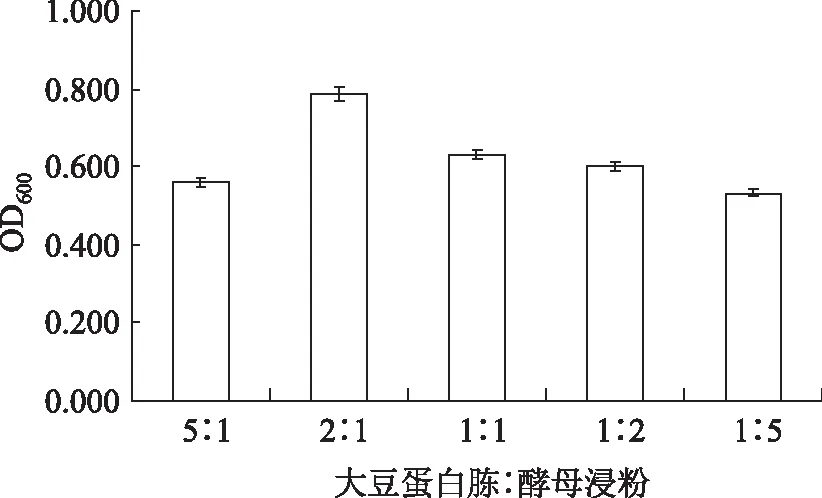
图3 氮源比例对长双歧杆菌生长影响Fig.3 Effect of nitrogen ratio on the growth of B.longum

图4 氮源质量分数对长双歧杆菌生长影响Fig.4 Effect of nitrogen mass fraction on the growth of B.longum
2.2.1.2碳源的选择构成细胞物质的基础是碳源,也是发酵培养基中的主要物质。碳源是否合适,决定长双歧杆菌吸收和利用碳源时消耗的能量是否适宜。如果碳源不适合,消耗能量过大,不利于长双歧杆菌的增殖。由图5可知,碳源为葡萄糖时,菌浓度达到最大,最适合菌体生长。由图6可知,葡萄糖的质量分数1.00%时最适合。

图5 碳源种类对长双歧杆菌生长影响Fig.5 Effect of carbon source on the growth of B.longum

图6 碳源质量分数对长双歧杆菌生长影响Fig.6 Effect of carbon mass fraction on the growth of B.longum
2.2.1.3益生元的选择由图7可知,水苏糖、低聚异麦芽糖、低聚果糖均高于对照,说明功能性低聚糖类均能促进长双歧杆菌的生长,可增殖双歧杆菌等有益菌。由图8可知,水苏糖质量分数为1.5%时最合适。

图7 益生元种类对长双歧杆菌生长影响Fig.7 Effect of prebiotics on the growth of B.longum

图8 水苏糖质量分数对长双歧杆菌生长影响Fig.8 Effect of prebiotics mass fraction on the growth of B.longum

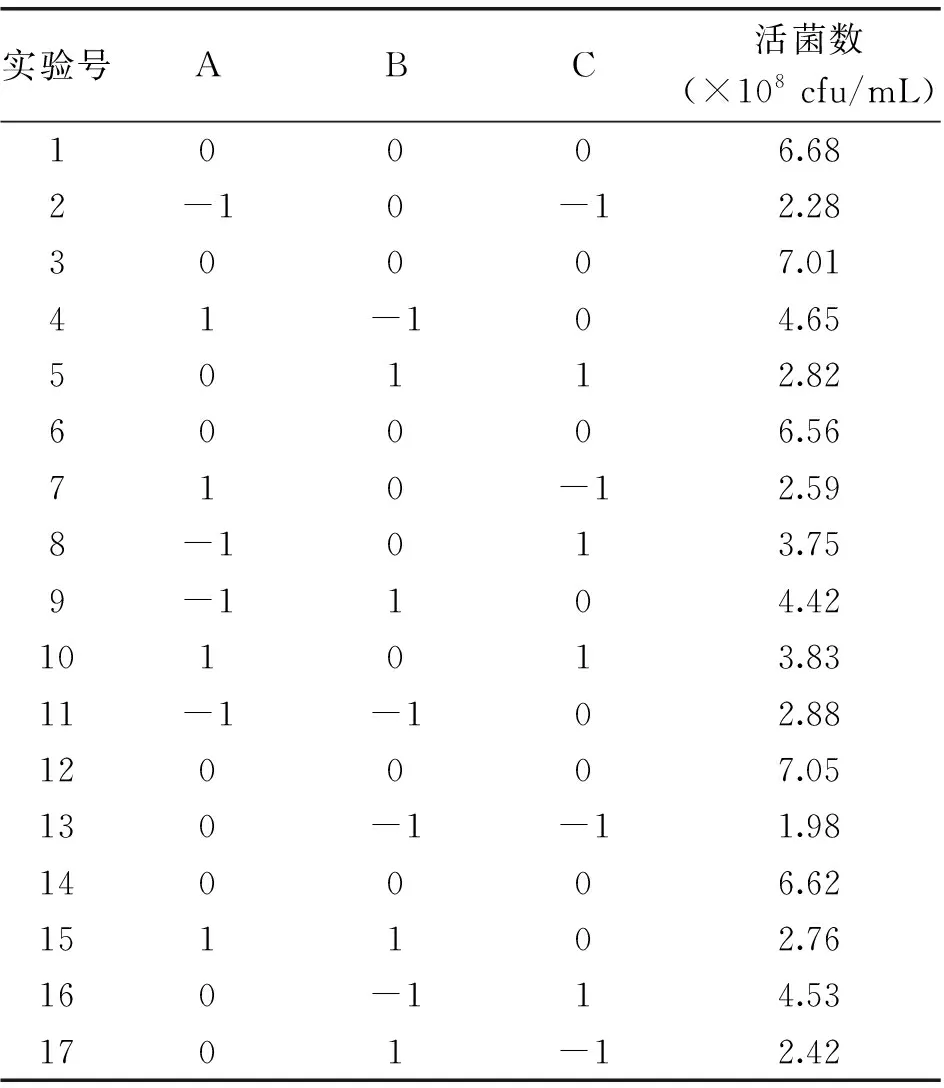
表2 Box-Behnken实验设计及结果

表3 模型回归方程方差分析
由表3可知,B、C是显著的,AB、BC交互作用显著。采用Design-Expert软件的Optimization模块,对培养基进行优化,在各个物质实验添加量的范围内,预测氮源6.05%,葡萄糖0.95%,水苏糖1.59%,长双歧活菌数最大6.86×108cfu/mL。采用上述最佳培养基,实际获得三组平行数据,平均活菌数为(7.42±0.05)×108cfu/mL,与预测值接近,模型能较好的预测实际发酵液的活菌数。优化后的培养基命名为G-TPY。
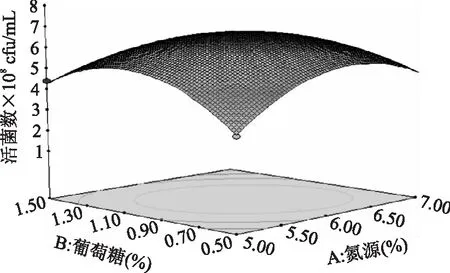
图9 氮源与葡萄糖对长双歧杆菌生长影响的响应面图Fig.9 Surface for the effect of nitrogen and glucose on the growth of B.longum

图10 氮源与水苏糖对长双歧杆菌生长影响的响应面图Fig.10 Surface for the effect of nitrogen and stachyose on the growth of B.longum
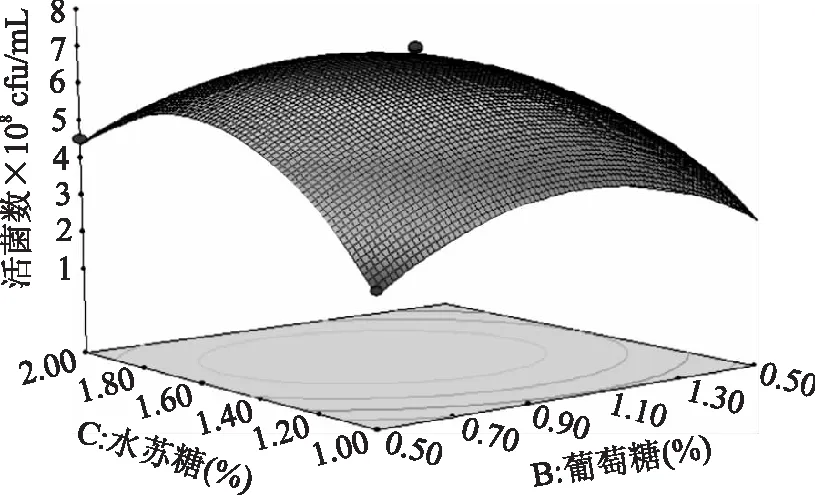
图11 葡萄糖与水苏糖对长双歧杆菌生长影响的响应面图Fig.11 Surface for the effect of glucose and stachyose on the growth of B.longum
2.2.3高密度培养技术的研究
2.2.3.1生长曲线的测定由生长曲线可知,双歧杆菌在发酵罐中生长良好,培养20 h后发酵液的pH降至4.0左右,最大活菌数不再增加,可能由于较低的pH会抑制双歧杆菌增殖。可以通过流加碱的方式调节生长过程中发酵液的pH,以提高其稳定期菌体密度。补料时间根据生长曲线中糖的消耗来确定。

图12 发酵罐培养pH、活菌数、OD600、残糖量的变化曲线Fig.12 The change curves of pH,the number of living bacterium,the OD600,the amount of residual sugar in fermentation tank culture
2.2.3.2氢氧化铵中和法高密度培养的研究由图13可知,与不添加中和剂的对比,流加氨水控制pH6.5时长双歧杆菌的菌体密度较高。过高和过低的pH都不适宜长双歧杆菌生长,而在菌体培养过程中,pH会逐渐降低,抑制菌体生长,所以通过加入氢氧化铵来保持pH稳定以去除酸胁迫作用。用氢氧化铵作为中和剂,在中和酸后产生的铵离子能被用作氮源,减少盐胁迫作用。最终菌浓度达到(5.23±0.02)×109cfu/mL。
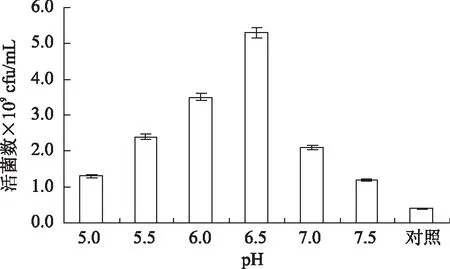
图13 pH对长双歧杆菌生长的影响Fig.13 Effect of pH on growth of B.longum
2.2.3.3流加补料法高密度培养的研究结果如图14,当糖浓度保持在6.0~8.0 g/L时,活菌数最多。最佳流加方式为:pH6.5,糖浓度保持在6.0~8.0 g/L。三组验证实验,活菌数均可达到(1.21±0.05)×1010cfu/mL,实验方案可行。

图14 糖浓度对长双歧杆菌生长的影响Fig.14 Effect of glucose concentration on growth of B.longum
3 结论
在照射距离30 cm,紫外灯瓦数20 W条件下,长双歧杆菌紫外诱变的最佳方案为:照射时间80 s,得
到一株耐氧菌株L80。以L80菌株为出发菌株,进行培养基优化,优化后的方案为:大豆蛋白胨4.03%,酵母浸粉2.02%,葡萄糖0.95%,水苏糖1.59%,得到最优培养基G-TPY。以G-TPY为基础培养基,进行流加补料发酵,最佳流加方式为:pH6.5,糖浓度保持在6.0~8.0 g/L。活菌数提高到(1.21±0.05)×1010cfu/mL。
[1]刘兰,曹郁生,黄筱萍.双歧杆菌选择计数方法的研究进展[J].食品与发酵工业,1999,25(4):61-63.
[2]陈文学,史俊华.双歧杆菌的研究进展[J].中国微生态学杂志,2000(12):298-300.
[3]Requena T,Burton J,Matsuki T,et al.Identification,detection,and enumeration of human bifidobacterium species by PCR targeting the transaldolase gene[J].Appl Environ Microbiol,2002(68):2420-2427.
[4]吕桂善,刘宁,周龙江,等.双歧杆菌的研究热点[J].中国乳业,2002(3):24-27.
[5]李俊洁,陈庆森.双歧杆菌调理和改善肠道相关疾病作用的研究进展[J].食品科学,2011,32(23):326-332.
[6]Al-Sherajia S H,Ismaila A,Manap M Y,et al.Hypocholesterolaemic effect of yoghurt containing Bifidobacterium pseudocatenulatum G4 or Bifidobacterium longum BB536[J].Food Chemistry,2012,135(2):356-361.
[7]Wu Qianqian,You H J,Ahn H J,et al.Changes in growth and survival of Bifidobacterium by coculture with Propionibacterium in soy milk,cow’s milk,and modified MRS medium[J].International Journal of Food Microbiology,2012,157(1):65-72.
[8]Catia M,Cidalia P,Aarian H,et al.Review on fermented plant materials as carriers and sources of potentially probiotic lactic acid bacteria e with an emphasis on table olives[J].Trends in Food Science & Technology,2012,26(1):31-42.
[9]McMaster L D,Kokott S A,Slatter P.Micro-encapsulation of bifidobacterium lactis for incorporation into soft foods[J].World J microbial biotechnol,2005,21(5):723-728.
[10]刘庆玉,姚影,张敏.紫外诱变筛选高效木质素降解菌株的研究[J].可再生能源,2010,28(4):58-61.
[11]袁辉,张新宜,王欣荣.抗性突变他克莫司高产菌株的选育[J].微生物杂志,2014,34(5):81-86.
[12]梁金钟,李雯,王风青.产γ-氨基丁酸乳酸菌的筛选及诱变育种[J].食品科学,2013,34(23):228-232.
Breeding of oxygen-resistant Bifidobacterium longum and its high-density fermentation conditions
LV Xiu-ming,LIANG Jin-zhong*
(Key Laboratory for Food Science and Engineering,Harbin University of Commerce,Heilongjiang Province,Harbin 150076,China)
Through the method of ultraviolet mutagenesis to Bifidobacterium longum,a strain was screened with resistance ability to oxygen,the strain was named L80.Using L80 as the test strain,the optimum culture medium was determined by single factor,response surface and flow and feeding method.High density culture medium optimization formula was(mass fraction)soy peptone 4.03%,yeast extract powder 2.02%,glucose 0.95% and stachyose 1.59%.The optimal fed-batch cultivation was:the sugar concentration was kept in 6.0~8.0 g/L,pH6.5,and the final viable bacteria number was reached(1.21±0.03)×1010cfu/mL.
Bifidobacterium longum;ultraviolet mutagenesis;high density cultivation;response surface;fed-batch cultivation
2015-09-07
吕秀明(1990-),女,硕士,研究方向:应用微生物与发酵工程,E-mail:lvxiuming0622@163.com。
梁金钟(1957-),男,本科,教授,研究方向:应用微生物与发酵工程,E-mail:Ljz2050@126.com。
TS201.3
A
1002-0306(2016)07-0159-05
10.13386/j.issn1002-0306.2016.07.023

