高效液相色谱测定樱桃酚类物质
姜 楠,王 蒙,韦迪哲,冯晓元
(北京农业质量标准与检测技术研究中心、农业部农产品质量安全风险评估实验室(北京)、农产品产地环境监测北京市重点实验室,北京 100097)
高效液相色谱测定樱桃酚类物质
姜楠,王蒙,韦迪哲,冯晓元*
(北京农业质量标准与检测技术研究中心、农业部农产品质量安全风险评估实验室(北京)、农产品产地环境监测北京市重点实验室,北京 100097)
本文建立了樱桃多酚物质的高效液相色谱分析方法。将固相萃取技术用于樱桃多酚物质提取过程,优化了前处理提取条件、Waters Oasis HLB固相萃取柱萃取条件以及色谱条件,在此基础上使用高效液相色谱测定了樱桃酚类物质成分及含量。最终确定樱桃多酚提取溶剂为60%甲醇-2%甲酸;HLB固相萃取小柱的淋洗液为10%甲醇-0.1%甲酸、洗脱液为乙腈-5%甲酸,此条件下多酚回收率在70%以上;确定在40℃柱温、2%甲酸水溶液和乙腈为流动相的条件下进行梯度洗脱,结果表明樱桃中含有香草酸、儿茶素、咖啡酸、芦丁、对香豆酸等多种多酚成分,含量在0.37~240.62(mg/kg DW)之间。该方法快速、灵敏、杂质干扰少,樱桃多酚类物质峰分离度较好。
高效液相色谱,固相萃取,多酚,樱桃
樱桃为多年生木本落叶果树,属蔷薇科(Rosaceae),李属(Prunus),樱亚属(Subgenus cerasus)。樱桃果实色泽鲜艳、香味浓郁、营养丰富,因富含多种有效成分而具有一定的医疗保健价值,其中尤以酚类较为突出。已有研究表明樱桃包含多种酚类成分,包括黄酮类(儿茶素、表儿茶素、花青素、原花青素等)和酚酸类(肉桂酸、绿原酸、咖啡酸等)[1]。多酚物质是具有苯环并结合多个羟基化学结构的物质总称,一般作为植物的次生代谢产物,对植物的生长发育和调节、基因的诱导表达、信号传导等都有一定的影响[2-3]。且多酚成分不仅显著影响果实的抗氧化作用[4-5],还具有降低癌症风险[6]以及抵抗神经性疾病[7]等多种功效。
近年来天然来源的多酚类物质常被作为抗氧化剂、抑菌剂、防腐剂,因此不同植物组织中多酚成分的分离鉴定已成为研究热点。目前国内外多采用分光光度计[8]对樱桃酚类物质进行分析与检测,分光光度计主要用于同类结构的总酚测定,不能区分结构类似的单一酚类物质含量。而HPLC不仅具有快速方便、准确度高的优点,而且可以定性定量检测单一酚类物质,虽然采用HPLC测定樱桃多酚已有报道[9-10],但并未见对前处理过程、流动相、柱温等条件进行优化的研究。此外,传统的液相色谱法中样品前处理过程费时费力、纯化效果不理想,而且处理过程易造成酚类物质损失。固相萃取技术具有萃取速度快、实验成本低、环境污染小、能有效的将分析物与干扰组分分离等优点,且操作简单。本文将固相萃取技术与前处理相结合,对樱桃多酚提取液进行纯化,筛选了固相萃取的淋洗和洗脱条件,实现对目标组分与杂质之间的高选择性分离。在此基础上,分析了常见的樱桃品种中的多酚物质的组成及含量,以期为樱桃多酚的开发利用及樱桃制品的质量控制提供基础数据。
1 材料与方法
1.1材料与仪器
拉宾斯(Lapins)、先锋(Van)、红灯(Hongdeng)、萨米脱(Summit)鲜樱桃于市场购买,酸樱桃采于北京农林科学院果树研究所。选取大小均匀、成熟度均一、无机械损伤、无病虫害的果实,切块去核,随后真空冷冻干燥48 h,冻干条件为-50℃、30 Pa。樱桃冻干样研磨成粉,过40目筛,置于密封袋内,于-20℃保存备用。
14种标准物质:没食子酸(Gallic acid)、香豆酸(Coumalic acid)、儿茶素(Catechin)、绿原酸(Chlorogenicacid)、咖啡酸(Caffeic acid)、香草酸(Vanillic acid)、表儿茶素(Epicatechin)、丁香酸(Syringic acid)、对香豆酸(p-Coumaric acid)、芦丁(Rutin)、芥子酸(Sinapic acid)、槲皮素(Quercetin)、肉桂酸(trans-Cinnamic acid)、山奈酚(Kaempherol)北京索莱宝生物科技有限公司,纯度>98%。
乙腈、甲醇、乙酸乙酯、甲酸均为色谱纯,乙酸、磷酸为分析纯。
Waters 2690高效液相色谱仪、Waters 2487紫外检测器、Waters Symmetry C18column(5 μm,4.6×250 mm)色谱柱Waters公司;3K-15高速冷冻离心机sigma公司;KQ-300VDV超声清洗器昆山市超声仪器有限公司;RE-5205旋转蒸发仪上海亚荣生化仪器厂;FD-1A-50冷冻干燥机北京华圣科仪实验设备有限公司;CM24氮吹仪北京成萌伟业科技有限公司;TV-1901紫外分光光度计北京普析通用仪器有限公司。
1.2实验方法
1.2.1樱桃酚类物质提取以拉宾斯樱桃品种进行前期检测方法的开发实验,之后选用其他樱桃品种进行实际样品测定。具体过程如下:取1.0 g拉宾斯樱桃冻干粉于50 mL离心管,加入体积分数60%甲醇-2%甲酸水溶液20 mL,涡旋,于室温下超声提取20 min,随后低温离心(10000 r/min,10 min,-10℃),将上清液倒出,重复提取两次,合并提取液,待测样品总酚含量。
1.2.1.1不同体积分数的甲醇溶液对多酚含量的影响按照上述提取过程,考察体积分数分别为50%、60%、70%甲醇-2%甲酸水溶液对总酚含量的影响,以纯水作为空白对照,其他提取条件不变。
1.2.1.2不同类型酸溶液对多酚含量的影响按照上述提取过程,考察不同类型的酸对总酚含量的影响,提取溶剂为60%甲醇,分别添加2%甲酸、2%乙酸、2%柠檬酸,以60%甲醇作为空白对照,其他提取条件不变。
1.2.2总酚含量测定总酚含量的测定参照Singleton和Rossi的方法并略做改动[11]。准确称取20 mg没食子酸标准品,加水溶解并定容至50 mL,得到400 μg/mL的没食子酸标准溶液。分别精确吸取0、0.25、0.50、0.75、1.00、1.25 mL于10 mL容量瓶中,用蒸馏水稀释至刻度线,得到溶液浓度分别为 0、10、20、30、40、50 μg/mL。分别吸取上述没食子酸溶液1.0 mL,加入十倍稀释的福林酚试剂0.5 mL,摇匀,静置8 min,加入10%碳酸钠溶液4 mL,摇匀,再加水至总体积为10 mL,充分混匀后,在室温下避光静置40 min,于765 nm处测定样品吸光度,以没食子酸标准溶液质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.2.3HPLC分析条件色谱柱:Waters Symmetry C18column(5 μm,4.6 mm×250 mm),流速:0.8 mL/min,柱温:40℃,二极管阵列检测器(PDA)检测波长:280、320 nm,进样量:10 μL,流动相洗脱条件见表1。

表1 流动相系统配比及梯度洗脱程序
1.2.3.1不同种类酸的选择在流动相A中分别加入体积分数2%甲酸、1%乙酸、0.5%磷酸,流动相B为乙腈,柱温为40℃其他条件不变,重复进样三次,选择最佳的酸作为流动相A中的添加成分。
1.2.3.2柱温对酚类分离效果的影响考察不同柱温对酚类物质分离效果的影响,分别设置柱温25、30、35、40℃,流动相A为2%甲酸-水,流动相B为乙腈,其他条件不变,重复进样三次,选择最佳的洗脱柱温。
1.2.4HLB小柱萃取方法优化选用Waters Oasis HLB(60 mg,3 mL)小柱对樱桃提取液进一步纯化,去除杂质以便用于下一步酚类样品组分分析。将樱桃提取液于40℃条件下旋转蒸发浓缩至一定体积,定容至20 mL,待上固相萃取小柱。先用3 mL甲醇、3 mL水活化,5 mL样品过柱,3 mL淋洗液过柱以去除杂质,5 mL洗脱液将目标物洗脱出来,收集洗脱液。固定洗脱液为乙腈-5%甲酸,分别考察淋洗液为水-0.1%甲酸、5%甲醇-0.1%甲酸、10%甲醇-0.1%甲酸对多酚回收率的影响;固定淋洗液为10%甲醇-0.1%甲酸,分别考察洗脱液为甲醇-5%氨水、甲醇-2%甲酸、甲醇-5%甲酸、乙腈-2%甲酸、乙腈-5%甲酸对多酚回收率的影响。将洗脱液于氮吹仪中35℃条件下吹干,而后用体积分数50%甲醇定容,过0.22 μm滤膜,上HPLC测定。
2 结果与分析
2.1前处理对樱桃总酚含量的影响
多酚的化学性质、存在形式、提取方法以及提取过程中存在的干扰物质等因素都会影响多酚类物质的有效提取。生产中多用于多酚类物质的提取方法是溶剂浸提法,该方法也最为经济、便捷且易操作,通常采用甲醇、乙醇、丙酮或醇水混合溶剂作为提取剂,常根据溶剂的极性作为选择依据。在提取过程中,为了防止多酚类物质的损失,常添加酸性溶剂如甲酸、盐酸等,充入氮气并与避光条件下提取。本文考察了甲醇浓度和向其添加不同类型的酸对多酚类物质含量的影响,发现甲醇浓度和酸种类可显著影响总酚含量。
2.1.1甲醇浓度对总酚含量的影响按照1.2.2所述方法绘制总酚含量的标准曲线为Y=0.0082X+0.0415(R2=0.9931)。
一定浓度的甲醇溶剂常被用作多酚类、黄酮类物质的提取,主要是因为水分使植物细胞溶胀,促使提取溶剂有效地详细胞内渗透,从而增大提取率。图1所示为溶剂浓度对樱桃总酚含量的影响,从图中可以看出与纯水相比50%~70%的甲醇均能有效地提取酚类物质,60%的甲醇略高于其他两个浓度,此时总酚含量为(4.28±0.02)mg/g DW,故选择60%甲醇作为提取溶剂。

图1 甲醇浓度对总酚含量的影响Fig.1 Effects of methanol concentration on total phenolic content
2.1.2酸种类对总酚含量的影响在提取过程中加酸可破坏多酚与蛋白质、脂质、多糖之间的氢键及疏水作用力,从而使酚类被更多的释放出来。此外,多酚类物质在酸性环境下较稳定,且酸可在一定程度上沉淀杂质[12],因此本文考察了不同种类的酸对多酚含量的影响,结果如图2所示。从图中可以看出,不同酸均在一定程度上增大了总酚含量,其对总酚含量影响顺序依次为甲酸>柠檬酸>乙酸。其中,添加甲酸时总酚含量为(4.26±0.03)mg/g,故选择甲酸来提供酸性环境。
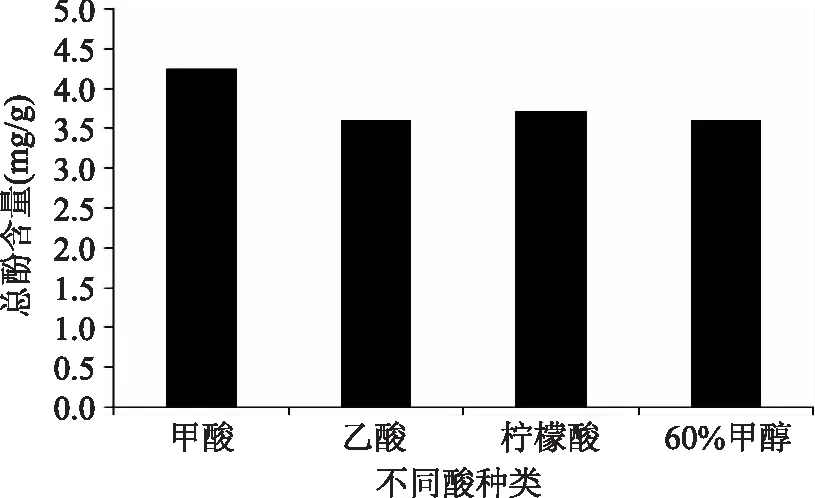
图2 酸种类对总酚含量的影响Fig.2 Effects of acid on total phenolic content
2.2色谱条件优化
本实验选用通用性较强的C18色谱柱对多酚类物质进行分离。由于多酚物质特别是酚酸类易分解,因而常出现色谱峰拖尾、变宽和不对称等现象,在流动相中加入适量的酸性抑制剂可抑制此类化合物的电离,改善峰形。本文考察了在液相分析中常用的甲酸、乙酸、磷酸三种酸对多酚分离效果的影响。咖啡酸、香草酸、表儿茶素和丁香酸四种物质出峰时间非常接近,选用乙酸和磷酸时色谱峰的分离效果不佳,四种物质保留不完全,而且可能由于磷酸较强的缓冲作用,出现较多杂峰。添加甲酸时,14种标准物质分离效果较好,故选用2%甲酸作为抑制剂。
根据色谱分离原理,柱温对色谱峰分离影响较为明显。根据目标物自身结构性质,有些物质在高柱温下易分离,有些物质在低柱温下易分离。本文考察了在25、30、35、40℃四个温度下的多酚分离效果。结果表明随着色谱柱温度的逐步升高,色谱峰的出峰时间逐步提前,这与文献研究结果一致。当色谱柱温度较低时,香草酸、表儿茶素没有保留,且出现很多杂峰。温度升到35℃时香草酸、表儿茶素已经出峰,但分离效果不理想。当柱温升到40℃时,咖啡酸、香草酸、表儿茶素和丁香酸四种物质可完全分开,没有其他杂峰,故柱温选择40℃。
按照优化后的色谱条件将14种标准物质混合溶液上机测定,图3为标准品的色谱图,表2列出了14种标准物质的名称、保留时间、最大吸收波长。

图3 多酚标准品HPLC图谱Fig.3 Chromatogram of mixed polyphenols standards
2.3HLB柱萃取条件优化
固相萃取技术常作为化学分离和纯化的手段应用于生物医学、食品分析、农兽药残留前处理过程、有机合成等众多领域,该技术主要是目标物与吸附剂之间通过疏水作用力、离子交换作用以及物理吸附等方式达到分离或纯化的目的[13]。固相萃取的主要过程是保留和洗脱,首先目标物被保留在吸附剂上,而后通过极性较强的溶剂将目标物与吸附剂分离从而被洗脱下来。吸附剂本身是完全离子化的状态,目标物必须完全离子化才可以保证其被吸附剂完全吸附保留,因此常在萃取过程中加入不同浓度的酸调节pH以改变目标物、吸附剂的离子化或质子化程度。此外,洗脱剂的极性大小及种类也尤为重要[14]。
2.3.1HLB柱淋洗液的选择样品上样后,目标物和杂质同时被吸附在吸附剂上,应选择适当浓度的有机溶剂或水将杂质洗去。通过调节有机溶剂的强度及体积尽可能多的去除杂质,本文考察了纯水、低浓度甲醇对酚类的淋洗效果,结果如表3所示。使用纯水、5%甲醇淋洗时部分多酚回收率较低,10%甲醇作为淋洗液时,酚类物质的回收率均在70%以上。

表2 14种酚类标准物质
2.3.2HLB柱洗脱液的选择一般根据目标物的化学结构和性质以及洗脱溶剂的极性来选择适当的洗脱液。在固相萃取时,常用作多酚物质的洗脱溶剂有甲醇、乙腈、乙酸乙酯、丙酮以及两种以上混合溶剂,但甲醇、乙腈最为常见,本文重点考察了甲醇和乙腈在添加不同浓度的甲酸和氨水时对多酚回收率的影响,结果见表4。当添加氨水时,可能与酚酸发生不可逆反应,导致几种多酚未能回收。无论是甲醇还是乙腈,添加5%甲酸的多酚回收率整体高于2%的甲酸,且乙腈-5%甲酸整体上回收率要高于甲醇-5%甲酸。因此选择乙腈-5%甲酸作为洗脱液。
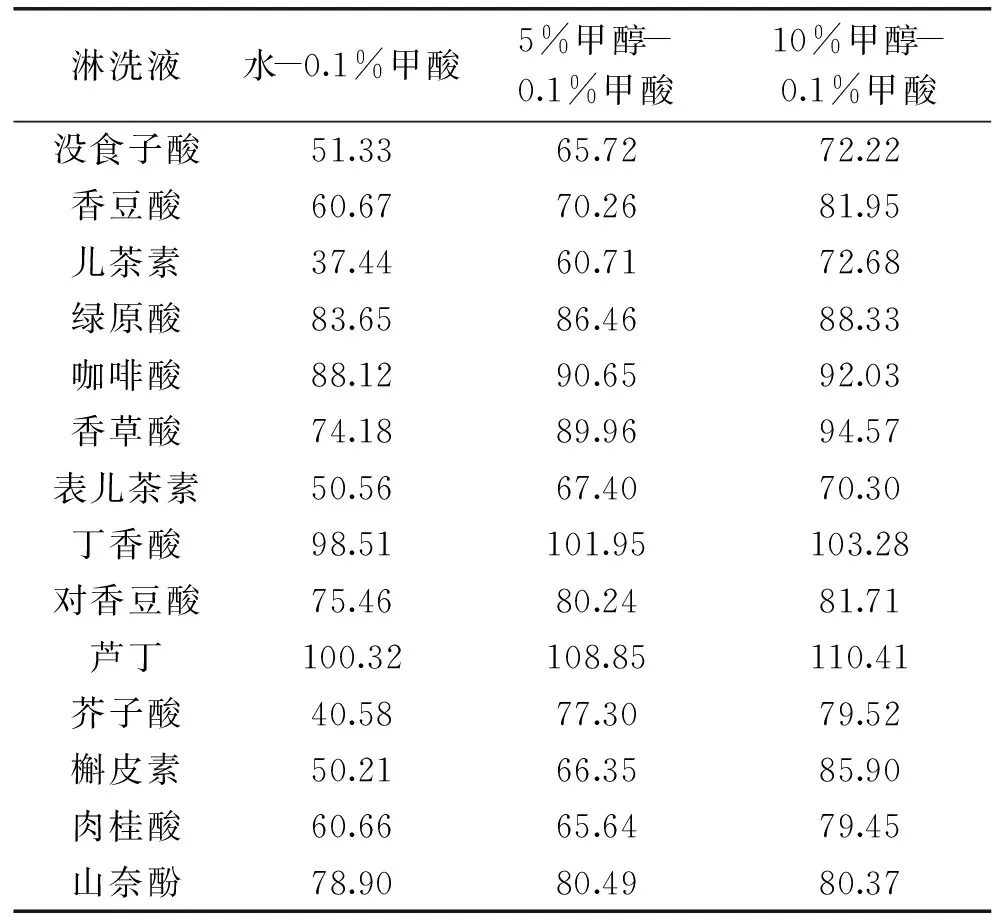
表3 多酚回收率(%)
2.4方法验证
配制质量浓度为10 mg/L的14种多酚混合标准溶液,并逐次稀释成系列混合标准溶液,按照优化后的色谱条件进行测定,以标准溶液的质量浓度(X)为横坐标,色谱峰面积(Y)为纵坐标绘制标准曲线,所得回归方程、线性范围及相关系数见表5。各标准物质线性关系良好,相关系数均大于0.9990。将混合标准溶液稀释后进样,以3倍信噪比计算得多酚物质的检出限(见表5)。取14种多酚的标准溶液,连续进样6次进行测定,标准溶液中14种多酚峰面积的RSD均小于6.6%,表明仪器的精密度良好,满足测定要求。
向樱桃样品中添加一定体积的已知浓度的混合标准品溶液,按照优化的前处理方法及色谱条件进行加标回收率实验,根据标准曲线计算各酚类物质的含量,平行测定3份,取平均值。多酚样品加标回收率均在70%以上,RSD均小于10.0%。方法学考察结果表明本HPLC方法具有很好的准确性和重现性,可以用于实际样品分析。

表4 多酚回收率(%)

表5 检测方法线性、精密度及回收率实验结果

表6 不同樱桃品种多酚类物质的含量(mg/kg干重)
偏低,酸樱桃以绿原酸、芥子酸、表儿茶素、咖啡酸、对香豆酸为主。
3 结论
本文以拉宾斯(Lapins)鲜樱桃冻干粉为原料,经过对样品前处理方法、固相萃取条件以及色谱条件的优化,使用高效液相色谱建立了樱桃多酚物质的检测方法,同时对市场流通中常见的樱桃品种进行了定性定量分析。经过对前处理条件的优化,确定提取溶剂为60%甲醇-2%甲酸,HLB固相萃取小柱的淋洗液为10%甲醇-0.1%甲酸、洗脱液为乙腈-5%甲酸,此条件下多酚回收率在70%以上。当柱温为40℃、流动相为2%甲酸水溶液和乙腈时多酚物质峰分离度较好。不同樱桃品种所含酚类物质大致相同,共检出6~8种多酚,包括香草酸、香豆酸、儿茶素、表儿茶素、芦丁、对香豆酸等,但在含量上有所差异,在0.37~240.62(mg/kg 干重)之间。
[1]Ballistreri G,Continella A,Gentile A,et al.Fruit quality and bioactive compounds relevant to human health of sweet cherry(Prunus avium L.)cultivars grown in Italy[J].Food Chemistry,2013,140:630-638.
[2]Usenik V,Fajt N,Mikulic-Petkovse M,et al.Sweet cherry pomological and biochemical characteristics influenced by rootstock[J].Journal of Agricultural and Food Chemistry,2010,58:4928-4933.
[3]Naczk M.,Shahidi F.Phenolics in cereals,fruits and vegetables:Occurrence,extraction and analysis[J].Journal of Pharmaceutical and Biomedical Analysis,2006,41(5):1523-1542.
[4]Serra AT,Duarte RO,Bronze MR,et al.Identification of bioactive response in traditional cherries from Portugal[J].Food Chemistry,2011,125:318-325.
[5]Usenik V,FabcicJ,Stampar F.Sugars,organic acids,phenolic composition and antioxidant activity of sweet cherry(Prunus avium L.)[J].Food Chemistry,2008,107:185-192.
[6]Kang SY,Seeram NP,Nair MG,et al.Tart cherry anthocyanins inhibit tumor development in ApcMin mice and reduce proliferation of human colon cancer cells[J].Cancer Letters,2003,194:13-19.
[7]Kim DO,Heo HJ,Kim YJ,et al.Sweet and sour cherry phenolics and their protective effects on neuronal cells[J].Journal of Agricultural and Food Chemistry,2005,53:9921-9927.
[8]王贤萍,段泽敏,戴桂林,等.甜樱桃主要栽培品种多酚含量的测定与品质分析[J].中国农学通报,2011,13:173-176.
WANG Xian-ping,DUAN Ze-min,DAI Gui-lin.Polyphenol Quantitative Analysis and Quality Evaluated in Fruit of Sweet Cherry Cultivars[J].Chinese Agricultural Science Bulletin,2011,13:173-176.
[9]Liu Y,Liu X,Zhong F,et al.Comparative study of phenolic compounds and antioxidant activity in different species of cherries[J].Journal of Food Science,2011,76:633-638.
[10]Usenik V,Fabcic J,Stampar F.Sugars,organic acids,phenolic composition and antioxidant activity of sweet cherry(Prunus avium L.)[J].Food Chemistry,2008,107:185-192.
[11]Singleton VL,Rossi JA.Colorimetry of total phenolics with phosphonolybdic-phosphotungsic acid reagents[J].American Journal of Enology and Viticulture,1965,16:144-158.
[13]刘红,曾建勇,温贤有,等.固相萃取技术及其影响因素[J].现代农业科技,2010,11:351-354.
[14]Mülek M.,Högger P.Highly sensitive analysis of polyphenols and their metabolites in human blood cells using dispersive SPE extraction and LC-MS/MS[J].Anal Bioanal Chemistry,2015,407:1885-1899.
2.5樱桃样品分析
本文方法研究时所用樱桃品种为拉宾斯(Lapins),增加先锋(Van)、红灯(Hongdeng)、萨米脱(Summit)以及酸樱桃四种樱桃品种的检测。五个樱桃品种共检出6~8种多酚,由表6可以看出,五种樱桃均未检出没食子酸和肉桂酸。只有酸樱桃检出含有一定量的槲皮素、山奈酚,其他四种樱桃未检出。五个樱桃品种所含多酚种类大致相近,但在含量上存在一定差异,其中拉宾斯主要含有表儿茶素、芦丁、香豆酸、儿茶素及香草酸等,先锋主要含有儿茶素、表儿茶素、香豆酸、芦丁,红灯中的表儿茶素及芦丁含量较高,萨米脱中检出的多酚种类的含量普遍
Determination of polyphenols in cherry by high-performance liquid chromatography
JIANG Nan,WANG Meng,WEI Di-zhe,FENG Xiao-yuan*
(Beijing Research Center for Agricultural Standards and Testing(BRCAST),Risk Assessment Lab for Agro-products(Beijing),Ministry of Agriculture.P.R.China, Beijing Municipal Key Laboratory of Agriculture Environment Monitoring,Beijing 100097,China)
HPLC was applied to separate and determine polyphenols in cherry.The conditions of pretreatment,solid-phase extraction and chromatography were investigated.The optimal pretreatment and chromatographic separating conditions were established:extraction solvent was 60% methanol(2% formic acid),the column leacheate was 10% methanol(0.1% formic acid),column eluent was acetonitrile(5% formic acid).Under this condition,the recovery of the polyphenols was higher than 70%.Meanwhile,mobile phase was water(2% formic acid)and acetonitrile,column temperature was 40℃.Through comparison with standar sample,vanillic acid,catechin,caffeic acid,ruitin,p-coumaric acid was detected in cherry.The content of the polyphenols was in the range of 0.365~240.617(mg/kg DW).This method was rapid,sensitive,simple,accurate and less impurity interference,and rhe polyphenols peaks were separated well.
high performance liquid chromatography(HPLC);solid-phase extraction;polyphenols;cherry
2015-11-05
姜楠(1988-),女,硕士,实习研究员,研究方向:农产品质量安全与标准,E-mail:jiangnan_fx@163.com。
冯晓元(1965-),女,博士,研究员,研究方向:果品质量与安全,E-mail:fengxiaoyuan2014@126.com。
公益性行业(农业)科研专项(201303075);北京市自然科学基金(6154023);北京农业质量标准与检测技术研究中心开放课题(zbzxkfkt201504)。
TS201.1
B
1002-0306(2016)07-0288-06
10.13386/j.issn1002-0306.2016.07.047

